NF⁃кBp65和H IF⁃1α在肾透明细胞癌中的表达及意义
那磊,吴斌
(中国医科大学附属盛京医院泌尿外科,沈阳 110004)
肾癌是泌尿系统肿瘤中常见的恶性肿瘤,透明细胞癌由肾小管上皮发生,是主要的病理类型。肿瘤细胞胞质内含大量胆固醇,在切片过程中溶解,故胞质在镜下呈透明状。肾透明细胞癌的治疗主要为手术治疗,对放化疗不敏感。其发病机制受多种因素影响,目前尚未完全了解。核因子kappa B(nuclear factor kappa B,NF⁃κB)是一种多向性、多功能的核转录因子,可调控细胞凋亡、增殖的相关基因,在肿瘤的发生发展过程中发挥重要作用[1~3]。在结肠癌、胃癌及乳腺癌等多种肿瘤中存在NF⁃кB信号通路的异常激活,引起活化的NF⁃κB发生核异位,从而促进下游靶基因转录活性增加,导致某些细胞因子或炎性因子转录活性增强,进一步促进肿瘤的发生、增殖、侵袭和转移。缺氧诱导因子1α(hypox⁃ia inducible factor 1 alpha,HIF⁃1α)是广泛存在于哺乳动物和人体细胞的另一类核转录因子,研究证实HIF⁃1α仅在人体许多肿瘤中大量表达,与肿瘤的生长繁殖、侵袭和转移、新生血管生成、凋亡、耐药等特征都密切相关。肿瘤细胞中普遍存在缺氧状态,在缺氧状态下,HIF⁃1ɑ诱导生成大量新生血管、增强糖酵解、增强细胞增殖因子及转移相关基因表达,是肿瘤低氧恶性演进的重要分子机制[4~6]。本实验通过免疫组织化学SP法探讨NF⁃κB p65及HIF⁃1α与肾透明细胞癌的关系,为肾透明细胞癌的发病机制及靶向基因治疗提供理论基础。
1 材料与方法
1.1 材料
选取我院2007年至2010年通过根治性肾切除和肾部分切除肾肿瘤标本38例,均经术后病理证实为肾透明细胞癌。患者年龄20~80岁,男24例,女14例。根据2002年美国癌症联合委员会(AJCC)肾癌分期组合标准,Ⅰ期18例,Ⅱ期4例,Ⅲ期9例,Ⅳ期7例。根据Fuhrman病理分级标准,Ⅰ级8例,Ⅱ级22例,Ⅲ级5例,Ⅳ级3例。同时,随机从38例标本中选取11例距肿瘤较远的正常肾组织作为对照。所有组织均经病理证实,术前均未行放疗、化疗。
1.2 方法
1.2.1 免疫组化染色:石蜡切片常规二甲苯脱蜡后,高压修复抗原,实验步骤按NF⁃κB p65和HIF⁃1α试剂盒说明书进行,封片镜检。以已知的阳性片作为阳性对照,PBS代替一抗作为阴性对照。NF⁃κB p65和HIF⁃1α蛋白阳性表达呈棕黄色颗粒位于细胞核或细胞质。
1.2.2 结果判断:NF⁃кB P65以胞核或胞质中出现棕黄色颗粒作为阳性,参照Malik等[7]的方法,在高倍(×400)光镜下对阳性细胞进行评分。随机选择5个视野,总共计数200个细胞。没有细胞着色为0分,≤20%细胞着色为1分,21%~50%细胞着色为2分,>50%细胞着色为3分。阳性染色强度按以下标准区分:没有着色为0分;微弱棕黄色为1分;细胞核或细胞质中等强度棕黄色为2分;阳性细胞核或细胞质呈深棕色为3分。最后,将上述两种评分相乘之积作为评判标准,分数为0~2分者作为阴性,3分或以上作为阳性表达。HIF⁃1ɑ按照Zhong等[8]的方法,在高倍(×400)光镜下对阳性细胞进行评分。随机选择5个视野,每个视野200个细胞。没有细胞着色为0分,≤25%细胞着色为1分,25%~50%细胞着色为2分,>50%细胞着色为3分。阳性染色强度按以下标准区分:不染色为0分;轻度染色为1分;中度染色为2分;强染色为3分。最后,将上述两种评分之和作为评判标准,分数为0~3分者为阴性,4分或以上为阳性表达。
1.3 统计学处理
采用SPSS 17.0统计软件,率的比较采用Fisher精确概率检验,相关性分析采用Spearman相关分析,以P<0.05为有统计学差异。
2 结果
2.1 NF⁃κB p65与HIF⁃1α在肾透明细胞癌标本中的表达
NF⁃κB p65、HIF⁃1α染色阳性的标本中,阳性染色大部分集中在胞质中,偶见胞核染色,呈浅黄至深棕色颗粒状(图1)。
2.2 NF⁃κB p65与HIF⁃1α的阳性表达相关性及与肾透明细胞癌的临床病理特征关系
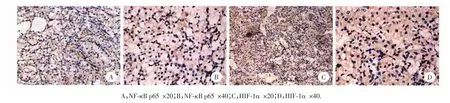
图1 NF⁃κB和H IF⁃1α的肾透明细胞癌免疫组织化学染色Fig.1 Immunohistochemical staining of NF⁃κB and HIF⁃1α
在11例正常肾组织中,NF⁃κB p65阳性表达率为 36.36%(4/11),HIF⁃1α阳性表达率为 18.18%(2/11);在38例肾透明细胞癌组织中,NF⁃κB p65阳性表达率为73.68%(28/38),HIF⁃1α阳性表达率为63.16%(24/38)。2者在正常肾组织和肾透明细胞癌组织的阳性表达率均有统计学差异(P<0.05)。临床分期早期肾癌组织的NF⁃κB p65的阳性表达率低于晚期肾癌组织,差异有统计学意义(P<0.05)。肿瘤直径<5 cm的肾癌组织的HIF⁃1α的阳性表达率低于肿瘤直径≥5 cm的肾癌组织,差异有统计学意义(P<0.05)。见表1。
NF⁃κB p65 与HIF⁃1α在肾透明细胞癌组织中的表达不相关(r=0.088,P=0.549)。
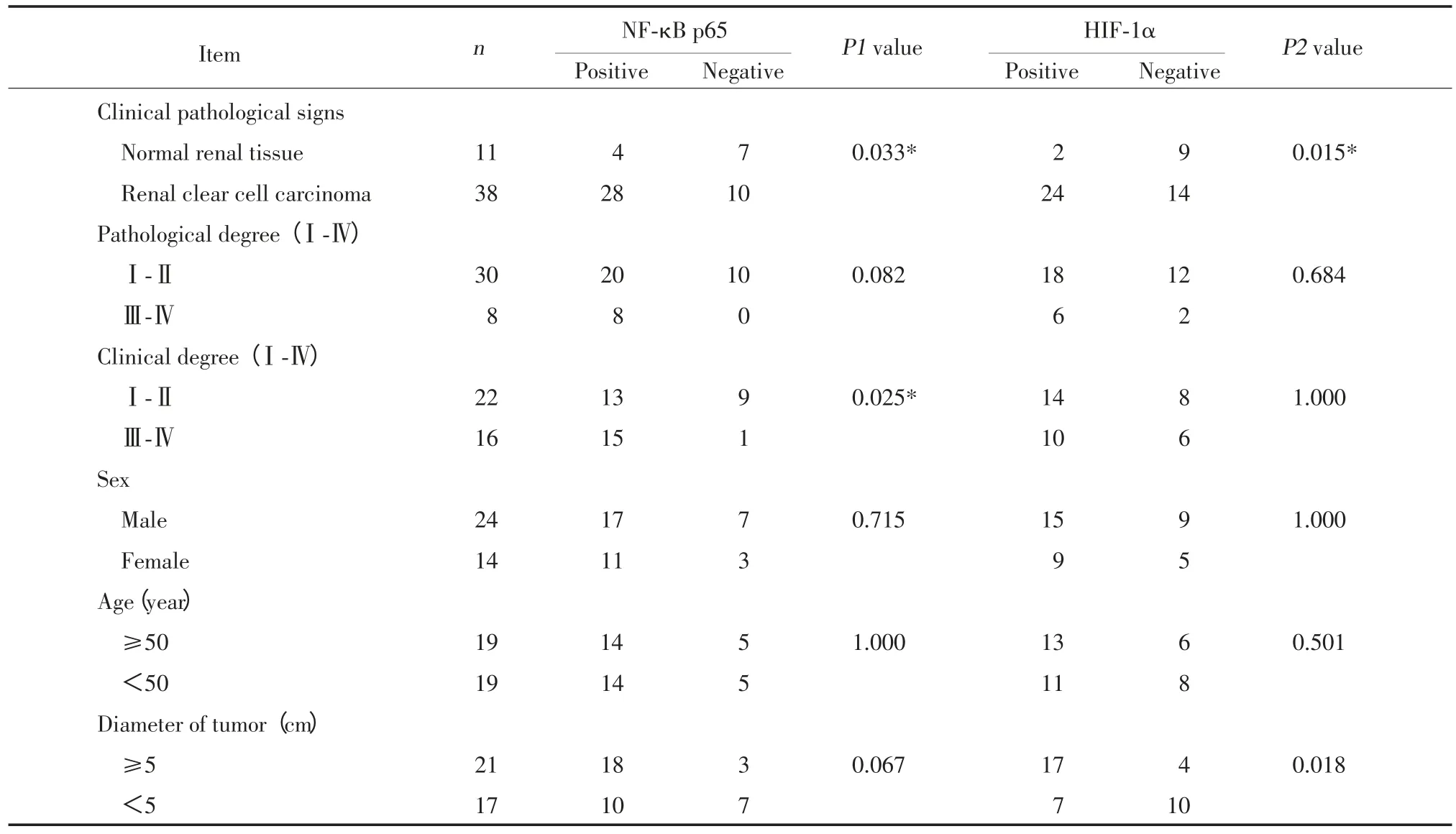
表1 NF⁃кB P65与H IF⁃lɑ的表达与肾透明细胞癌的临床病理特征关系Tab.1 Correlation between NF⁃κB and HIF⁃1αin renal clear cell carcinoma
3 讨论
NF⁃κB是一种调节炎性和细胞增殖的重要核转录因子,参与多种疾病和肿瘤的细胞因子、生长因子、细胞黏附因子等的基因调控[10]。在人类肿瘤细胞中,许多情况可以影响NF⁃κB的表达和活化,进而导致促进细胞转化的关键靶基因转录增强,促进肿瘤的发生发展[11]。国内外的相关文献报道NF⁃κB因子的持续活化可作为乳腺癌、卵巢肿瘤、结肠癌、胰腺癌、甲状腺癌、胆道肿瘤和前列腺肿瘤等实体肿瘤的标志,但尚无明确报道证实NF⁃κB在肾透明细胞癌组织中是否存在高表达。本研究显示,73.68%的肾透明细胞癌组织中有NF⁃κB p65的阳性表达,与正常肾组织的阳性表达比较差异有统计学意义(P<0.05)。临床分期晚的肾癌组织的阳性表达率高于临床分期早的肾癌组织,差异有统计学意义(P<0.05),提示NF⁃κB p65的高表达可以作为肾透明细胞癌的标志物与正常肾组织区别,而且其在肾透明细胞癌组织中的高表达可能与肿瘤的发展及预后有关。
HIF⁃1α是在缺氧条件下广泛存在于哺乳动物和人体内一种转录因子,它调节多种缺氧相关的靶基因的表达,使机体适应缺氧环境。在人类肿瘤细胞中,由于肿瘤细胞的快速生长,缺氧条件广泛存在。HIF⁃1α的过表达促进了肿瘤组织的血管生成,进而提高对缺氧环境的适应性[12]。国内外的相关文献报道[8,13~15]在结肠癌、肺癌、乳腺癌、胃癌、肾癌等十余种人类肿瘤组织中存在HIF⁃1α的高表达。本研究显示,63.16%的肾透明细胞癌组织中有HIF⁃1α的阳性表达,与正常肾组织比较有统计学差异(P<0.05),提示HIF⁃1α可以作为肾透明细胞癌的标志物与正常肾组织区别。以肿瘤大小分组,得到直径大(≥5 cm)的肿瘤组织HIF⁃1α的阳性表达明显高于直径小(<5 cm)的肿瘤(P<0.05),考虑可能在大肿瘤的内部细胞缺氧更加明显,HIF⁃1α表达更加充分,在一定程度上可以用作预测肾透明细胞癌的进展程度。
对NF⁃κB p65与HIF⁃1α在肾透明细胞癌组织中的表达相关性分析显示2者无相关性(P>0.05),故尚不能认为2者对于肾透明细胞癌的发生存在共同的表达调控机制。但有文献报道[15]NF⁃κB p65为HIF⁃1α的上游基因并对其表达及维持活性起着重要作用,存在一定相关性。
NF⁃κB p65与HIF⁃1α在人类肿瘤细胞中调控的确切机制尚不十分清楚,随着NF⁃κB p65与HIF⁃1α深入研究和一些新药临床试验的开展应用,相信它们能成为治疗肾透明细胞癌的新靶点。
[1]Calzado MA,Bacher S,Schmitz ML,et al.NF⁃kappa B inhibitors for the treatment of inflammatory diseases and cancer[J].Curr Med Chem,2007,14(3):367-376.
[2]TerzicˊJ,Grivennikov S,Karin E,et al.Inflammation and colon can⁃cer[J].Gastroenterology,2010,138(6):2101-2114.
[3]Karin M.NF⁃kB as a critical link between inflammation and cancer[J].Cold Spring Harb Perspect Biol,2009,1:a000141.
[4]Zhao X,Gao S,Ren H,et al.HIF⁃1 promotes pancreatic ductal ade⁃nocarcinoma invasion and metastasis by activating transcription of the actin⁃bundling protein fascin[J].Cancer Res,2014,PMID:24599125
[5]Snell CE,Turley H,McIntyre A,et al.Proline⁃hydroxylated hypoxia⁃inducible factor 1α(HIF⁃1α)upregulation in human tumours[J].PLoS One,2014,9(2):e88955.
[6]White NM,Masui O,Newsted D,et al.Galectin⁃1 has potential prog⁃nostic significance and is implicated in clear cell renal cell carcino⁃ma progression through the HIF/mTOR signaling axis[J].Br J Can⁃cer,2014,110(5):1250-1259.
[7]Malik SN,Brattain M,Ghosh PM,et al.Immunohistochemical dem⁃onstration of phospho⁃Akt in high gleason grade prostate cancer[J].Clin Cancer Res,2002,8(4):1168-1171.
[8]Zhong H,De Mario AM,Langhner E,et al.Overexpression of hypox⁃ia⁃inducible factor 1alpha in common human cancers and their me⁃tastases[J].Cancer Res,1999,55(2):5830-5835.
[9]郝天春,周玉林,汪小勇,等.HIF⁃1ɑ和CXCR4在肾透明细胞癌中的表达[J].安徽医科大学学报,2010,45(2):168-171.
[10]Bernal⁃Mizrachi L,Lovly CM,Ratner L.The role of NF⁃kappa B⁃1 and NF⁃kappa B⁃2⁃mediated resistance to apoptosis in lymphomas[J].Proc Natl Acad Sci USA,2006,103(24):9220-9222.
[11]Djavaheri⁃Mergny M,Amelotti M,Mathieu J,et al.NF⁃kappa B ac⁃tivation represses tumor necrosis factor⁃alpha⁃induced autophagy[J].J Biol Chem,2006,281(41):30373-30382.
[12]Semenza GL.HIF⁃1:mediator of physiological and pathophysiologi⁃cal responses to hypoxia [J].J Appl Physiol,2000,88(4):1474-1480.
[13]徐可,李映川,陈波,等.HIF⁃1ɑ和HIF⁃2ɑ在肾透明细胞癌中的表达及意义[J].中国癌症杂志,2007,7(3):245-247.
[14]Klatte T,Seligson DB,Riggs SB,et al.Hypoxia⁃inducible factor 1 alpha in clear cell renal cell carcinoma[J].Clin Cancer Res,2007,13(24):7388-7393.
[15]Van Uden P,Kenneth NS,Rocha S.Regulation of hypoxia⁃induc⁃ible factor⁃1alpha by NF⁃kappa B[J].Biochem J,2008,412(3),477-484.

