喉癌患者血清HMGB1和MMP-9表达及其临床意义
刘 嘉,阮宏莹,林 鹏,宋 维
(1天津医科大学一中心临床学院,天津300192;2天津市第一中心医院)
近年来研究发现,HMGB1在很多恶性肿瘤细胞中出现过高表达。高迁移率族蛋白B1(HMGB1)是一种存在于真核细胞内的非组蛋白,在肝癌、结直肠癌、乳腺癌、鼻咽癌、胃癌等患者肿瘤组织中出现过度表达,并与肿瘤发生、发展等过程有着密切的联系,但其与喉癌关系的报道较少。基质金属蛋白酶-9(MMP-9)亦在多种恶性肿瘤血清和肿瘤组织中过度表达,其参与了肿瘤发生发展过程,在喉癌中的表达也有相关报道。2012年10月~2013年6月,我们观察了40例喉癌患者血清HMGB1及MMP-9表达,现分析结果,探讨HMGB1及MMP-9在喉癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 研究对象为我院同期收治的40例喉癌患者(喉癌组),男30例,女10例,年龄43~80岁,均经术后病理证实为鳞状上皮细胞癌;其中声门上型21例,声门型15例,声门下型4例;TNM分期(UICC2002)T1、T2期28 例,T3、T4期 12 例;颈部淋巴结转移13例;高分化9例,中分化22例,低分化9例。37例癌前病变患者(癌前组),男28例,女9例,年龄50~78岁,其中喉角化病30例、成人喉乳头状瘤7例。41例健康对照者(健康组),男22例,女19例,年龄45~75岁。
1.2 HMGB1、MMP-9表达检测 手术前取各组空腹静脉血5 mL,高速离心(3 000 r/min)20 min,用干净的移液器吸取分离后的血清至EP管中,分别编号密封放置于-80℃冰箱中保存。采用ELISA法测定 HMGB1、MMP-9表达水平。分析 HMGB1、MMP-9表达与喉癌临床病理特征的关系。
1.3 统计学方法 采用SPSS18.0统计软件行统计学处理。数据以±s表示,处理前均经过正态性检验,对于符合正态分布的数据两组间比较用t检验,多组间比较采用方差分析(ANOVA),不符合正态分布的采用非参数检验,相关关系采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清HMGB1、MMP-9表达水平 见表1。
表1 各组血清HMGB1、MMP-9表达水平比较(ng/mL , ±s)

表1 各组血清HMGB1、MMP-9表达水平比较(ng/mL , ±s)
注:与癌前组及健康组比较,△P <0.01
组别 n HMGB1 MMP-9喉癌组 40 5.01±0.77△ 4.32±0.89△41 4.47 ±0.67 3.72 ±0.75癌前组 37 4.55 ±0.69 3.88 ±0.70健康组
2.2 HMGB1、MMP-9表达与喉癌临床病理特征的关系 见表2。由表2可知,HMGB1、MMP-9表达T3、T4期明显高于 T1、T2期(P <0.05),有淋巴结转移者明显高于无淋巴结转移者(P<0.05);二者表达与患者年龄、性别、分化程度和原发部位无关(P >0.05)。
表2 血清HMGB1、MMP-9水平与喉癌临床病理特征的关系( ±s)
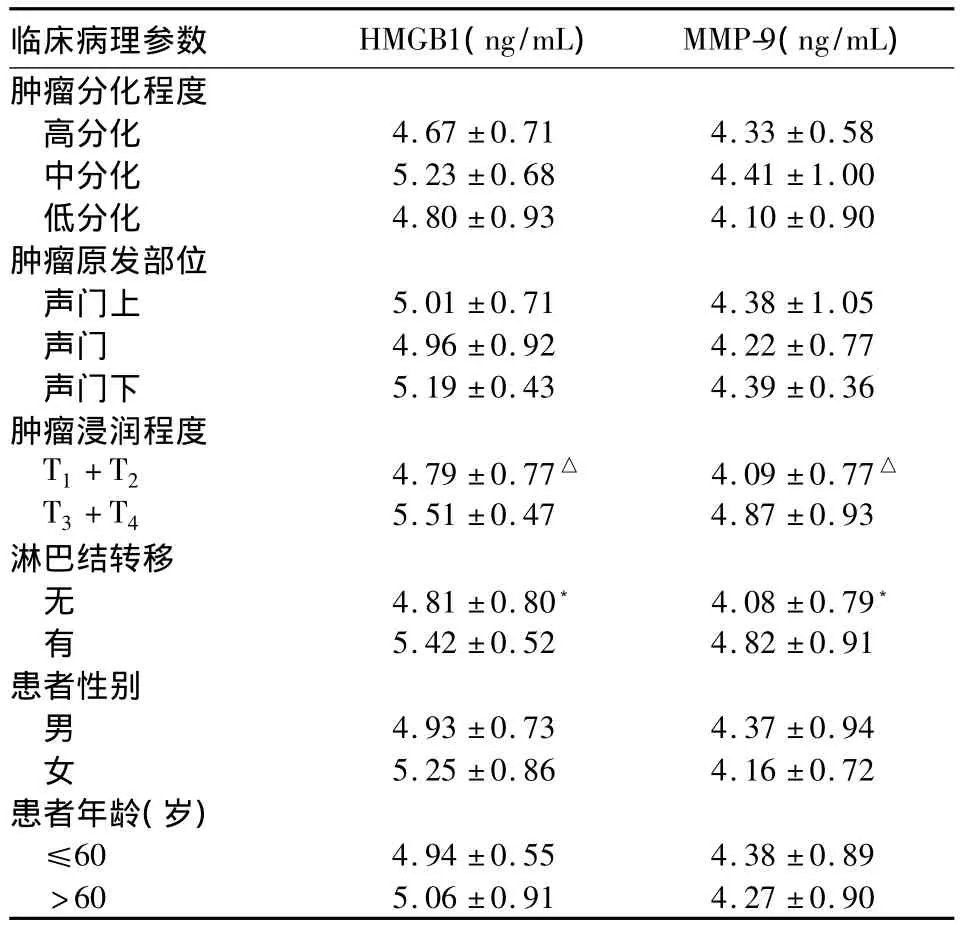
表2 血清HMGB1、MMP-9水平与喉癌临床病理特征的关系( ±s)
注:与 T3+T4比较,△P <0.01;与有淋巴结转移比较,*P <0.05
临床病理参数 HMGB1(ng/mL) MMP-9(ng/mL)肿瘤分化程度高分化 4.67 ±0.71 4.33 ±0.58中分化 5.23 ±0.68 4.41 ±1.00低分化 4.80 ±0.93 4.10 ±0.90肿瘤原发部位声门上 5.01 ±0.71 4.38 ±1.05声门 4.96 ±0.92 4.22 ±0.77声门下 5.19 ±0.43 4.39 ±0.36肿瘤浸润程度T1+T2 4.79 ±0.77△ 4.09 ±0.77△T3+T4 5.51 ±0.47 4.87 ±0.93淋巴结转移无4.81 ±0.80﹡ 4.08 ±0.79﹡有5.42 ±0.52 4.82 ±0.91患者性别男4.93 ±0.73 4.37 ±0.94女5.25 ±0.86 4.16 ±0.72患者年龄(岁)≤60 4.94 ±0.55 4.38 ±0.89>60 5.06 ±0.91 4.27 ±0.90
2.3 MMP-9与 HMGB1表达的相关性 喉癌组MMP-9和 HMGB1表达呈明显正相关,r=0.578,P <0.01。
3 讨论
在耳鼻喉科领域中喉癌的发病率仅次于鼻咽癌和鼻腔、鼻窦癌,居第三位,在我国北方地区更是常见。一直以来喉癌的治疗效果均不理想,造成患者病重甚至死亡的最主要因素依旧是肿瘤复发和转移。
HMGB1广泛存在于真核细胞中,是一种核内非组蛋白,因其在聚丙烯酰胺凝胶电泳(PAGE)中迁移速度快而得名。HMGB1以往一直作为一种核蛋白而受到关注,自1999年 Wang等[1]报道 HMGB1是一种新的晚期炎症介质且在脓毒症的发病过程中起重要作用以后,其作为炎症因子的重要意义引起临床重视;然而近年来国内外研究发现,HMGB1在很多恶性肿瘤组织中出现了过度表达,如宫颈癌、膀胱癌、结肠癌、鼻咽癌、胃癌等,且与肿瘤的发生发展过程十分密切。Fu等[2]采用免疫组化法检测宫颈癌组织HMGB1表达,发现HMGB1阳性率高于正常组织,且与肿瘤大小、浸润和转移呈正相关,其认为HMGB1阳性表达可作为宫颈癌发生浸润、转移的重要标志。Wang等[3]通过免疫组化和PCR法对膀胱癌组织中HMGB1的进行检测,发现HMGB1在膀胱癌组织过度表达,认为HMGB1是膀胱癌进展的关键因素之一,并可能作为潜在的诊断和治疗靶点。肖建彪等[4]报道,HMGB1在多种恶性肿瘤组织中呈强阳性表达,其可能是鉴别正常组织与癌组织潜在的生物学标志物。胡海青等[5]分别采用 ELISA法和化学发光免疫法检测160例胃癌患者术前血清HMGB1、CA19-9和CEA水平和52例胃良性疾病患者、60例正常对照者的血清HMGB1水平,结果胃癌患者血清HMGB1水平明显高于正常对照和胃良性疾病患者,其认为血清HMGB1表达水平可作为反映胃癌生物学行为的参考指标;亦有喉癌组织中HMGB1 表 达 的 报 道[6,7]。 本 研 究 喉 癌 组 血 清HMGB1表达明显高于癌前组和健康组,喉癌组T3、T4期者 HMGB1表达明显高于 T1、T2期者,说明HMGB1参与了喉癌的发生与发展;HMGB1在有淋巴结转移者明显高于无淋巴结转移者,说明HMGB1过度表达参与了喉癌的转移过程。
MMP-9是基质金属蛋白酶(MMPs)家族中的一种,参与细胞外基质的分解过程[8],在大部分恶性肿瘤中均有高表达。Somiari等[9]通过对345例供血者血清MMP-2、MMP-9水平进行检测并将其作为区分乳腺癌低危、高危以及判断肿瘤良恶性的依据,结果显示准确率达64.5%,其得出的结论是MMP-2、MMP-9可作为乳腺癌分类的标志物。Kopczyńska等[10]对50例非小细胞肺癌患者血清MMP-9水平进行检测,结论是MMP-9可作为非小细胞肺癌转移的标志物。钱红等[11]用组织芯片和免疫组化技术检测乳腺良性病变及乳腺癌组织中MMP-9的表达水平,认为MMP-9的表达与乳腺癌淋巴管生成及淋巴结转移关系密切并呈正相关。李培勇等[12]应用免疫组织化学法检测60例肾癌组织和20例癌旁正常肾组织中MMP-9的表达,发现肾癌组织MMP-9阳性率明显高于癌旁组织,证实MMP-9参与了肾癌新生血管的形成,并与侵袭转移关系密切。Yang等[13]研究表明,MMP-9在喉癌组织中高表达且参与了喉癌侵袭和转移。本研究喉癌组血清中MMP-9水平明显高于癌前组和健康组,喉癌组T3、T4期者明显高于T1、T2期者,说明MMP-9水平与喉癌的分期有关,MMP-9参与了喉癌的发生与发展;有淋巴结转移者MMP-9水平高于无淋巴结转移者,说明MMP-9的过度表达参与了喉癌的转移过程。
近年来有研究显示,HMGB1与恶性肿瘤的浸润和转移密切相关的主要原因可能是在一些较大的肿瘤组织中,坏死的肿瘤细胞会释放出HMGB1到周围环境,从而激活MMP-9,而MMP-9可破坏基底膜和细胞外基质。文献报道HMGB1与RAGE结合后通过 MAPK 信号通路激活 MMP-2、MMP-9[14],而MMP-2、MMP-9可以降解细胞外基质从而促进肿瘤的侵袭及转移。在非小细胞肺癌的研究中发现,HMGB1可通过激活 NF-κB 等信号通路[15],继而激活MMP-9,从而促进癌细胞的转移。本研究结果显示,喉癌患者血清HMGB1与MMP-9表达水平呈正相关,说明二者存在某种特殊的联系,可能是HMGB1通过诱导MMP-9的合成,促使细胞外基质的降解从而促进肿瘤的浸润、转移,但具体过程需大量的更深入的研究加以证实。
本研究结果显示,HMGB1和MMP-9参与了喉癌的发生发展过程,且在喉癌的浸润、转移中起着不可忽视的作用。对二者进行联合检测可为喉癌的早期诊断、恶性程度评估提供重要参考。进一步探讨HMGB1与MMP-9相互作用的原理,可能对喉癌的治疗提供新思路。
[1]Wang H,Bloom O,Zhang M,et al.HMG-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248-251.
[2]Fu X,Du XQ,Hao Q.Expression of HMGB1 protein in human cervical squamous epithelium carcinoma[J].J Clin Oncol,2008,5(1):53-57.
[3]Wang W,Jiang H,Zhu H,et al.Overexpression of high mobility group box 1 and 2 is associated with the progression and angiogenesis of human bladder carcinoma[J].Oncol Lett,2013,5(3):884-888.
[4]肖建彪,陈龙华.HMGB1在多种人体恶性肿瘤组织、癌旁组织中的表达及意义[J].山东医药,2013,53(12):1-3.
[5]胡海青,胡志明.高迁移率族蛋白1在胃癌病人血清中的含量及意义[J].外科理论与实践,2013,18(1):46-49.
[6]Wild CA,Brandau S,Lotfi R,et al.HMGBl is overexpressed in tumor cells and promotes activity of regulatory T cells in patients with head and neck cancer[J].Oral Oncol,2012,48(5):409-416.
[7]刘勇,邱元正,张欣,等.HMGB1与VEGF蛋白在喉鳞状细胞癌中的表达及其相关性研究[J].临床耳鼻咽喉头颈外科杂志,2011,25(6):265-269.
[8]Deryugina EI,Quigley JP.Matrix metalloproteinase and tumor metastasis[J].Cancer Metastasis Rev,2006,25(1):9-34
[9]Somiari SB,Somiari RI,Heckman CM,et al.Circulating MMP-2 and MMP-9 in breast cancer-potential role in classification of patients into low risk,high risk,benign disease and breast cancer categories[J].Int J Cancer,2006,119(6):1403-1411.
[10] Kopczyńska E,Dancewicz M,Kowalewski J,et al.The serum concentration of metalloproteinase 9 and 2 in non-small cell lung cancer patients[J].Pol Merkur Lekarski,2007 ,22(132):539-541
[11]钱红,曹桂明,牛国梁,等.MMP-9、MMP-14、MMP-2 和 VEGF-C在乳腺癌中的表达及意义[J].肿瘤学杂志,2013,19(3):223-226.
[12]李培勇,辛军,伍佰聪,等.HIF-1α、MMP-9、MVD 在肾细胞癌中的表达及临床意义[J].重庆医科大学学报,2013,38(2):151-154.
[13]Yang L,Shang X,Zhao X,et al.Correlation study between OPN,CD44v6,MMP-9 and distant metastasis in laryngeal squamous cell carcinoma[J].Lin Chuang Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2012,26(21):989-992.
[14]Kim SW,Lira CM,Kim JB,et al.Extracellular HMGB1 released by NMDA treatmentconfersneuronalapoptosisviaRAGE-p38 MAPK/ERK signaling pathway[J].Neurotox Res,2011,20(2):159-169.
[15]Liu PL,Tsai JR,Hwang JJ,et al.High-mobility group box 1-mediated matrix metalloproteinase-9 expression in non-small cell lung cancer contributes to tumor cell invasiveness[J].Am J Respir Cell Mol Biol,2010,43(5):530-538.

