10周有氧运动对2型糖尿病患者DNA氧化损伤的影响及机制分析
郭艳利,薄 海,彭 朋
(1.洛阳师范学院体育学院运动医学实验室,河南 洛阳471022;2.中国人民武装警察部队后勤学院,天津300309)
2型糖尿病(T2DM)是由于胰岛素抵抗引起的以慢性血糖升高为特征的代谢性疾病。本病患者生活质量降低,寿命缩短,病死率高,积极防治尤为重要。高血糖可造成多系统损害,特别是心血管系统的慢性进行性病变[1]。氧自由基(ROS)和抗氧化防御系统动态平衡破坏引发的氧化应激参与了上述过程[2]。运动是防治T2DM的有效手段,可增强机体的抗氧化能力,改善胰岛素抵抗并促进葡萄糖摄取,因此,美国运动医学学会将规律的有氧运动作为T2DM患者康复疗法的首选方案[3]。DNA易被ROS攻击而发生氧化损伤,DNA氧化损伤的产物是一种修饰化的碱基——8-羟基脱氧鸟苷(8-OHdG),后者入血后经尿液排出,因此8-OHdG是DNA氧化损伤最重要的标志物[4]。虽然机体同时存在清除ROS的抗氧化系统,但抗氧化激活的代偿能力是有限的,最终导致组织损伤。规律运动可提高抗氧化能力并降低组织的氧化损伤。有关运动与T2DM患者抗氧化的研究较多,但结论并不一致,而针对DNA损伤的影响鲜有报道。本研究以T2DM患者为受试对象,观察10周中等强度有氧运动对DNA损伤的影响并探讨其可能机制。
1 研究资料
1.1 一般资料 以电话、E-mail等方式招募洛阳市某社区成年健康受试者20名与T2DM患者40例,年龄45~60岁。T2DM的诊断标准为:空腹血糖(FBG)≥7.0 mmol/L和/或餐后2 h血糖(2 hPG)≥11.1 mmol/L,并排除1型糖尿病患者、严重T2DM并发症者以及严重心血管疾病患者。健康受试者作为对照组(C组,n=20),将40例 T2DM患者随机分为T2DM运动组(TE组,n=20)和T2DM安静组(TR组,n=20)。TE组进行10周有氧运动,TR组和C组保持日常生活习惯。实验过程中,TE组和TR组常规服用降糖药物,不得随意更换药物种类与剂量。3组一般资料比较无显著性差异(P均>0.05),见表1。

表1 受试者的基线特征
1.2 安静心率和血压测定 受试者安静坐位休息10 min后,计数3次脉搏取平均值作为安静心率。血压采用台式水银柱血压计进行测试,连续测量3次,每次间隔5 min,取均值,获得收缩压(SBP)和舒张压(DBP)。
1.3 血液生化指标测定 受试者分别于实验前1 d以及末次实验后1 d清晨(7:00—9:00)空腹状态下肘正中静脉取血5 mL,肝素抗凝,4℃ 3 000 r/min离心取血浆。血糖指标采用日本日立7060型全自动生化分析仪测定:FBG用葡萄糖氧化法测定,糖化血红蛋白(HbA1c)用免疫抑制比浊法测定。血脂指标测定:总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)和高密度脂蛋白胆固醇(HDL-C)均采用常规生化方法测定,仪器同上。氧化应激指标测定:氧化低密度脂蛋白(ox-LDL)采用酶联免疫吸附法(ELISA)测定,仪器:美国BIO-RAD 680型酶标仪;丙二醛(MDA)采用硫代巴比妥酸法测定,仪器同血糖测定。抗氧化酶活性测定:超氧化物歧化酶(SOD)采用黄嘌呤氧化酶法,谷胱甘肽过氧化酶(GSH-Px)采用谷胱甘肽还原酶法测定,仪器同血糖测定。DNA损伤测定:8-OHdG采用ELISA法测定,仪器同ox-LDL。试剂盒均购自南京建成生物工程研究所。
1.4 运动处方 TE组进行为期10周的有氧运动处方干预,运动方式为有氧健身跑。其中前4周运动强度为最大预测心率的50%~60%(最大预测心率(HRmax)计算公式为:HRmax=208-0.7 ×年龄[5]),每周3 次,每次30 min;后6 周运动强度为60%~70%HRmax,每周5次,每次45 min。运动前后进行5~10 min热身和整理活动以避免运动损伤。整个运动过程中受试者佩戴遥测心率表(Polar FT4,芬兰)对运动强度实时监控,以控制在靶心率范围内。
1.5 统计学方法 数据以均数±标准差表示。连续性变量使用参数检验:组间比较使用单因素方差分析,组内实验前后比较使用配对t检验;非连续性变量(百分构成比)使用卡方检验。P<0.05为差异有统计学意义。
2 结 果
实验后,TE 组体质量、BMI、HbA1c、ox-LDL、MDA 和8-OHdG均降低(P均<0.05),而SOD和GSH-Px均升高(P均<0.05)。TR组和 C组各指标均无显著性变化(P>0.05)。见表2。
3 讨 论
T2DM是心血管疾病的重要危险因素,不良心血管事件则是T2DM患者病死率居高不下的主要原因。在本研究中,实验前安静状态下,TE组和TR组SBP与C组比较无显著性差异,但DBP高于C组。研究证实,除血糖外,血压特别是DBP升高是T2DM患者心血管并发症的独立危险因素[6]。T2DM患者持续高血糖可造成机体ROS增多,本研究TE组和TR组ox-LDL、MDA和8-OHdG均高于C组,说明T2DM患者存在氧化应激状态并造成DNA氧化损伤。ROS增多可引起脂质过氧化,同时引发胞浆钙超载并降低一氧化氮的利用率,进而造成内皮功能紊乱、血管顺应性下降以及动脉硬化斑块形成[7];ROS的另一作用是攻击DNA双链造成其氧化损伤[4],ROS攻击DNA脱氧鸟苷C8位形成特异性的碱基修饰产物——8-OHdG,后者可引起DNA复制过程中碱基错配,从而导致G:C→T:A的颠换突变,进而导致细胞凋亡与功能紊乱,是造成T2DM患者胰岛素抵抗以及心血管疾病的重要病理生理机制[8]。机体除了氧化系统,还存在抗氧化防御系统,其中SOD和GSH-Px是最重要的抗氧化酶,以阻止ROS的过度产生并抑制其对细胞的损伤性攻击[9]。本研究中TE组和TR组SOD和GSH-Px均低于C组,提示氧化与抗氧化失衡是引发氧化应激和DNA损伤的根本原因。
表2 实验前后身体形态与功能指标比较(±s)
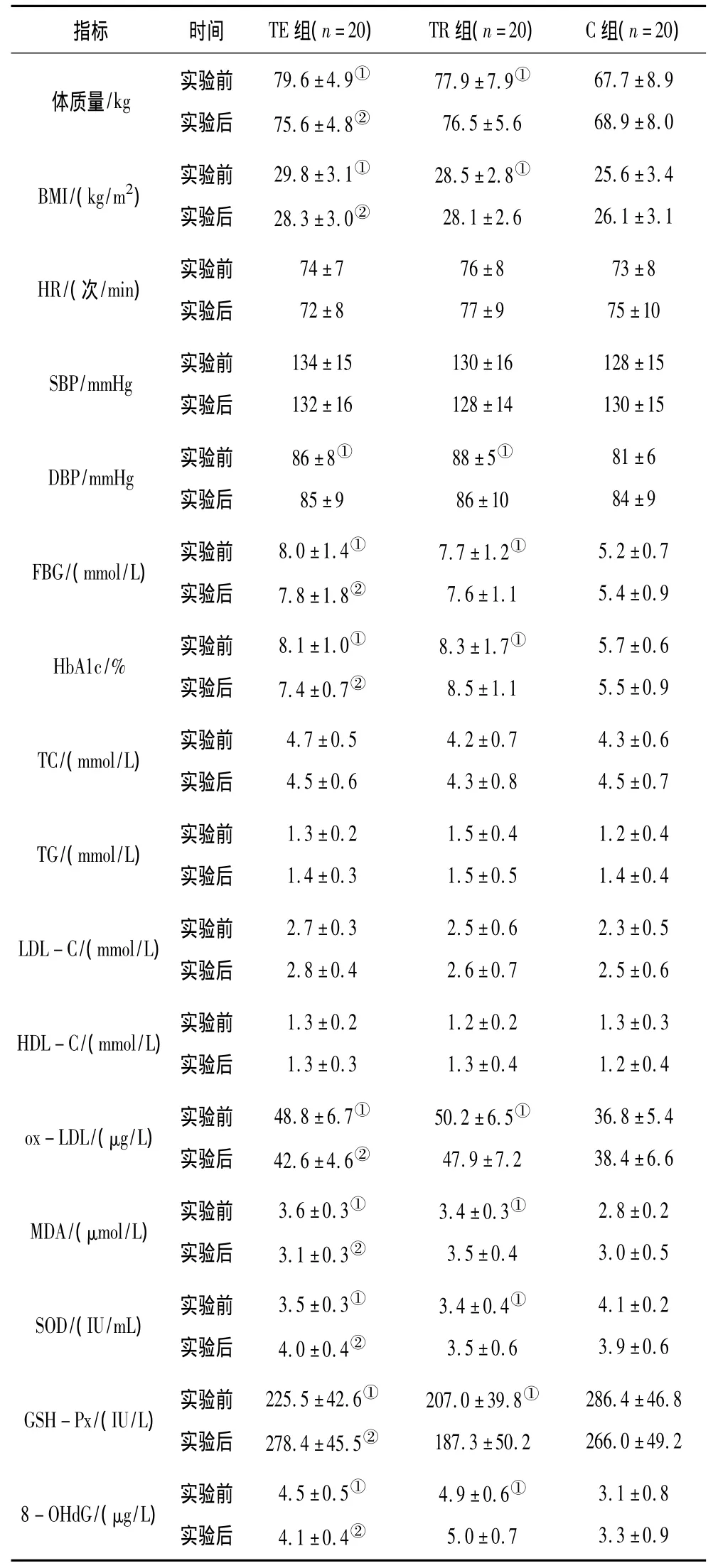
表2 实验前后身体形态与功能指标比较(±s)
注:①与 C组比较,P<0.05;②与实验前比较,P<0.05。1 mmHg=0.133 kPa。
指标 时间 TE组(n=20) TR组(n=20) C组(n=20)体质量/kg 实验前实验后79.6±4.9①75.6±4.8②77.9±7.9①76.5±5.6 67.7±8.9 68.9±8.0 BMI/(kg/m2)实验前实验后29.8±3.1①28.3±3.0②28.5±2.8①28.1±2.6 25.6±3.4 26.1±3.1 HR/(次/min) 实验前实验后74±7 72±8 76±8 77±9 73±8 75±10 SBP/mmHg 实验前实验后134±15 132±16 130±16 128±14 128±15 130±15 DBP/mmHg 实验前实验后86±8①85±9 88±5①86±10 81±6 84±9 FBG/(mmol/L) 实验前实验后8.0±1.4①7.8±1.8②7.7±1.2①7.6±1.1 5.2±0.7 5.4±0.9 HbA1c/% 实验前实验后8.1±1.0①7.4±0.7②8.3±1.7①8.5±1.1 5.7±0.6 5.5±0.9 TC/(mmol/L) 实验前实验后4.7±0.5 4.5±0.6 4.2±0.7 4.3±0.8 4.3±0.6 4.5±0.7 TG/(mmol/L) 实验前实验后1.3±0.2 1.4±0.3 1.5±0.4 1.5±0.5 1.2±0.4 1.4±0.4 LDL-C/(mmol/L) 实验前实验后2.7±0.3 2.8±0.4 2.5±0.6 2.6±0.7 2.3±0.5 2.5±0.6 HDL-C/(mmol/L) 实验前实验后1.3±0.2 1.3±0.3 1.2±0.2 1.3±0.4 1.3±0.3 1.2±0.4 ox-LDL/(μg/L) 实验前实验后48.8±6.7①42.6±4.6②50.2±6.5①47.9±7.2 36.8±5.4 38.4±6.6 MDA/(μmol/L) 实验前实验后3.6±0.3①3.1±0.3②3.4±0.3①3.5±0.4 2.8±0.2 3.0±0.5 SOD/(IU/mL) 实验前实验后3.5±0.3①4.0±0.4②3.4±0.4①3.5±0.6 4.1±0.2 3.9±0.6 GSH-Px/(IU/L) 实验前实验后225.5±42.6①278.4±45.5②207.0±39.8①187.3±50.2 286.4±46.8 266.0±49.2 8-OHdG/(μg/L) 实验前实验后4.5±0.5①4.1±0.4②4.9±0.6①5.0±0.7 3.1±0.8 3.3±0.9
规律运动是T2DM的重要康复手段,其中有氧运动简便易行、效果持久且不良反应少,可显著降低血糖并改善胰岛素抵抗,是 T2DM患者的首选方式[3]。有氧运动能够降低T2DM患者心血管疾病的发生率,提高其生活质量[10],其机制除了与血糖稳定控制外,还可能与氧化应激与DNA损伤改善有关。在本研究中,实验后TE组SOD和GSH-Px升高,ox-LDL、MDA和8-OHdG降低,说明10周规律有氧运动提高了抗氧化酶活性,降低了氧化应激和DNA氧化损伤。DNA氧化损伤主要通过机体最重要的一种DNA修复酶——8-羟鸟嘌呤 DNA 糖基化酶(OGG1)进行切除修复[11],陈磊[12]研究显示,运动可上调OGG1表达量和/或活性,诱导OGG1对8-OHdG的修复,以保证DNA序列的“高保真”,从而抑制细胞凋亡与损伤。因此推测实验后TE组8-OHdG的下降是抗氧化酶活性升高介导的氧化应激下降以及OGG1表达上调诱导对DNA损伤修复等多个“事件”综合作用的结果。长期有氧运动可降低T2DM患者DNA氧化损伤,其机制可能与抗氧化酶表达上调以及氧化应激水平下降有关。
此外,本研究中T2DM受试者(TE组和TR组)病程较短(<3 a),ox-LDL、MDA和8-OHdG显著升高,说明脂质过氧化和DNA损伤发生在T2DM早期,与文献[13]报道一致;而实验后TE组上述指标均显著下降,说明运动的抗氧化与抗DNA损伤效应对T2DM及其并发症起到了逆转作用。本研究的结果进一步提示,积极改善生活方式如长期坚持规律有氧运动是T2DM患者非药物治疗的重要手段,同时也是临床治疗的有益补充。
[1]American Diabetes Association.Standards of medical care in diabetes—2014[J].Diabetes Care,2014,37(Suppl 1):S14-80
[2]李一梅.氧化应激、线粒体功能障碍与2型糖尿病[J].临床荟萃,2014,29(2):213-216
[3]Tuttle LJ,Hastings MK,Mueller MJ.A moderate-intensity weightbearing exercise program for a person with type 2 diabetes and peripheral neuropathy[J].Phys Ther,2012,92(1):133-141
[4]Lin TS,Wu CC,Wu JD,etal.Oxidative DNA damage estimated by urinary 8-hydroxy-2’-deoxyguanosine and arsenic in glass production workers[J].Toxicol Ind Health,2012,28(6):513-521
[5]Tanaka H,Monahan KD,Seals DR.Age-predicted maximal heart rate revisited[J].JAm Coll Cardiol,2001,37(1):153-156
[6]Vamos EP,Harris M,Millett C,etal.Association of systolic and diastolic blood pressure and all cause mortality in people with newly diagnosed type 2 diabetes:retrospective cohort study[J].BMJ,2012,345(10):e5567-5577
[7]Donato AJ,Eskurza I,Silver AE,etal.Direct evidence of endothelial oxidative stress with aging in humans:relation to impaired endothelium-dependent dilation and upregulation of nuclear factor-kappaB[J].Circ Res,2007,100(11):1659-1666
[8]Simone S,Gorin Y,Velagapudi C,etal.Mechanism of oxidative DNA damage in diabetes:tuberin inactivation and downregulation of DNA repair enzyme 8-oxo-7,8-dihydro-2’-deoxyguanosine-DNA glycosylase[J].Diabetes,2008,57(10):2626-2636
[9]Alipour M,Salehi I,Ghadiri SF.Effect of exercise on diabetes-induced oxidative stress in the rat hippocampus[J].Iran Red Crescent Med J,2012,14(4):222-228
[10]Nicolucci A,Balducci S,Cardelli P,etal.Relationship of exercise volume to improvements of quality of life with supervised exercise training in patients with type 2 diabetes in a randomised controlled trial:the Italian Diabetes and Exercise Study(IDES)[J].Diabetologia,2012,55(3):579-588
[11]Prabhulkar S,Li CZ.Assessment of oxidative DNA damage and repair at single cellular level via real-time monitoring of 8-OHdGbiomarker[J].Biosens Bioelectron,2010,26(4):1743-1749
[12]陈磊.有氧运动对青年男性外周血淋巴细胞DNA修复酶的影响[J].山东体育科技,2012,34(3):39-43
[13]Al-Aubaidy HA,Jelinek HF.Oxidative DNA damage and obesity in type 2 diabetes mellitus[J].European journal of endocrinology/Eur J Endocrinol,2011,164(6):899-904

