萤光素酶表达质粒pEE14.1-luc的构建及表达
朱晓明 ,李盼,王琳,王宇,张亮,徐元基,杜芝燕,于继云,阎瑾琦
1.军事医学科学院 基础医学研究所,北京 100850;2.解放军316医院,北京 100093
DNA 疫苗具有预防和治疗双重功效,是一个功能强大的新型疫苗输入系统[1]。随着相关研究的不断深入,DNA 疫苗的递送方式也取得了长足发展,目前报道的主要方法有基因枪法、脂质体法、水动力法和电穿孔法等。其中,活体电穿孔方法的靶器官选择范围广泛,对连入的外源基因片段大小没有限制,操作简便快速,毒性低,具有较高的转染效率,从而成为DNA 疫苗递送的首选方法[2-3]。但有关电穿孔递送的条件还有待深入探讨[4],其中质粒的大小是影响递送效率的重要因素之一。现有含萤光素酶报告基因的质粒pGL3-CMV,但分子较小仅为5 kb,不便于模拟分子较大的DNA 质粒进行电穿孔递送条件的研究[5]。因此,我们构建了萤光素酶表达质粒pEE14.1-luc,其中pEE14.1 是一种高效表达载体[6],分子较大约为11 kb,将萤光素酶报告基因luc克隆入该载体后的质粒分子可达12.7 kb。以此质粒作为大分子质粒的代表,为进一步摸索递送10 kb 以上质粒的电穿孔条件奠定了重要的实验基础。
1 材料和方法
1.1 材料
BALB/c 小鼠购自军事医学科学院实验动物中心;293T 细胞系购自北京协和细胞研究所;大肠杆菌DH5α感受态由本室制作;含有萤光素酶报告基因的质粒pGL3-CMV 为本室保存;载体pEE14.1 由军事医学科学院宋宏彬博士赠予;限制性内切酶HindⅢ、BamHⅠ、EcoRⅠ和DNA 聚合酶KlenowⅠ购自New England Biolabs 公司;SolutionⅠ连接酶购自TakaRa 公司;DNA 片段回收试剂盒、高纯度质粒小提试剂盒和无内毒素质粒大提试剂盒购自康为世纪生物科技有限公司;萤光素酶底物luck-100 购自GOLDB10 公司;一抗为山羊抗萤光素酶抗体,二抗为HRP和FITC分别标记的兔抗山羊抗体,购自中杉金桥生物技术有限公司;细胞破膜剂购自BD 公司;Western 印迹超敏发光液购自北京普利莱基因技术有限公司;IVIS 5D imaging system 活体成像仪为Xenogen公司所有。
1.2 重组质粒pEE14.1-luc的构建及鉴定
用EcoRⅠ单酶切含有萤光素酶报告基因的重组质粒pGL3-CMV,纯化回收并将粘性末端补平,再用HindⅢ单酶切,回收luc基因片段;用BamHⅠ单酶切pEE14.1 质粒,纯化回收后将粘性末端补平,再用HindⅢ单酶切补平后的线性质粒pEE14.1,获得同样是一平一粘的pEE14.1 载体片段;将纯化回收的pEE14.1 载体片段和luc基因片段在SolutionⅠ连接酶的作用下于16℃连接过夜,转化大肠杆菌DH5α感受态,挑取单克隆菌培养,并进行菌液PCR鉴定[引物为F(5'-ATAGGATCCGCCACCATGGAA GACGC-3')和R(5'-ATTCCCGGGTTACACGGCG ATCTTTC3')],将菌液PCR 鉴定为阳性的克隆测序,把测序正确的阳性克隆质粒命名为pEE14.1-luc。
1.3 重组质粒pEE14.1-luc转染293T细胞
转染的前1 d 将293T 细胞接种于6 孔板,当细胞覆盖到70%~80%时,用Entranster-H 转染试剂将提取的质粒pEE14.1-luc 和空载体pEE14.1 分别转染293T细胞,37℃、5% CO2培养箱中培养。
1.4 Western 印迹检测重组质粒pEE14.1-luc 的表达
收集转染后培养48 h 的细胞,离心后弃上清,加入200 μL 细胞裂解液置冰上裂解40 min~1 h,离心后取上清,加入25 μL 蛋白样品处理液煮沸5 min,进行SDS-PAGE;电泳毕,用Bio-RAD 转移仪将凝胶中的蛋白分子转移到PVDF 膜,用含5%牛血清的TBST 室温封闭2 h,一抗为1∶500 稀释的山羊抗萤光素酶抗体,二抗为1∶5000稀释的HRP标记兔抗山羊抗体,用普利莱超敏发光液显影。
1.5 流式细胞术和免疫荧光法检测重组质粒pEE14.1-luc的表达
收集转染后培养48 h 的细胞,离心后弃上清,用细胞打孔液打孔7 min,4℃与抗体孵育30 min,一抗为1∶200稀释的山羊抗萤光素酶抗体,二抗为1∶1000 稀释的FITC 标记的兔抗山羊抗体,用流式细胞仪检测,再用激光共聚焦扫描显微镜观察细胞表面荧光的表达情况。
1.6 活体成像技术检测重组质粒pEE14.1-luc 的表达
大量提取重组质粒pEE14.1-luc 及对照质粒pGL-3-CMV,在BALB/c 小鼠的左右腿部肌肉组织中分别注射浓度为50 μg/100 μL的pGL-3-CMV 和pEE14.1-luc,并用电穿孔技术进行质粒递送(电压60 V,脉冲时间50 ms,放电6 次)。免疫后48 h,将萤光素酶底物luck-100 注射入腹腔,10 min 后将麻醉的小鼠放入活体成像检测仪中,观察萤光素酶在活体内的表达情况。
2 结果
2.1 重组质粒pEE14.1-luc的构建及鉴定
将重组质粒pEE14.1-luc转化大肠杆菌DH5ɑ感受态,挑取单克隆进行培养,以培养物为模板,用设计的引物进行PCR 鉴定。琼脂糖电泳结果显示,4号菌液扩增出约1700 bp 的片段,与萤光素酶基因片段大小一致(图1)。将PCR 鉴定正确的4 号菌液提取质粒,送公司测序,结果分析证明连入pEE14.1载体中的片段序列与萤光素酶基因序列完全相符,表明重组质粒pEE14.1-luc构建成功。
2.2 Western印迹检测
收集转染后的细胞进行Western印迹,重组质粒pEE14.1-luc 转染后的细胞中有特异性条带,相对分子量约为62×103,而空载体pEE14.1 转染后的细胞中未检测出特异性条带,表明重组质粒pEE14.1-luc能够正确表达萤光素酶(图2)。
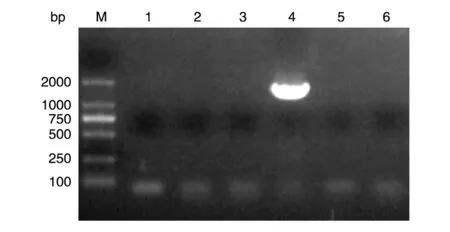
图1 重组质粒pEE14.1-luc的菌液PCR鉴定
2.3 流式细胞术及免疫荧光检测
对转染后48 h 的293T 细胞进行流式细胞术及免疫荧光检测。流式细胞术检测表明,转染了重组质粒pEE14.1-luc 的293T 细胞,luc 阳性表达率为22.41%,而未转染质粒的对照组细胞无luc 表达(图3)。免疫荧光检测结果表明,转染了重组质粒pEE14.1-luc 的293T 细胞有FITC 标记的绿色荧光,而未转染质粒的对照组细胞无荧光表达(图4)。
2.4 活体成像检测结果
将质粒pGL3-CMV 和重组质粒pEE14.1-luc 分别注射入BALB/c 小鼠的左右腿肌肉内,利用电穿孔技术进行质粒递送,48 h 后的活体成像检测结果显示,小鼠注射质粒pEE14.1-luc和pGL3-CMV后的左右腿部均有很强的荧光表达(图5)。
3 讨论
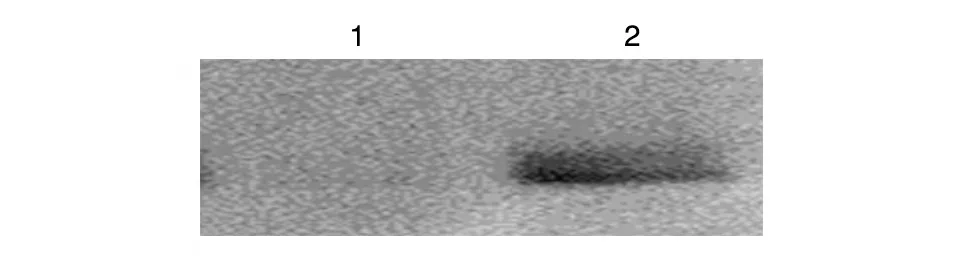
图2 重组质粒pEE14.1-luc表达的Western印迹
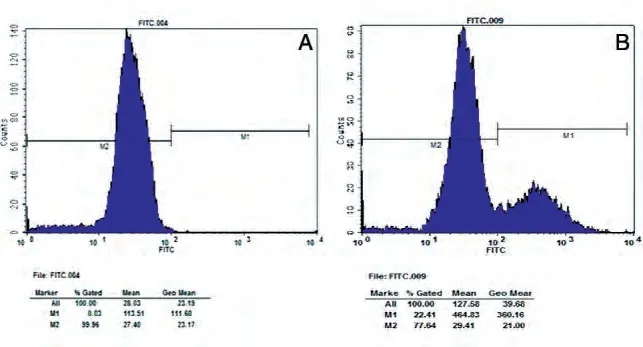
图3 重组质粒pEE14.1-luc的流式细胞术检测
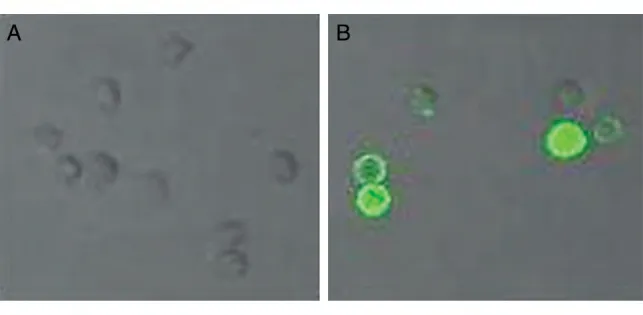
图4 重组质粒pEE14.1-luc的免疫荧光检测(×20)
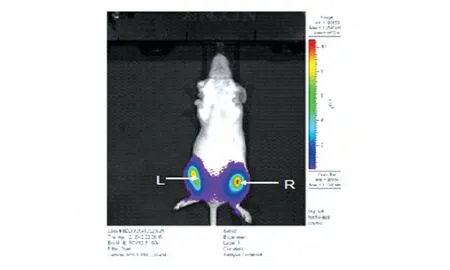
图5 活体成像检测重组质粒pEE14.1-luc在体内的表达
DNA 疫苗作为第三代疫苗,能够诱导机体产生抗原特异性的体液免疫和细胞免疫应答,具有广阔的发展前景[7]。关于DNA 疫苗体内递送的研究也越来越受关注。诸多研究表明,通过电穿孔技术递送DNA 疫苗已成为一种高效的疫苗递送策略[8]。首先,电穿孔的作用原理非常明确,细胞在短暂脉冲电压作用下,细胞膜出现开孔,质粒DNA 即可沿孔洞向细胞内转移,因此能够使肌肉细胞对质粒DNA 的摄入比直接肌肉注射显著提高[9-10]。其次,电穿孔技术操作简单快捷且成本较低。影响电穿孔递送的因素较多,除电压、脉冲次数、脉冲时间等[11-12],质粒DNA 的大小、自身特性也是影响递送效率的重要因素。目前在临床试验的研究中,电穿孔递送还未有统一的参数标准[13],各项技术指标有待完善。
近年来,活体成像技术成为检测活体动物体内基因表达的研究热点。此技术是在生物体处于活体的状态下,通过采用多种成像模式的方法,对生物体在细胞和分子水平上进行定性和定量分析研究。这项技术具有以下优点:首先是在近乎无创的条件下对活体动物体内的生物学表现进行成像跟踪,无须处死动物,简单可行;其次是操作便捷,短时间内便可动态、连续、直观地观察到实验结果,一目了然,具有极高的灵敏度[14]。我们将该技术运用于本实验,对质粒DNA 在体内的表达情况进行了可视化评估,为实验结果提供了客观、可靠的理论基础。
本研究中应用的pEE14.1 载体较大约为11 kb,我们将萤光素酶报告基因克隆入该真核表达载体,所构建的重组表达质粒可作为大分子模式质粒的代表。Western 印迹、流式细胞术、免疫荧光方法检测表明萤光素酶能在体外细胞中表达;利用电穿孔方法在小鼠腿部肌肉中进行重组质粒pEE14.1-luc 的递送,活体成像结果显示小鼠腿部肌肉中有较强的荧光表达。这说明我们构建的重组质粒pEE14.1-luc在活体动物中得到了很好的表达,为电穿孔递送较大分子质粒的实验条件优化奠定了基础。
[1]Ghanem A,Healey R,Adly F G.Current trends in separation of plasmid DNA vaccines:a review[J].Anal Chim Acta,2013,760:1-15.
[2]Sardesai N Y,Weiner D B.Electroporation delivery of DNA vaccines:prospects for success[J].Curr Opin Immunol,2011,23(3):421-429.
[3]Gothelf A,Gehl J.What you always needed to know about electroporation based DNA vaccines[J].Hum Vaccin Immunother,2012,8(11):1694-1702.
[4]van Drunen Littel-van den Hurk S,Hannaman D.Electroporation for DNA immunization:clinical application[J].Exp Rev Vaccines,2010,9(5):503-517.
[5]李盼,张亮,王宇,等.复制子萤光素酶表达质粒pSVK-luc 的构建与应用[J].细胞与分子免疫学杂志,2013,29(7):765-768.
[6]高燕,汪习,张巍,等.人干扰素α高效表达质粒pEE14.1-IFNα的构建和表达[J].细胞与分子免疫学杂志,2012,28(4):381-383.
[7]杨海,王芳宇.DNA 疫苗的研究进展[J].生物技术,2013,40(1):72-76.
[8]Murakami T,Sunada Y.Plasmid DNA gene therapy by elec-troporation:principles and recent advances[J].Curr Gene Ther,2011,11(6):447-456.
[9]Andre F,Mir L M.DNA electrotransfer:its principles and an updated reviewof its therapeutic applications[J].Gene Ther,2004,11(Suppl 1):33-42.
[10]Wells D J.Gene therapy progess and prospects:electroporation and other physical metehods[J].Gene Ther,2004,11(18):1363-1369.
[11]Bodles-Brakhop A M,Draghia-Akli R.DNA vaccination and gene therapy:optimization and delivery for cancer therapy[J].Expert Rev Vaccines,2008,7(7):1085-1101.
[12]Rabussay D.Applicator and electrode design for in vivo DNA delivery by electroporation[J].Methods Mol Biol,2008,423:35-59.
[13]Reed S D,Li S.Electroporation advances in large animals[J].Curr Gene Ther,2009,9(4):316-326.
[14]宿华威,韩德恩,吴德全,等.活体生物萤光成像技术及新进展[J].哈尔滨医科大学学报,2006,40(4):342-344.

