Pinx1、hTERT mRNA在三种皮肤肿瘤组织中的表达及意义
陈前明 方杰 瓦庆彪 袁伟 吴波 蔡琦 路永红 周培媚 蒋存火
·研究报道·
Pinx1、hTERT mRNA在三种皮肤肿瘤组织中的表达及意义
陈前明 方杰 瓦庆彪 袁伟 吴波 蔡琦 路永红 周培媚 蒋存火
目的探讨内源性端粒酶抑制基因PinX1及端粒酶逆转录酶hTERT在基底细胞癌、鳞状细胞癌、日光性角化病组织中的表达及其意义。方法实时定量PCR检测实验组36例3种皮肤肿瘤组织中内源性端粒酶抑制基因PinX1及端粒酶逆转录酶hTERT的mRNA表达水平,并以15例正常人皮肤组织作为对照组。结果实验组PinX1基因的mRNA表达水平(2.53±1.57)低于对照组(4.25±2.02),差异有统计学意义(t=3.273,P<0.05);hTERT基因的mRNA表达水平(6.37±3.81)明显高于对照组(1.62±0.99),差异有统计学意义(t=6.927,P<0.05);Pinx1的表达水平与hTERT表达的相关性无统计学意义(P>0.05)。结论PinX1的下调及hTERT上调可能与3种皮肤肿瘤形成过程中端粒酶激活及维持机制有关。
皮肤肿瘤;基因,Pinx1;基因,hTERT
作者单位:610017成都市第二人民医院皮肤科(陈前明、瓦庆彪、吴波、蔡琦、路永红、周培媚、蒋存火);遵义医学院附属医院皮肤科(方杰、袁伟)
端粒酶活性增强可导致细胞永生化、肿瘤形成。内源性端粒酶抑制基因PinX1(PIN2/TERF1 interacting,telomerase inhibitor 1)基因是在人类细胞中发现的一个能与端粒酶逆转录酶hTERT直接相互作用的新的端粒酶/端粒调控因子,被推测为潜在的抑癌基因,目前发现,在人类包括肝癌、前列腺癌、肺癌、结肠癌等多种肿瘤中明显降低或无表达[1]。已有研究表明,在皮肤肿瘤中端粒酶活性高于正常皮肤组织[2]。本研究通过检测基底细胞癌、鳞状细胞癌和日光性角化病组织中,PinX1和hTERT的mRNA表达水平,初步探讨PinX1在3种皮肤肿瘤发病机制中的作用。
一、对象与方法
(一)对象:收集2012年3月至2013年3月遵义医学院附属医院及成都第二人民医院3种皮肤肿瘤手术标本36例,其中男15例,女21例,年龄41~93岁,平均60岁,包括基底细胞癌13例、鳞状细胞癌11例、日光性角化病12例。正常皮肤组织取自遵义医学院附属医院外科手术切除的正常皮肤,其中男9例,女6例,年龄22~65岁,平均39岁。本研究都经过两家医院医院伦理委员会批准,患者均签署知情同意书。所有标本均为手术切除,经组织病理诊断,标本离体10min内置入冻存管内,放入-80℃低温冰箱保存。
(二)主要试剂及仪器:荧光定量PCR仪购于美国Bio-Rad公司,紫外分光光度计购于美国Beckman Coulter公司,反转录反应体系试剂盒及SYBR Green I嵌合荧光法试剂盒均购于大连TakaPa公司,PinX1、hTERT引物及内参还原磷酸甘油醛脱氢酶(GAPDH)引物均由上海Sangon公司设计合成,引物序列见表1。
(三)方法:
1.提取总RNA,合成cDNA:取组织100mg用Trizol一步法[3]提取组织内总RNA。所提取的总RNA用紫外分光光度计测定A260/A280含量并检测其纯度,1.5%甲醛变性琼脂糖凝胶电泳检测RNA完整性。筛选所有比值在1.8~2.0之间且无降解的样品,取2 μg总RNA按反转录反应体系试剂盒说明合成cDNA。cDNA放入-20℃冰箱中保存备用。
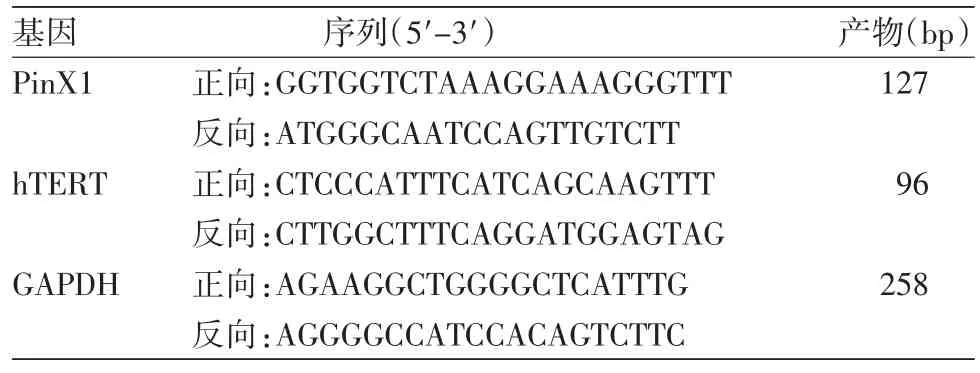
表1 PinX1、hTERT、GAPDH 引物序列
2.实时荧光定量PCR:以cDNA为模板,用Bio-Rad荧光定量PCR仪按照SYBR Green I嵌合荧光法试剂盒说明书检测PinX1、hTERT基因mRNA在基底细胞癌、鳞状细胞癌、日光性角化病及正常皮肤组织中的表达。扩增反应条件:PinX1 PCR:预变性95℃ 10 s,1个循环:变性95℃ 10 s,退火(复性)55℃30 s,40个循环;GAPDH PCR:预变性95℃10 s,1个循环;变性95℃ 10 s,退火60℃30 s,40个循环;hTERT PCR:预变性95℃10 s,1个循环;变性95℃ 10 s,退火60℃30 s,40个循环。用2-△△Ct法对有特异性扩增的目的基因进行相对定量。反应结束后分析PCR扩增曲线及熔解曲线,并进行2%琼脂糖凝胶电泳实验检测扩增特异性。
3.统计学处理:用SPSS13.0软件对各组数据进行单因素方差分析及t检验,两组基因mRNA的相对表达量的相关性进行Pearson线性相关分析,P<0.05为差异有统计学意义。
二、结果
1.总RNA纯度和完整性:A260/A280样本比值在1.8~2.0之间,提示总RNA纯度良好;在紫外线灯下可见28S、18S和5S三条大小和比例合适的条带,表明提取的总RNA无降解。
2.PinX1及hTERT mRNA的表达水平:PinX1基因PCR扩增产物电泳图在127 bp处可见明显的电泳条带(图1),hTERT基因PCR扩增产物电泳图在96 bp处可见明显的电泳条带(图2),GAPDH基因PCR扩增产物电泳图在258 bp处可见明显的电泳条带(图3)。
3.PinX1基因mRNA的相对表达量:BCC、SCC、AK组织中PinX1 mRNA的相对表达量均低于正常对照组,差异有统计学意义(均P<0.05),见表2。3种皮肤肿瘤之间两两比较PinX1 mRNA的相对表达量差异无统计学意义(均P>0.05);3种皮肤肿瘤组织中PinX1 mRNA的相对表达量低于正常对照组,差异有统计学意义(t=3.273,P<0.01),见表2。
4.hTERT基因mRNA的相对表达量:BCC、SCC、AK组织中hTERT mRNA的相对表达量均高于正常对照组,差异有统计学意义(均P<0.05)。3种皮肤肿瘤之间两两比较hTERT mRNA的相对表达量差异无统计学意义(均P>0.05);3种皮肤肿瘤组织中hTERT mRNA的相对表达量明显高于正常对照组,差异有统计学意义(t=6.927,P<0.001)。见表2。
5.PinX1与hTERT mRNA表达的相关性分析:PinX1与hTERT mRNA相对表达量的Pearson相关系数为0.016,P=0.913,两者的相关关系无统计学意义。
表2 基底细胞癌、鳞状细胞癌、日光性角化病组织中PinX1、hTERT mRNA的相对表达量(±s)

表2 基底细胞癌、鳞状细胞癌、日光性角化病组织中PinX1、hTERT mRNA的相对表达量(±s)
组别 例数 PinX1 hTERT基底细胞癌 13 2.26±1.38 5.90±2.94鳞状细胞癌 11 2.62±1.92 6.82±5.14日光性角化病 12 2.75±1.50 6.45±3.51正常对照组 15 4.25±2.02 1.62±0.99

图1 PinX1基因PCR扩增产物电泳图 M:标准参照物;1:空白对照;2~4:PinX1扩增片段(127 bp)
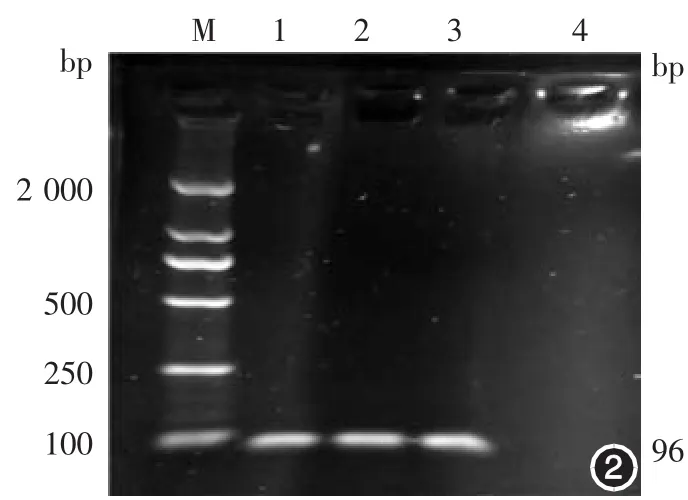
图2 hTERT基因PCR扩增产物电泳图 M:标准参照物;1~3:hTERT扩增片段(96 bp);4:空白对照
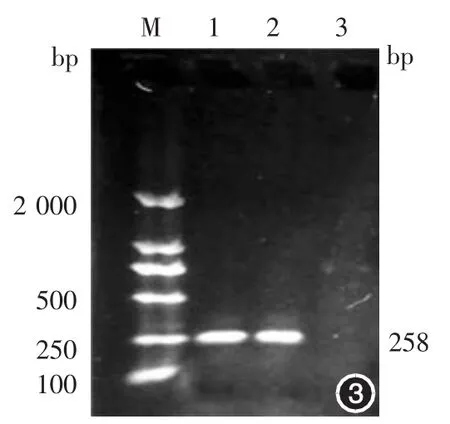
图3 GAPDH基因PCR扩增产物电泳图 M:标准参照物;1,2:GAPDH扩增片段(258 bp);3:空白对照
三、讨论
端粒(telomere)作为线性DNA,其末端不能被DNA酶复制,因此它的末端会随周期性的复制而逐渐缩短,从而使细胞逐渐衰老或凋亡[4]。而端粒酶能以自身RNA为模板合成端粒DNA,并加至端粒末端以维持端粒长度的稳定,抵消因各种原因造成的端粒的缩短及不稳定[5-6]。正常情况下人类体细胞端粒酶的检测是阴性的,但85%以上的肿瘤样品能检测到端粒酶的存在[7]。人类端粒酶有3个主要组分:人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)、人端粒酶RNA(human telomerase RNA,hTR)和端粒酶相关蛋白(telomerase associated protein,TEP1)[8]。其中hTERT是端粒酶活性表达所必需的。作为RNA依赖的DNA聚合酶,hTERT可识别单链富含G的寡核苷酸引物,以其RNA组分的碱基为模板与端粒重复序列进行碱基互补配对,在合成、延伸端粒碱基序列中起催化作用[9]。
作为内源性端粒酶抑制基因,PinX1基因由7个外显子组成,有两种转录形式,分别编码174个氨基酸和328个氨基酸[10]。其定位于8p23,该区域同时也是一个在多种人类肿瘤中发生高频杂合缺失的区域。PinX1在正常人体组织中广泛表达,而在肿瘤组织中则相应低表达或不表达,不能有效抑制端粒酶活性而阻遏肿瘤生长。在体外,过度表达PinX1可抑制纤维肉瘤HTl080细胞的增殖,抑制端粒酶活性、缩短端粒长度引发危机状态;相反,抑制内源性PinX1可促进瘤细胞的增殖,增加端粒酶活性、延长端粒[11]。
PinX1可以抑制端粒酶活性,而有研究表明在基底细胞癌、皮肤鳞状细胞癌中端粒酶都有过多的表达[2]。本研究结果显示,作为端粒酶活性表达所必需的基因,hTERT基因在BCC、SCC、AK组织中的表达水平明显高于正常组织(P<0.05),提示3种皮肤肿瘤组织中端粒酶活性可能高于正常组织。PinX1基因在BCC、SCC、AK组织中的表达水平低于正常皮肤组织(P<0.05),表明在端粒酶活性增强的3种皮肤肿瘤组织中,PinX1下调后,端粒酶活性可能不能被PinX1有效抑制,从而使端粒长度得到维持,导致肿瘤细胞生长。
[1]马英玉,武良,李继承.Pinx1表达与端粒酶活性及肿瘤的关系[J].细胞生物学杂志,2008,30:472-474.
[2]Chen Z,Smith KJ,Skelton HG,et al.Telomerase activity in Kaposi's sarcoma,squamous cell carcinoma,and basal cell carcinoma[J].Exp Biol Med,2001,226(8):753-757.
[3]赵志龙,宗志红,李建新,等.从石蜡包埋肺癌组织提取检测基因转录的研究[J].中国肺癌杂志,2008,11(8):563-565.
[4]Johnson FB.PinX1 the tail on the chromosome[J].J Clin Invest,2011,121(4):1242-1244.
[5]Grandin N,Charbonneau M.Protection against chromosome degradation at the telomeres[J].Biochimie,2008,90(1):41-59.
[6]Bianchi A, Shore D.How telomerase Reaches Its End:Mechanism of Telomerase Regulation by the Telomeric Complex[J].Mol Cell,2008,31(2):153-165.
[7]Rhyu MS.Telomeres,telomerase,and immortality[J].J Natl Cancer Inst,1995,87(12):884-894.
[8]Marcia B,Christophe N.Regulation of Telomerase and Telomeres:Human Tumor Viruses Take Control[J].J Natl Cancer Inst,2008,100(2):98-108.
[9]Gillis AJ,Schuller AP,Skordalakes E.Structure of the Tribolium castaneum telomerase catalytic subunit TERT[J].Nature,2008,455(7213):633-637.
[10]WS Park,Lee JH,et al.Genetic analysis of the liver putative tumor suppressor(LPTS)gene in hepatocellular carcinomas[J].Cancer Lett,2002,178(2):199-207.
[11]Zhou XZ,Lu KP.The Pin2/TRF1-interacting protein PinX1 is a potent telomerase inhibitor[J].Cell,2001,107(3):347-359.
2013-08-19)
(本文编辑:吴晓初)
Expressions of PinX1 and hTERT mRNAs in three skin tumors and their significance
Chen Qianming*,Fang Jie,Wa Qingbiao,Yuan Wei,Wu Bo,Cai Qi,Lu Yonghong,Zhou Peimei,Jiang Cunhuo.*Department of Dermatology,Second People's Hospital of Chengdu,Chengdu 610017,China
Yuan Wei,Email:dryuanweihua@sina.com
ObjectiveTo investigate the mRNA expressions of PinX1 and hTERT in lesions of three skin tumors(including basal cell carcinoma(BCC),squamous cell carcinoma(SCC)and actinic keratosis)as well as their significance.MethodsThis study included 36 tissue specimens from the lesions of 13 patients with BCC,11 patients with SCC and 12 patients with actinic keratosis,as well as 15 tissue specimens from the normal skin of 15 individuals receiving surgical therapy.Real-time PCR was performed to quantify the mRNA expressions of PinX1 and hTERT in these specimens.ResultsThe specimens from the lesions of the skin tumors showed a significantly lower expression of PinX1 mRNA(2.53±1.57 vs.4.25±2.02,t=3.273,P<0.05),but a higher expression of hTERT mRNA(6.37±3.81 vs.1.62±0.99,t=6.927,P<0.05)compared with those from the normal skin.There was no significant correlation between the mRNA expressions of PinX1 and hTERT(P>0.05).Conclusion The down-regulated PinX1 expression and up-regulated hTERT expression may be associated with the activation and maintenance of telomerase in the formation of the three skin tumors.
Skin neoplasms;Genes,Pinx1;Genes,hTERT
10.3760/cma.j.issn.0412-4030.2014.06.015
四川省科技支撑计划项目(2010SZ0015)
袁伟,Email:dryuanweihua@sina.com

