苯酚提取-超高效液相色谱法测定烟草中的磷酸腺苷
林小峰,吴玉萍,陈学军,孔光辉
1 云南省烟草农业科学研究院,分析测试中心,云南省玉溪市高新开发区南祥路14号 653100;
2 云南大学,材料科学与工程系,云南省昆明市五华区翠湖北路2号 650091
苯酚提取-超高效液相色谱法测定烟草中的磷酸腺苷
林小峰1,2,吴玉萍1,陈学军1,孔光辉1
1 云南省烟草农业科学研究院,分析测试中心,云南省玉溪市高新开发区南祥路14号 653100;
2 云南大学,材料科学与工程系,云南省昆明市五华区翠湖北路2号 650091
建立了苯酚提取超高效液相色谱法(UPLC)同时测定新鲜烟叶中三磷酸腺苷(ATP)、二磷酸腺苷(ADP)和单磷酸腺苷(AMP)的分析方法。苯酚提取样品溶液中的ATP、ADP和AMP较稳定,不易水解,样品在2 h以内各磷酸腺苷变化率小于10%。采用6‰三乙胺(pH=6.6)和甲醇作为流动相梯度洗脱,3种磷酸腺苷在10 min内实现了较好的分离,线性范围(5~200)μg/mL内,磷酸腺苷浓度与峰面积相关性很高(r>0.9999),3种磷酸腺苷 检测限均小于0.5 μg/mL,回收率在91.68%~110.79%之间,RSD在1.53%~3.67%之间。
超高效液相色谱;磷酸腺苷;苯酚;新鲜烟草
磷酸腺苷在生物体生存和繁殖中占据重要地位,测定磷酸腺苷(ATP,adenosine 5’-triphosphate;ADP,adenosine 5’-diphosphate; AMP,adenosine 5’-monophosphate)含量广泛应用于监测和评估各种细胞和组织间的代谢活动。尽管最近研究表明ATP能作为某些疾病的一种有效生物标志物[1-3],但对于其他磷酸腺苷(ADP、AMP)在不同器官或系统中生理或病理的确切作用,其重要性在很大程度上仍然未开发。而ATP对植物,特别是烟草的遗传育种、生长发育、品质控制等方面起着重要作用。国内外报道的ATP检测文献较多,其中动物组织[4-6]或者其代谢产物[7-9]占据很大部分,国外关于ATP的高效、专一检测研究试验[10-16]也较多。ATP含量检测历来使用较多的是荧光素-荧光素酶发光检测技术[17]。近年来,高效液相色谱-紫外检测器(HPLC-UV),或液相色谱-质谱联用(LC-MS)已用于各种生物样品[18]的检测。早前报道的ATP提取方法包括强酸提取,有机溶剂提取,热提取,超声波提取等[19-21];最新的报道[22-23]显示,采用阳离子表面活性剂作为细菌细胞的ATP提取剂也具有相当可行性。
然而目前的提取方法对复杂样品中ATP的提取效果不佳:利用沸水,氯仿,正丁醇提取样品中的ATP,提取效率均不太理想[24],超声波提取仅仅局限于微生物,该方法得不到广泛推广,阳离子表面活性剂等应用较少。利用高氯酸或者正丁醇对ATP进行提取因其污染少,步骤简单而受到青睐,在现阶段是主要的提取方法,但仍存在一些问题需要进一步探讨,一是需要进行去除高氯酸处理,二是提取的样品稳定性较差,不易存放等。本项研究比较高氯酸和苯酚法之间提取效果和样品稳定性,结果表明苯酚在提取效果和样品稳定性上均优于高氯酸。
检测方法方面,生物发光分析技术检测ATP比较方便快捷,但不能同时检测ATP、ADP和AMP,且试剂盒价格高昂。高效液相色谱法是检测ATP的首选,高效液相色谱法流动相一般采用磷酸盐缓冲溶液和有机溶剂梯度洗脱[25-30],而另外一种方法则采用反相离子对试剂洗脱[31-35],结果表明反相离子对试剂分离效果理想。但使用液相色谱分析植物中磷酸腺苷含量至今鲜有报导。本研究以三乙胺缓冲液代替磷酸盐缓冲液为流动相”,使ATP、ADP和AMP分离效果更理想。通过以上样品前处理和分离条件优化,成功的将液相色谱分析应用于植物烟草中ATP的检测,为烟草ATP的快速分析和烟草生长过程的深入研究提供方法依据。
1 材料与方法
1.1 仪器与试剂
超高效液相色谱仪(美国Waters公司 Acquity,配有二元溶剂管理器,自动进样器,TUV检测器和色谱工作站),高速离心机(德国 Eppendorf 5810R),电子天平(精度0.0001g,METTLER公司AE240),超纯水制备系统(德国Millipore公司Milli-Q Reference),pH计(瑞士Mettler Toledo公司SevenMulti),振荡混合器(上海沪达仪器设备有限公司ZD-100)。
5’-三磷酸腺苷钠盐(adenosine 5’-triphosphate disodium salt,美国Sigma公司,≥98.5%)、5’-二磷酸腺苷钠盐(adenosine 5’-diphosphate sodium salt,美国 Sigma公司,≥95%)、5’-单磷酸腺苷钠 盐 (adenosine 5’-monophosphate disodium salt,美国Sigma公司,≥98%),乙二胺四乙酸二钠盐(Ethylenediaminetetraacetic acid disodium salt dihydrate,美国Sigma公司,99.0~101.0%)、三乙胺(Triethylamine,美国Sigma公司,≥99%)、磷酸(Phosphoric acid,美国Sigma公司,≥85.0%)、氢氧化钾(Potassium hydroxide,美国Sigma公司,≥85%)、甲醇(Methanol,J.T.Baker公司,色谱纯)、高氯酸(Perchloric acid,国药集团化学试剂有限公司,70.0%~72.0%,优级纯)、苯酚(Phenol,广东汕头西陇化工股份有限公司,≥99%,分析纯)、氯仿(Trichloromethane,广东汕头西陇化工股份有限公司,≥99.0%,分析纯)。
1.2 标准品
磷酸腺苷标准储备液及工作液的配制:分别称取标准品各100 mg,用超纯水溶解后定容于100mL棕色容量瓶中,配制成1000 μg/mL浓度的标准储备液,于4℃条件下保存,保质期为7天;测定样品时,按要求配制成不同浓度的混合标准工作液,混合标准工作液现配现用。
1.3 样品处理
将采集的新鲜烟叶沿叶脉剖成两半,称取5 g样品,在液氮条件下研磨粉碎并转移到10mL离心管中,按照以下方法进行提取。
1.3.1 高氯酸(PCA)提取
于上述装有样品的10mL离心管中加入10mL预冷高氯酸(0.6 M),在震荡混合器中快速混合1 min后立即离心10 min(12000 r/min,4℃),离心后取2mL上清液,置于另外一个5mL离心管中并加入适量预冷氢氧化钾(6 M)调节pH至6.0~6.5,用流动相(三乙胺缓冲盐溶液)定容至5mL并摇匀,冷冻离心3 min(12000 r/min,4℃)后取适量上清液并用0.22 μm滤膜过滤,滤液移入样品瓶中,供UPLC分析。
1.3.2 苯酚(Phenol-TEA)提取
于上述装有样品的10mL离心管中加入10mL预冷TEA-EDTA-饱和苯酚溶液(Phenol-TEA; 0.6% 三乙胺-磷酸,pH 8.0,1 mmol/L EDTA,加入苯酚至饱和。用EDTA螯合镁或其他二价离子以抑制核苷酸转换酶对磷酸腺苷作用[36]),震荡混合1 min并冷冻离心10 min(12000 r/min,4℃),离心后取2mL适量上清液,加入氯仿萃取过量苯酚,震荡混合1 min,冷冻离心3 min(12000 r/min,4℃)后取适量上清液并用0.22 μm滤膜过滤,滤液移入样品瓶中,供UPLC分析。
1.4 色谱条件
色谱柱:ACQUITY BEH-C18(2.1 m×50 mm,1.7 μm); 流动相:甲醇(A);6 ‰三乙胺水溶液,用磷酸调节pH为6.6(B);柱温30℃;进样量1 μL;检测波长259 nm;梯度洗脱条件如表1所示。采用与标准样对比保留时间定性,外标法定量。

表1 梯度洗脱条件Tab.1 Conditions for gradient elution
2 结果分析
2.1 提取方法的确定
本实验探讨了用高氯酸和苯酚所提取样品的稳定性。结果(表2)显示,苯酚提取样品ATP和ADP稳定性明显比高氯酸方法略胜一筹。高氯酸法所处理的样品,在2~3 h之间ADP水解趋势明显,3~12 h,ADP变化基本稳定;而AMP含量在5 h以内平缓增长,这可能由于ATP和ADP水解生成AMP的缘故,5~12 h呈降低趋势,这说明此时段内ATP、ADP水解为AMP速率比不上AMP自身水解速率。苯酚法所处理的样品,ATP缓慢下降;ADP变化率较为小;AMP则一直呈上升趋势,由此,初步推断高氯酸条件下ATP部分可能直接水解为AMP,而苯酚条件下ATP水解更倾向于分步完成,即ATP→ADP→AMP。苯酚法所提取实际样品在2 h以内各磷酸腺苷变化率绝对值小于10%,且AMP在苯酚中不易发生水解,检测在2 h以内完成测量,也能保证结果在误差范围以内;对于3种磷酸腺苷总量(∑adenosine),在5 h以内,该方法所提取实际样品含量为t0时刻的95.72%,如只是对3种磷酸腺苷总体含量作定量分析,则可放宽在5 h以内分析完毕;高氯酸法在2 h内磷酸腺苷总量水解率高达12.07%,所以该方法所提取样品最好为处理完样品后立即检测。
此外,根据所处理样品颜色显示,高氯酸法处理样品颜色刚开始为黄褐色,2 h以后,样品颜色逐渐变为绿色并加深,而苯酚法所处理样品颜色较浅,并很长一段时间之内外观上也没有发生改变,即苯酚方法提取样品溶液中的磷酸腺苷较高氯酸法提取的稳定。
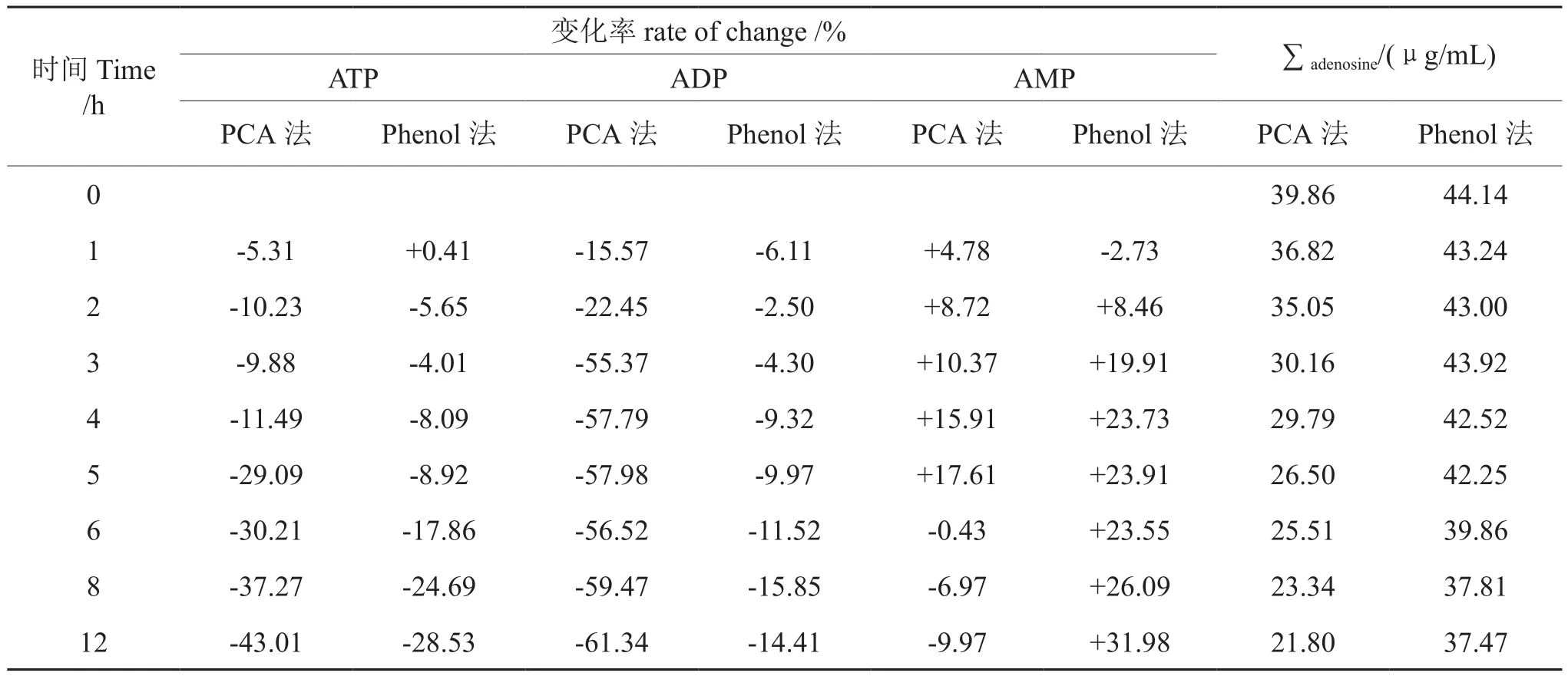
表2 不同提取方法对样品中磷酸腺苷的稳定性(n=2)Tab.2 Effect of different extract methods on stability of ATP,ADP and AMP (n=2)
分析比较了高氯酸和苯酚提取对烟草中ATP测定结果的影响(表3)。结果表明苯酚提取效果与高氯酸相当,但用苯酚法节省了高氯酸法中调节pH的步骤,且样品稳定性有所提高。两种提取方法结果t检验结果显示,ATP和ADP测定结果差异不显著,AMP存在显著差异(P<0.05),苯酚法测定结果较小,说明苯酚条件下ATP水解更倾向于分步完成。

表3 高氯酸和苯酚提取方法对新鲜烟叶样品中磷酸腺苷提取效果比较Tab.3 Comparison of ef ficiencies of PCA and Phenol on extraction of adenosine phosphate in fresh tobacco
2.2 色谱条件的优化
磷酸腺苷是两性化合物,结构相似,极性较强,很难在反相色谱柱上保留;使用反相液相色谱分析时多使用磷酸盐缓冲液或离子对试剂作为流动相对其进行分离,前者分离效果往往不理想,峰保留时间过早,常常与样品中其它杂质峰重叠;后者能加强色谱柱对磷酸腺苷保留时间,但反离子对试剂价格高昂,限制了其在一般科研机构的推广使用。实验比较了磷酸盐缓冲液和三乙胺缓冲液作为流动相的分离效果(图1),结果表明三乙胺缓冲液作为流动相的分离效果较理想,样品杂质与磷酸腺苷有很好的分离,优于普遍使用的磷酸盐缓冲液。
根据样品的实际分离情况对流动相三乙胺盐溶液浓度和pH值进行优化,试验发现当流动相浓度为6‰,pH值为6.6时,未知物与样品中ATP分离情况良好,不影响ATP的准确定性和定量,实际样品的分离见图2。
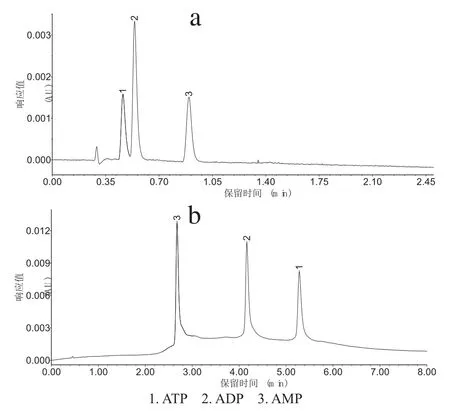
图1 磷酸腺苷混合标准溶液色谱图:流动相分别为磷酸盐缓冲液(a)和三乙胺缓冲液(b)Fig.1 Chromatograms of adenosine phosphate standard solution:the mobile phase are phosphate buffer(a) and triethylamine buffer(b)
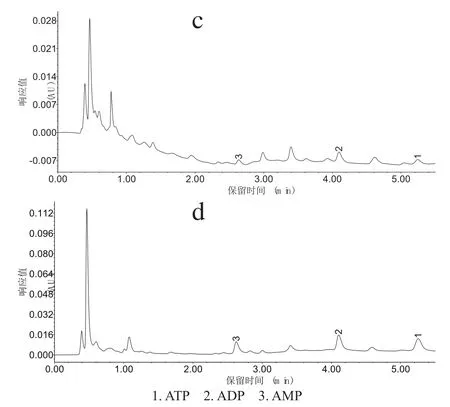
图2 新鲜烟叶样品色谱图:PCA提取(c)和苯酚提取(d)Fig.2 Chromatograms of fresh tobacco samples:extraction of PCA(c) and Phenol(d)
2.3 工作曲线与检测限
配制浓度为5、10、15、20、25、50、100、200 μg/mL的标准溶液,分别对各浓度的标准溶液进行UPLC分析,用ATP色谱峰面积及其浓度进行回归分析。结果(表4)表明,测定3种磷酸腺苷的线性范围为5~200 μg/mL,检测限小于0.5μg/mL,能满足实际样品分析需求。
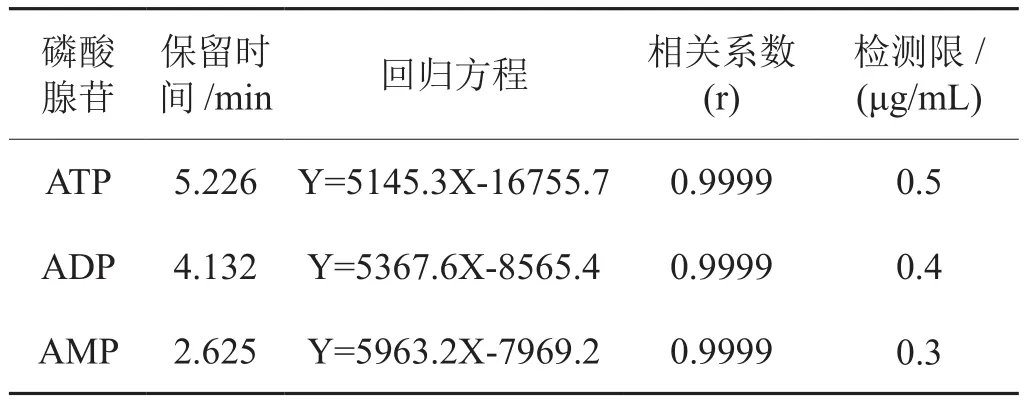
表4 磷酸腺苷的线性关系、保留时间及检测限Tab.4 Linearity,retention time and detection limits of adenosine phosphate
2.4 回收率与重复性
取样后把实际样品沿叶脉剖成两份,分别对高氯酸法和苯酚法进行回收率试验。结果如表5所示,高氯酸法ATP和ADP回收率较低,与上述ATP在强酸性条件下易水解为其他代谢产物的结果一致,而苯酚法回收率比较理想,不同添加浓度下,3种磷酸腺苷的回收率为91.68%~110.79%,RSD为1.53%~3.67%之间。
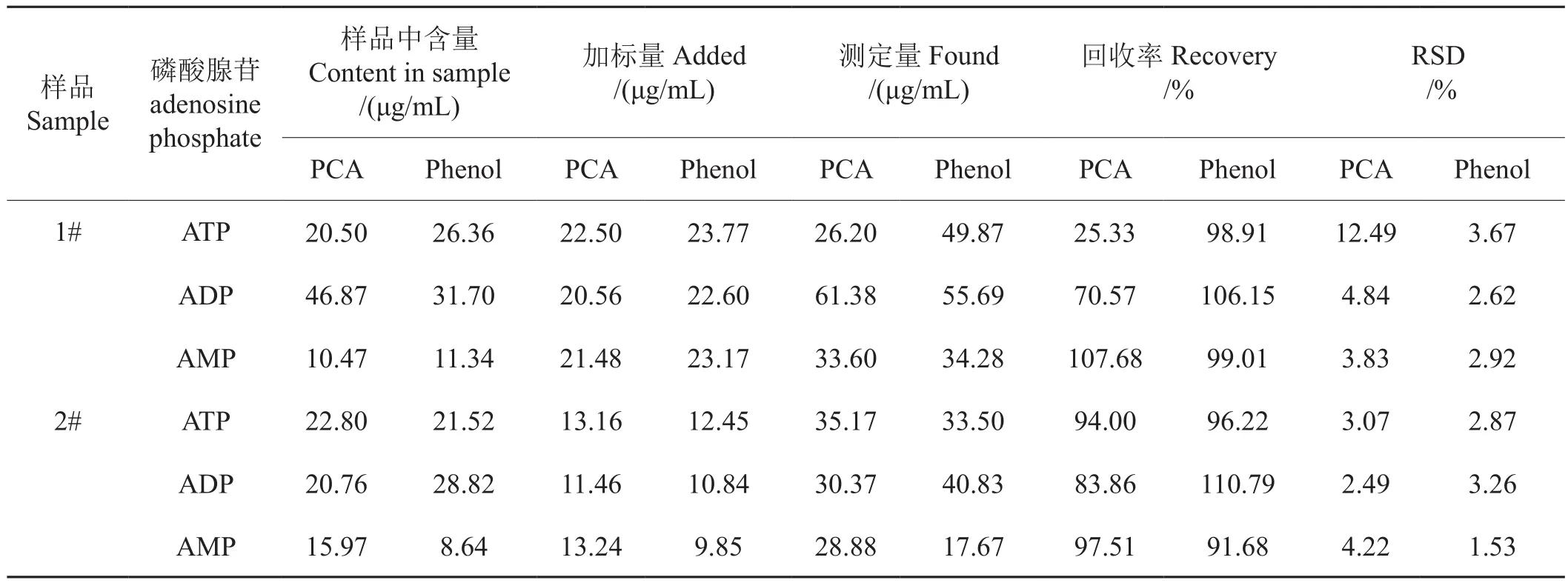
表5 不同萃取方法精密度与回收率比较(n=3)Tab.5 Comparison of recoveries and accuracies between different extraction methods (n=3)
3 结论
建立了一种高效、便捷和精确的超高效液相色谱测定烟草中磷酸腺苷的方法。采用苯酚法提取,三乙胺缓冲液和甲醇进行洗脱,超高效液相色谱法进行检测。3种磷酸腺苷的平均回收率为91.68%~110.79%,RSD<5%,可用于烟草中提取检测磷酸腺苷。
[1]Sugaya K,Nishijima S,Kadekawa K,et al.Relationship between lower urinary tract symptoms and urinary ATP in patients with benign prostatic hyperplasia or overactive bladder [J].Biomed Res,2009,30(5):287-294.
[2]Cheng Y,Mansfield K J,Allen W,et al.Does adenosine triphosphate released into voided urodynamic fluid contribute to urgency signaling in women with bladder dysfunction? [J].J Urol,2010,183(3):1082-1086.
[3]Kumar V,Chapple C R,Rosario D.In vitro release of adenosine triphosphate from the urothelium of human bladders with detrusor overactivity,both neurogenic and idiopathic [J].Eur Urol,2010,57(6):1087-1092.
[4]吴燕川,李尧华,谢胜男,等.液相色谱法测定小鼠脑组织中ATP、ADP及AMP含量[J].首都医科大学学报,2011,32(4):534-537.
[5]张燕婉,龙村,史世勇.反相离子对高效液相色谱法测定心肌组织中的三磷酸腺苷[J].色谱,2000,18(4):322-324.
[6]缪宇,王承龙,殷惠军.高效液相色谱测定大鼠心肌组织腺苷酸含量[J].北京大学学报(医学版),2005,37(2):201-202.
[7]邹玲莉,李秋莎,韩国柱,等.离子对反相高效液相色谱法同时测定大鼠血浆和红细胞中外源性磷酸肌酸及其代谢产物和相关三磷酸腺苷[J].分析化学,2011,39(1):45-50.
[8]Xue X F,Zhou J H,Wu L M,et al.HPLC determination of adenosine in royal jelly [J].Food Chemistry,2009,115(2):715-719.
[9]Kim J,Lee J.Observation and quantification of self-associated adenosine extracted from royal jelly products purchased in USA by HPLC [J].Food Chemistry,2011,126(1):347-352.
[10]Yan L,Ye Z,Peng C,et al.A new perylene diimide-based fluorescent chemosensor for selective detection of ATP in aqueous solution [J].Tetrahedron,2012,68(12):2725-2727.
[11]Moon H S,Im H T,Choi A,et al.Real-time detection of food-borne bacterial adenosine triphosphate (ATP) using dielectrophoretic force and a bioluminescence sensor [J].Microchimica Acta,2010,170(3-4):283-288.
[12]Soldatkin O O,Schuvailo O M,Marinesco S,et al.Microbiosensor based on glucose oxidase and hexokinase co-immobilised on platinum microelectrode for selective ATP detection [J].Talanta,2009,78(3):1023-1028.
[13]Zeng X,Zhang X,Yang W,et al.Fluorescence detection of adenosine triphosphate through an aptamer-molecular beacon multiple probe [J].Analytical Biochemistry,2012,424(1):8-11.
[14]Li F,Du Z,Yang L,et al.Selective and sensitive turn-on detection of adenosine triphosphate and thrombin based on bifunctional fluorescent oligonucleotide probe [J].Biosensors and Bioelectronics,2013,41:907-910.
[15]Chen Z,Li G,Zhang L,et al.A new method for the detection of ATP using a quantum-dot-tagged aptamer [J].Analytical and Bioanalytical Chemistry,2008,392(6):1185-1188.
[16]Chida J,Yamane K,Takei T,et al.An ef ficient extraction method for quantitation of adenosine triphosphate in mammalian tissues and cells [J].Analytica Chimica Acta,2012,727:8-12.
[17]Neufeld H A,Towner R D,Pace J.A rapid method for determining ATP by the firefly luciferin-luciferase system [J].Experientia,1975,31(3):391-392.
[18]Czarnecka J,Cieslak M,Michal K.Application of solid phase extraction and high-performance liquid chromatography to qualitative and quantitative analysis of nucleotides and nucleosides in human cerebrospinal fluid [J].J Chromatogr B:Anal Technol Biomed Life Sci,2005,822(1/2):85-90.
[19]Dhople A M,Hanks J H.Quantitative extraction of adenosine triphosphate from cultivable and host-grown microbes:calculation of adenosine triphosphate pools [J].Applied Microbiology,1973,26(3):399-403.
[20]Lundin A,Thore A.Comparison of methods for extraction of bacterial adenine nucleotides determined by firefly assay [J].Applied Microbiology,1975,30(5):713-721.
[21]代瑞华,刘会娟,曲久辉.铜绿微囊藻中磷酸腺苷的提取及分析[J].分析化学,2007,35(12):1701-1705.
[22]叶菁,王周平,乐国伟,等.微生物ATP提取方法及其在微波灭菌效果快速评价中的应用研究[J].食品与生物技术学报,2010,29(2):172-176.
[23]Noda K,Matsuno T,Fujii H,et al.Single bacterial cell detection using a mutant luciferase [J].Biotechnology Letters,2007,30(6):1051-1054.
[24]陈兰珍,李桂芬,薛晓锋,等.蜂王浆中磷酸腺苷的提取及超高效液相色谱分析[J].色谱,2008,26(6):736-739.
[25]Coolen E J C M,Arts I C W,Swennen E L R,et al.Simultaneous determination of adenosine triphosphate and its metabolites in human whole blood by RP-HPLC and UV-detection [J].Journal of Chromatography B,2008,864(1/2):43-51.
[26]Veciana-Nogues M T,Izquierdo-Pulido M,Vidal-Carou M C.Determination of ATP related compounds in fresh and canned tuna fish by HPLC [J].Food Chemistry,1997,59(3):467-472.
[27]Özogul F,Taylor K D,Quantick P C,et al.A rapid HPLC-determination of ATP-related compounds and its application to herring stored under modi fied atmosphere [J].International Journal of Food Science & Technology,2000,35(6):549-554.
[28]Liu H,Jiang Y,Luo Y,et al.A simple and rapid determination of ATP,ADP and AMP concentrations in pericarp tissue of litchi Fruit by high performance liquid chromatography [J].Food Technol Biotechnol,2006,44(4):531-534.
[29]Xue X F,Wang F,Zhou J H,et al.Online cleanup of accelerated solvent extractions for determination of Adenosine 5’-Triphosphate (ATP),Adenosine 5’-Diphosphate (ADP),and Adenosine 5’-Monophosphate(AMP) in royal jelly using highperformance liquid chromatography [J].J Agric Food Chem,2009,57(11):4500-4505.
[30]寇瑛琍,何才云,刘智敏,等.高效液相色谱法在测定心肌组织中ATP、ADP、AMP 方面的应用[J].华西医学,2000,15(3):295-296.
[31]Manfredi G,Yang L,Gajewski C D,et al.Measurements of ATP in mammalian cells [J].Methods,2002,26(4):317-326.
[32]Mora L,Hernández-Cázares A S,Aristoy M C,et al.Hydrophilic interaction chromatographic determination of adenosine triphosphate and its metabolites [J].Food Chemistry,2010,123(4):1282-1288.
[33]Yeung P,Ding L,Casley W L.HPLC assay with UV detection for determination of RBC purine nucleotide concentrations and application for biomarker study in vivo [J].Journal of Pharmaceutical and Biomedical Analysis,2008,47(2):377-382.
[34]Losa R,Sierra M I,Gion M O,et al.Simultaneous determination of gemcitabine di- and triphosphate in human blood mononuclear and cancer cells by RP-HPLC and UV detection [J].Journal of Chromatography B,2006,840(1):44-49.
[35]Nedden S,Eason R,Doney A S,et al.An ion-pair reversedphase HPLC method for determination of fresh tissue adenine nucleotides avoiding freeze-thaw degradation of ATP [J].Analytical Biochemistry,2009,388(1):108-114.
[36]李立人.植物和微生物中ATP的提取及测定方法评述[J].植物生理学通讯,1986,(4):5-11.
Determination of adenosine phosphate in tobacco leaf by UPLC with phenol-TEA pretreatment
LIN Xiaofeng1,2,WU Yuping1,CHEN Xuejun1,KONG Guanghui1
1 Analysis & Test Center,Yunnan Academy of Tobacco Agricultural Science,Yuxi 653100,China;
2 Department of Materials Science and Engineering,Yunnan University,Kunming 650091,China
A analytical method for simultaneous determination of adenosine triphosphate (ATP),adenosine diphosphate (ADP) and adenosine monophosphate (AMP) in fresh tobacco leaves was established by ultra high performance liquid chromatography (UPLC)with phenol extraction.ATP,ADP and AMP in phenol extraction were stable and dif ficult to be hydrolyzed with rate of change less than 10% within 2 hours.A better separation of ATP,ADP and AMP was achieved in 10 minutes by utilizing a gradient elution system of 6 ‰triethylamine (pH = 6.6) and methanol as mobile phase.The linear range was between 5~200 µg.mL-1with adenosine concentration and peak area were highly correlated (r> 0.9999).The detection limits for ATP,ADP and AMP were 0.5 µg.mL-1,0.4 µg.mL-1,0.3 µg.mL-1respectively,and average recovery rate was 91.68% ~ 110.79% with RSD ranged between 1.53%~3.67%.This method can quickly and accurately detect ATP content in tobacco samples,thus providing important test indicators for the study of energy metabolism,especially tobacco CMS generation mechanism.
UPLC; adenosine phosphate; phenol; fresh tobacco leaves
10.3969/j.issn.1004-5708.2014.01.005
TS411
A
1004-5708(2014)01-0026-06
国家烟草专卖局“烟草育种新技术研究及新一轮优质抗病烤烟新品种选育”(合同号:110201002001)
林小峰(1989—),在读硕士,研究方向为仪器分析及材料化学,Tel:0877-2075072,Email:15807613143@qq.com
吴玉萍(1974—),硕士,副研究员,研究方向为仪器分析及烟草化学,Tel:0877-2075072,Email:ypwumm@163.com
2013-07-30

