高浓度苯酚降解菌的分离鉴定及降解特性的研究
龙燕,谢作崧
(1武汉大学 生命科学学院,武汉 430072;2广西大学 生命科学与技术学院,南宁 530004)
苯酚是工业上较为多见的一类污染源,具有毒性大,分布范围广的特点,在造纸、印染、制药、塑料、炼焦等多种工业领域的产出废弃物中均有存在[1-6].目前世界上的多种苯酚污染治理方法中占据主导地位的有物理法、化学法和生物降解法,以及这几种方法相互联用的处理技术.而苯酚生物降解方法因其具有绿色、高效、经济等优势,并且还可达到相关污染物矿化的目的,因此它在苯酚污染治理行业中被广泛应用[7].
围绕苯酚生物降解已进行了大量研究,文献已报道的用于苯酚降解的微生物种类繁多,如Rhodococcus erythropolis[8],Pseudomonassp.[8],Alcaligenessp.[10],Fusariumsp.[11],Trichosporon cutaneum[12],Bacillus brevis[13]等.目前已报道的苯酚降解菌大部分对苯酚的耐受浓度较低(低于1000 mg/L),且不同环境中分离的苯酚降解菌并不具备理想的目标环境适应性[14-15].如果能从目标环境中分离具有高效降解能力的土著优势菌,处理效果会明显升高.因此,有必要从需治理的目标环境中分离获得能降解高浓度苯酚的土著菌株,并将扩大培养的高浓度苯酚降解土著菌株投入到目标环境中,土著菌对目标环境具有很好的适应性,这就使得目标环境中苯酚污染的生物降解治理成为可能.
本文从钢厂长期受到苯酚污染的土壤中首次分离出目标环境的可降解高浓度苯酚的土著真菌,并进行了纯化和鉴定,初步了解其苯酚降解生物学特性,为丰富真菌的苯酚降解研究及目标环境中苯酚污染的生物治理奠定了基础.
1 材料和方法
1.1 实验材料
实验所用土壤是从湖北省黄石新冶钢有限公司东钢厂区受苯酚污染严重的区域获取.
1.2 培养基
MSM培 养 基:KH2PO41 g/L,(NH4)2SO41 g/L,MgSO4·7H2O 0.5 g/L[16].LB培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L.YEPD培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母粉10 g/L.
1.3 高浓度苯酚降解菌的筛选和分离
1.3.1 高浓度苯酚降解菌的驯化和筛选
10 g土壤样品加入盛有90 mL无菌水并带有玻璃珠的三角瓶中,在摇床上震荡约3 h,让土壤与水充分混合,接着静置20到30 min.取50 mL土壤悬液加入盛有含300 mg/L苯酚的100 mL液体无机盐基础培养基的三角瓶内,30℃,200 r/min,摇床培养.按1∶2接种比例进行转接,每次转接时,培养基中苯酚浓度逐渐增加至300 mg/L.
1.3.2 高浓度苯酚降解菌的分离纯化
将驯化培养30 d后的培养液进行梯度稀释,分别取10-6、10-8、10-10稀释度的培养液0.1 mL涂布于300 mg/L苯酚的MSM固体平板上,30℃培养,直至有明显菌落长出.挑取单菌落继续划线分离纯化,将纯化后的单菌落进行编号和菌种保存.将这些菌种分别接种于含300 mg/L苯酚的LB液体培养基中,30℃,200 r/min,摇床培养24 h.每个菌种分别取培养液0.1 mL依次涂布在含500、900、1200、1500、2000 mg/L苯酚的MSM固体平板,30℃培养,能在含苯酚浓度最高的MSM固体平板生长的菌种,即为高浓度苯酚降解菌.
1.4 高浓度苯酚降解菌的鉴定
1.4.1 高浓度苯酚降解菌形态观察
将分离纯化得到的高浓度苯酚降解菌接种于LB液体培养基中,培养24 h后,显微镜观察其形态.镜检初步确定降解菌种类后,稀释菌液涂布于YEPD平板上,观察其在YEPD平板上的菌落形态.
1.4.2 高浓度苯酚降解菌分子生物学鉴定
将菌种接种于含苯酚300 mg/L的YEPD液体培养基中,30℃,200 r/min,摇床培养24 h,然后收集菌体,提取基因组,测序.得到的28S rDNA序列上传到NCBI,BLAST比对,构建系统发育树(邻接法)[19-20].
1.5 高浓度苯酚降解菌降解特性研究
(1)pH值对菌株降解苯酚影响.配制pH分别为3.0、5.0、6.0和7.0的含苯酚浓度为800 mg/L的MSM培养基[16],按照4%(V/V)进行接种,30℃下培养,在不同的时间点取样测定苯酚浓度.
(2)温度对苯酚降解的影响.配制pH为6.0含苯酚浓度为800 mg/L的MSM培养基,按照4%(V/V)进行接种,设定20、25、30、37、45℃为培养温度,在不同的时间点取样测定苯酚浓度.
(3)为探究接种量对苯酚的降解影响,配制pH为6含苯酚浓度为800 mg/L的MSM培养基,分别按照2%、4%、6%和8%(V/V)进行接种,30℃下培养,在不同的时间点取样测定苯酚浓度.
苯酚浓度采用高效液相色谱法测定.C18色谱柱,柱箱温度40℃,流动相60%甲醇,设定0.5 mL/min流速.样品用0.22 μm的滤膜过滤处理.
2 实验结果
2.1 高浓度苯酚降解菌的分离纯化
经驯化筛选、纯化后分离出一株高浓度苯酚降解菌,苯酚降解浓度可达1200 mg/L将该菌株编号记为LY500.
2.2 高浓度苯酚降解菌的形态观察
菌株LY500在YEPD平板上的生长形态为乳白色的圆形菌落,菌落表面较为湿润,容易挑取(图1(a)).显微镜观察菌体呈椭球形,出芽生殖(图1(b)),初步判断为酵母菌.
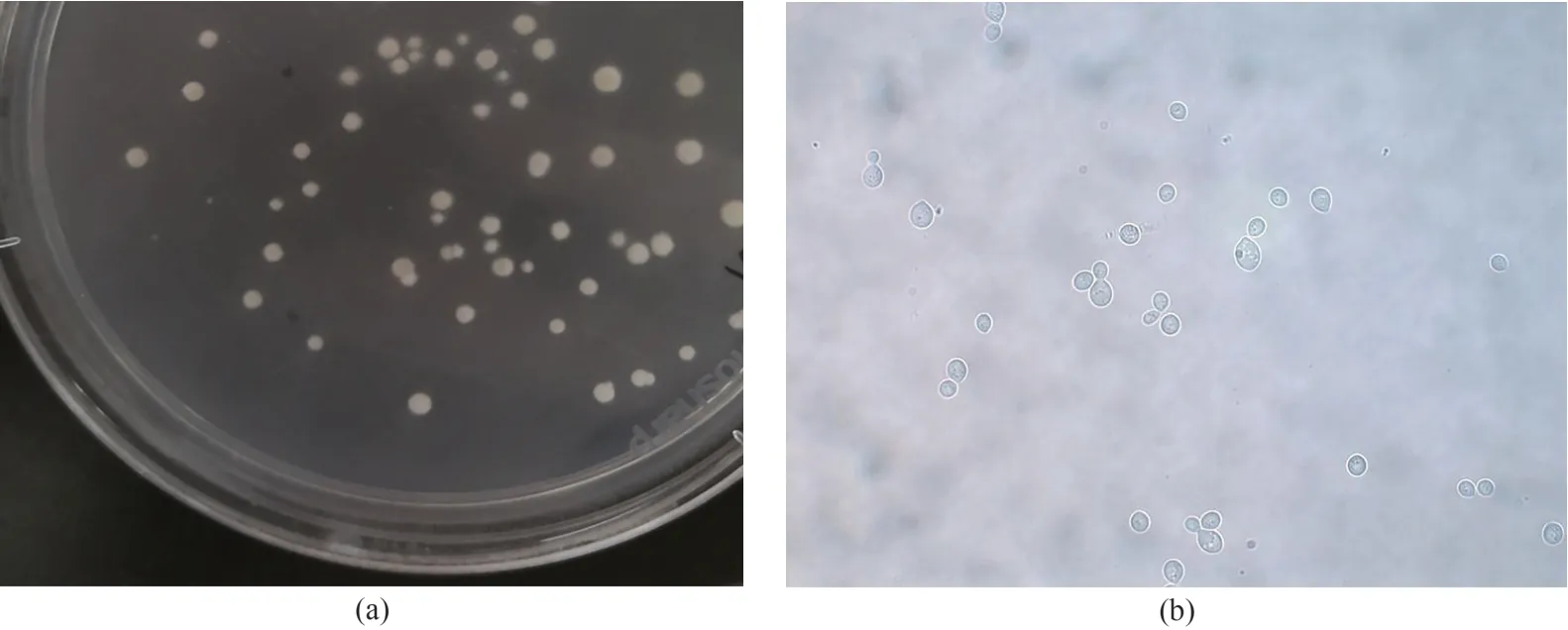
图1 菌株LY500在YEPD平板上的生长形态(a)和显微观察结果(b)Fig.1 Morphology of strain LY500 in YEPD plate(a)and microscopic result of of strain LY500(b)
2.3 高浓度苯酚降解菌的分子生物学鉴定
菌株LY500的28S rDNA序列长度为607 bp(图2).将得到菌株的28S rDNA序列上传至GenBanK核酸数据库,根据BLAST比对结果,用由MEGA-X软件构建的系统发育树(图3),菌株LY500可初步鉴定为丝孢酵母菌属Cutaneotrichosporonsp.(曾用名Trichosporonsp.).

图2 菌株LY500的28S rDNA序列Fig.2 The 28S rDNA sequence of strain LY500

图3 菌株LY500的28S rDNA系统发育树Fig.3 The 28S rDNA phylogenetic tree of strain LY500
2.4 高浓度苯酚降解菌降解特性研究
2.4.1 最适降解温度
在培养条件因素中,温度是微生物降解动力学的重要影响因素,也是影响菌体生长和底物降解活性的主要因素之一.实验结果表明(图4),温度在20℃到37℃在之间时,菌株LY500均能在15 h内将苯酚完全降解,且温度30℃时,苯酚降解速率相对较快,当温度升高至45℃时,仅能微量降解苯酚.上述研究结果表明,30℃为菌株LY500的最佳降解温度,因此将30℃作为后续实验的温度条件.
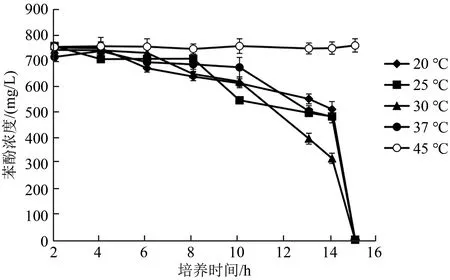
图4 温度对苯酚降解的影响Fig.4 Effect of temperature on phenol degradation
2.4.2 最适降解pH值
各种微生物都有其最适pH值和一定的pH耐受范围,因为微生物对营养物质的吸收,代谢过程中酶的活性均受到环境pH值的影响,进而微生物降解过程也受到环境pH值的影响.该菌株在起始pH为5.0~7.0时,苯酚降解过程没有显著差异,苯酚均能在14 h内被完全降解(图5).在起始pH为3.0时,仅能微量降解苯酚.以上结果表明,菌株对pH值环境适应能力较强,在pH为5.0~7.0的范围内,均能快速有效降解初始浓度为800 mg/L的苯酚.

图5 pH对苯酚降解的影响Fig.5 Effect of pH value on phenol degradation
2.4.3 接种量对苯酚降解的影响
接种量对苯酚的降解影响结果见图6.在不同接种量下,菌种延滞期长短接近,基本为6 h左右.菌株在进入指数生长期后,不同接种量下苯酚降解速度差别较大,苯酚降解速度随着接种量的增加而增加.当接种量为2%时,苯酚完全降解需要15 h,当接种量为4%时,苯酚完全降解需要14 h,当接种量为6%时,苯酚完全降解需要13 h,当接种量为8 %时,苯酚降解最快,在10 h完全降解.

图6 接种量对苯酚降解的影响Fig.6 Effect of the inoculum size on phenol degradation
3 结论与展望
从钢厂中长期受到苯酚污染的土壤中首次分离出该目标环境的高浓度苯酚降解土著真菌菌株LY500,经初步鉴定属丝孢酵母菌属,该菌株苯酚降解浓度可高达1200 mg/L,高于已有文献报道的丝孢酵母菌苯酚降解浓度[14-15].且菌株LY500对温度和pH值都有很好的环境适应能力,温度在20℃到37℃之间,pH在5.0~7.0之间,菌株LY500都能在15 h内快速降解起始浓度为800 mg/L的苯酚溶液.
丝孢酵母菌在自然界中分布广泛,对环境的适应能力强,具有高浓度苯酚降解能力的丝孢酵母菌在苯酚污染治理中具有重要意义.目前国内外微生物苯酚降解的研究主要集中于细菌,如假单胞菌(Pseudomonassp.)、芽孢杆菌(Bacillussp.)等[16-18],对于真菌的苯酚降解研究相对较少,后续会将此高浓度苯酚降解丝孢酵母菌扩大培养后,投加到目标环境中,用于苯酚污染土壤的生物治理.
- 中南民族大学学报(自然科学版)的其它文章
- 巯基功能化碳纳米管吸附稀土元素研究
- Copper(II)-mediated cascade cyanomethylation of arylacrylamides to access cyano substituted quinoline-2,4-diones
- 不同采收期对野菊花质量的影响
- 城市黑臭水体的无人机高光谱遥感识别
- Optical and electrical performance of titanium-gallium-zinc oxide transparent semiconductor thin films
- 一类电压采样电阻异常的电能表计量失准研究

