肾移植继发自身免疫病理具有组织损伤依赖性①
方 成 肖显杰 万 卉 丁洪波 刘 立 陈 卓 杨 清 陈慧敏 梅智强
(武汉轻工大学医学院移植免疫实验室,武汉430023)
器官移植后继发自身免疫反应现象已有广泛报道[1-5],有些自身免疫抗体水平可作为监测移植物病变程度的指标[6-8]。虽然自身免疫反应与移植物病变程度有相关性,但尚未有研究报道移植后继发自身免疫的致病性。移植物病变是异体排斥、固有免疫、缺血再灌注损伤等多因素导致的结果[9-12],只有先甄别自身免疫效应才能独立检测其致病性。
使用F344-Lewis大鼠同种肾移植组合,可稳定得到慢性移植肾肾病模型[13]。8周后肾功能出现异常,具有移植肾肾病特征性病理改变。对自身组织蛋白vimentin的免疫监测,发现移植受体发生了vimentin体液及细胞免疫[14]。本实验在移植后继发自身免疫反应的研究基础上,对其致病性(不限于vimentin免疫)进行研究。
1 材料与方法
1.1 动物及试剂 雄性近交系F344(RT11v1)和Lewis(RT11)大鼠,12~15周龄,体质量220~250 g,由北京维通利华实验动物技术公司提供(许可证号SCXK京2006-0009),20℃~24℃/12 h光照条件下标准鼠粮饲养。实验过程遵循中华人民共和国科技部《关于善待实验动物的指导性意见》。
1.2 大鼠肾移植模型及分组 Lewis大鼠左肾被F344大鼠供肾取代,7天后行右侧肾切除术,受体不使用免疫治疗长期存活,建立经典慢性移植肾肾病(CAN)模型[13]。改良该模型,保留受体大鼠右侧自体肾;术后7天探查左侧移植肾,确定血供正常,输尿管通畅,建立自体肾损害(Autoimmune injury)观测组(AI组,n=3)。正常Lewis大鼠切除左肾,右侧肾蒂阻断45 min[15],建立单纯缺血再灌注(Ischemia reperfusion)组(IR组,n=3)。在IR组建模程序基础上,另经下腔静脉输注同系CAN大鼠脾细胞(5×107个)悬液1 ml,建立自身免疫过继并自体肾缺血再灌注组(AR组,n=4)。Lewis大鼠自体肾移植(Syngenic transplant)作为对照(Syn组,n=3)。
1.3 脾细胞悬液的制备 无菌收获大鼠脾脏,将脾脏研磨通过200目不锈钢滤网。裂解红细胞后,有核细胞以 PBS清洗2次,细胞重悬于 PBS液[16]。台盼蓝拒染法计数,活细胞>95%。脾细胞悬液4℃保存,1 h内输注受体。
1.4 酶联免疫吸附试验(ELISA) 为检测大鼠血清中的vimentin抗体[14],先以重组大鼠vimentin蛋白(Cytoskeleton公司)10 μg/ml包埋 ELISA 板4℃过夜,仅加入PBS作为对照孔。洗板并以3%牛血清白蛋白封闭后,加入稀释大鼠血清样本(1/25)37℃孵育2 h。洗板后加入HRP标记山羊抗大鼠IgG抗体(Santa Cruze公司)检测,最终加入底物TMB(碧云天公司)显色20 min,用iMARK酶标仪(Bio-Rad公司)读取415 nm吸光度。
1.5 蛋白尿指标检测 术后14天开始收集尿液进行肾功能检测,受体代谢笼内禁食可随意饮水,收集24 h尿液。尿总蛋白浓度(g/L)以考马斯亮蓝法,尿肌酐浓度(mmol/L)以苦味酸法,使用Aeroset全自动生化分析仪(Abbott公司)测定。蛋白尿(Proteinuria)指标依照以下公式计算[16]:蛋白尿(g/mmol)=尿蛋白(g/L)/尿肌酐(mmol/L)。
1.6 肾脏组织学检测 大鼠肾脏以4%甲醛固定,石蜡切片行HE染色,肾小球出现毛细血管袢皱缩、塌陷和闭塞为肾小球硬化。根据硬化面积占单个肾小球比例进行评分,无硬化改变为0分,硬化面积≤25%、≤50%、≤75%、>75% 分别计 1、2、3、4 分。随机观测25个肾小球,计算平均数为肾小球硬化指数(Glomerulosclerosis index,GSI)[17]。
1.7 肾脏IgG抗体沉积检测 以常规免疫组化及免疫荧光染色检测肾脏组织IgG沉积。石蜡切片经抗原修复后,以 HRP标记山羊抗大鼠 IgG抗体(Santa Cruze公司)室温下孵育30 min,以DAB底物(碧云天公司)显色。另用Cy3标记山羊抗大鼠IgG抗体(Jackson公司)对肾脏组织染色,荧光显微镜下观测。
1.8 统计学分析 统计分析使用Prism(4.00)软件。数值用表示。多组间数据比较使用方差分析,辅以指定两组间秩和检验。所有统计分析使用双侧比较,P<0.05则差异具有显著性。
2 结果
2.1 血清vimentin抗体水平(图1) 各组模型第10周收获血清,检测vimentin抗体水平。以自体肾移植大鼠(Syn组)血清vimentin抗体水平(0.061±0.012)为对照,单纯缺血再灌注大鼠(IR组)的血清vimentin抗体水平(0.064±0.011)无明显变化。同种肾移植大鼠(AI组)vimentin抗体水平显著升高(0.312±0.036)。慢性移植肾肾病大鼠的脾细胞输注同系大鼠后(AR组),vimentin体液免疫实现过继,处于升高状态(0.310±0.017)。
2.2 蛋白尿指标时间曲线(图2) 同种肾移植受体保留健肾(AI组),观测蛋白尿指标至40 W,未出现持续肾功能异常。肾脏单纯缺血再灌注组(IR组)观测至40W亦无肾功能异常(proteinuria<0.05 g/mmol)。自免过继并肾缺灌组(AR组)在第18W蛋白尿水平升高至(0.18±0.03)g/mmol,其后持续缓慢上升,观测至第40周为(0.23±0.04)g/mmol,蛋白尿变化具有显著性。
2.3 肾小球硬化指数 AI组40周时同种移植肾已极度萎缩硬化,同时收获自体肾未见肾小球硬化(图3)。IR组40周收获缺血再灌注肾脏,未见肾小球硬化。AR组40周收获自体肾,发生广泛肾小球硬化(GSI为1.24±0.16)及局部细胞浸润(图3)。

图1 第10周血清vimentin IgG抗体水平Fig.1 The levels of vimentin IgG antibodies in serum at the 10thweeks

图2 蛋白尿动态检测Fig.2 Theproteinuria levelsofthe 3 groupsat different times

图3 第40周自体肾组织学检测(HE)Fig.3 Light microscopie examination of autologous kidney at the 40thweeks(HE)
2.4 肾脏自身抗体IgG沉积检测 AI组及IR组自体肾未测到IgG沉积,常规组化及荧光染色为阴性。AR组自体肾广泛IgG沉积,常规组化(图4左)及荧光染色(图4右)呈强阳性。
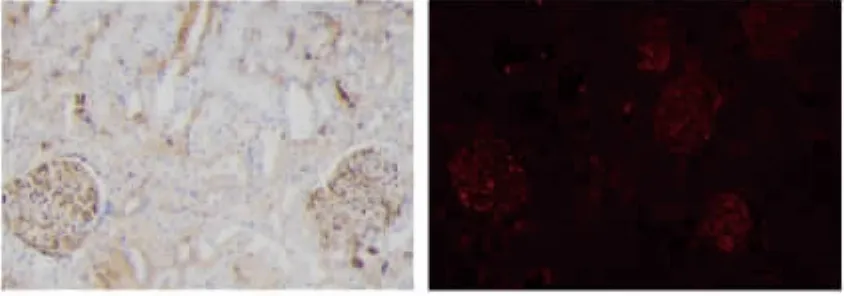
图4 第40周自体肾组织IgG沉积检测Fig.4 The IgG deposits in autologous kidney of AR group at the 40thweeks
3 讨论
有报道器官移植后继发自身免疫反应,已发现的人体肾移植后自身反应性组织蛋白有agrin、vimentin、Hsp60[18-20]。在实验肾移植模型中组织蛋白vimentin自身反应性普遍存在[21,22]。大鼠同种肾移植后第4周可检测到抗vimentin抗体,抗体水平持续上升,与CAN的加重正相关[8]。在本实验室对大鼠同种肾移植及CAN的研究中,不仅发现了vimentin抗体(高水平)及另一种肾脏组织蛋白megalin抗体(低水平)的持续存在[14,16],还检测到 vimentin反应性T细胞。鉴于自身抗体或淋巴细胞并非都具有致病性,肾移植继发自身免疫的病理性有待鉴定。由于异体排斥反应与自身免疫反应在受体的共同存在,以及慢性移植肾肾病的非特异性病理表现,需要设计实验甄别继发自身免疫导致的移植肾损害。
传统单侧原位肾移植模型均摘除对侧自体肾[13,16],本实验设计使用了 AI及 AR 两种改良模型。AR模型中没有异体MHC抗原,可以除外MHC抗原抗体复合物的影响。结果模型AI至40周时同种移植肾已极度萎缩自截,而自体肾功能、病理保持正常。模型AR的自体肾在18周出现功能异常,40周出现肾小球硬化。而单纯缺血再灌(IR)模型观测至40周无不可逆损伤,有报道肾脏缺血再灌注模型观察至20周未发生任何纤维化改变[15]。对模型的自体肾作抗体沉积检测,AI及IR组均未发现IgG沉积,AR组则出现IgG沉积。以上实验证明过继的移植后自身免疫在缺血再灌注损伤基础上具有病理性,抗原抗体反应参与了该自身免疫病理。有理由推断在异体排斥引起组织损伤基础上,CAN模型中的继发自身免疫可以发展出致病性。
在前期对F344-Lewis大鼠同种肾移植CAN模型的研究中,也对肾功能进行了持续监测[13]。慢性排斥肾移植组蛋白尿水平在2~6周即升高,维持于(0.15~0.20)g/mmol,术后8周明显上升达到(0.42±0.17)g/mmol,第14周时上升至(1.43±0.55)g/mmol,受体已难以存活。本实验中自身免疫肾功能损害在第18周出现,至40周蛋白尿水平为(0.23±0.04)g/mmol。虽然在40周内肾移植继发自身免疫导致的肾功能损害强度较低,但已经导致广泛的肾小球硬化及抗体沉积,肾功能损害往往会加速增强[23,24]。除了体液免疫参与移植肾自身免疫损害,在部分自体肾病理检测中还发现了局部细胞浸润。对更长期存活的临床移植肾,自身免疫损害强度难以忽视。
异体排斥反应导致的免疫调节异常及自身抗原性质的改变,可能使禁忌的自身反应淋巴细胞活化,在同种肾移植后引发自身免疫。虽然该自身免疫可以处于不致病的“生理性自身免疫”状态(AI组),肾单纯缺血再灌注损伤(IR组)亦未出现慢性损害,但基于肾缺血再灌注损伤该“生理性自身免疫”转变为了“病理性自身免疫”(AR组)。其发生机制可能与损伤相关分子模式(DAMP)有密切关系,某些内源性的损伤相关分子如缺氧诱导因子1(HIF-1)、高迁移率族蛋白B-1(HMGB1)等[25-27],应激或损伤情况下从细胞内释放,使固有免疫活化并可促进获得性免疫的发展。
而vimentin的一些免疫学特征令人关注,该蛋白是高度保守的细胞骨架中间纤维蛋白,在肾小球、肾小管及间质细胞有丰富表达,分子量约57 kD[28]。近年的研究发现vimentin在肿瘤发生中参与细胞的黏附和迁移[29];前列腺素A1可与vimentin共价结合,可能通过这种结合而发挥抗炎作用[30]。vimentin能在细胞损伤时释放,如果具有募集趋化能力,或促淋巴细胞活化与分化的能力,则可促进自身免疫的发展。vimentin可能具有的其他免疫学特征,将是后续工作感兴趣的内容。
[1]Porcheray F,DeVito J,Yeap BY,et al.Chronic humoral rejection of human kidney allografts associates with broad autoantibody responses[J].Transplantation,2010,89(10):1239-1246.
[2]Win TS,Rehakova S,Negus MC,et al.Donor CD4 T cells contribute to cardiac allograft vasculopathy by providing help for autoantibody production [J].Circ Heart Fail,2009,2(4):361-369.
[3]Goers TA,Ramachandran S,Aloush A,et al.De novo production of K-alpha1 tubulin-specific antibodies:role in chronic lung allograft rejection [J].J Immunol,2008,180(7):4487-4494.
[4]Miyagawa-Hayashino A,Haga H,Egawa H,et al.Outcome and risk factors of de novo autoimmune hepatitis in living-donor liver transplantation[J].Transplantation,2004,78(1):128-135.
[5]Dieterle CD,Hierl FX,Gutt B,et al.Insulin and islet autoantibodies after pancreas transplantation [J].Transpl Int,2005,18(12):1361-1365.
[6]Azimzadeh AM,Pfeiffer S,Wu GS,et al.Humoral immunity to vimentin is associated with cardiac allograft injury in nonhuman primates[J].Am J Transplant,2005,5(10):2349-2359.
[7]Tanaka M,Zwierzchoniewska M,Mokhtari GK,et al.Progression of alloresponse and tissue-specific immunity during graft coronary artery disease[J].Am J Transplant,2005,5(6):1286-1296.
[8]杨 立,卢一平,宋 君,等.大鼠肾移植后抗波形蛋白抗体升高与慢性移植肾肾病的相关性[J].中华器官移植杂志,2008,29(12):737-740.
[9]Birnbaum LM,Lipman M,Paraskevas S,et al.Management of chronic allograft nephropathy:a systematic review[J].Clin J Am Soc Nephrol,2009,4(4):860-865.
[10]Snell GI,Westall GP.The contribution of airway ischemia and vascular remodelling to the pathophysiology of bronchiolitis obliterans syndrome and chronic lung allograft dysfunction [J].Curr Opin Organ Transplant,2010,15(5):558-562
[11]Shilling RA,Wilkes DS.Immunobiology of chronic lung allograft dysfunction:new insights from the bench and beyond[J].Am J Transplant,2009,9(8):1714-1718.
[12]Desai M,Neuberger J.Chronic liver allograft dysfunction[J].Transplant Proc,2009,41(2):773-776.
[13]方 成,刘 立,胡汉宁,等.大鼠双侧供肾左侧原位肾移植模型的建立及肾功能监测[J].中国组织工程研究与临床康复,2010,14(53):9933-9936.
[14]方 成,刘 立,陈 薇,等.慢性排斥肾移植大鼠继发对自身组织蛋白vimentin的细胞与体液免疫反应[J].中国免疫学杂志,2012,28(1):45-49.
[15]Appenroth D,Lupp A,Kriegsmann J,et al.Temporary warm ischaemia,5/6 nephrectomy and single uranyl nitrate administration-comparison of three models intended to cause renal fibrosis in rats[J].Exp Toxicol Pathol,2001,53(4):316-324.
[16]Fang C,Ballet C,Dugast AS,et al.Autoimmune responses against renal tissue proteins in long-term surviving allograft recipients[J].Transpl Int,2009,22(11):1091-1099.
[17]Bobkova I N,Chebotareva NV,Kozlovskaia LV,et al.Urine excretion of a monocytic chemotaxic protein-1 and a transforming growth factor beta1 as an indication of chronic glomerulonephritis progression[J].Ter Arkh,2006,78(5):9-14.
[18]Joosten SA,Sijpkens YW,van Ham V,et al.Antibody response against the glomerular basement membrane protein agrin in patients with transplant glomerulopathy [J].Am J Transplant,2005,5(2):383-393.
[19]Carter V,Shenton BK,Jaques B,et al.Vimentin antibodies:a non-HLA antibody as a potential risk factor in renal transplantation[J].Transplant Proc,2005,37(2):654-657.
[20]Caldas C,Luna E,Spadafora-Ferreira M,et al.Cellular autoreactivity against heat shock protein 60 in renal transplant patients:peripheral and graft-infiltrating responses[J].Clin Exp Immunol,2006,146(1):66-75.
[21]Jonker M,Danskine A,Haanstra K,et al.The autoimmune response to vimentin after renal transplantation in nonhuman prima-tes is immunosuppression dependent[J].Transplantation,2005,80(3):385-393.
[22]Mahesh B,Leong HS,Nair KS,et al.Autoimmunity to vimentin potentiates graft vasculopathy in murine cardiac allografts[J].Transplantation,2010,90(1):4-13.
[23]Le Berre L,Hervé C,Buzelin F,et al.Renal macrophage activation and Th2 polarization precedes the development of nephrotic syndrome in Buffalo/Mna rats[J].Kidney Int,2005,68(5):2079-2090.
[24]Oleinikov AV,Feliz BJ,Makker SP.A small N-terminal 60-kD fragment of gp600(megalin),the major autoantigen of active Heymann nephritis,can induce a full-blown disease[J].J Am Soc Nephrol,2000,11(1):57-64.
[25]Dang EV,Barbi J,Yang HY,et al.Control of T(H)17/T(reg)balance by hypoxia-inducible factor 1 [J].Cell,2011,146(5):772-784.
[26]Duan L,Wang CY,Chen J,et al.High-mobility group box 1 promotes early acute allograft rejection by enhancing IL-6-dependent Th17 alloreactive response [J].Lab Invest,2011,91(1):43-53.
[27]Bonilla WV,Fröhlich A,Senn K,et al.The alarmin interleukin-33 drives protective antiviral CD8+T cell responses[J].Science,2012,335(6071):984-989.
[28]Ivaska J,Pallari HM,Nevo J,et al.Novel functions of vimentin in cell adhesion,migration,and signaling[J].Exp Cell Res,2007,313(10):2050-2062.
[29]Zhao Y,Yan Q,Long X,et al.Vimentin affects the mobility and invasiveness of prostate cancer cells[J].Cell Biochem Funct,2008,26(5):571-577.
[30]Gharbi S,Garzón B,Gayarre J,et al.Study of protein targets for covalent modification by the antitumoral and anti-inflammatory prostaglandin PGA1:focus on vimentin[J].J Mass Spectrom,2007,42(11):1474-1484.

