ESAT-6对人外周血γδT细胞IL-17的影响及其信号通路的研究①
王 娟 杜发旺 杜先智 (重庆医科大学第二附属医院呼吸内科,重庆400010)
IL-17是一种具有多种生物学效应的炎症因子,主要由TH17细胞、γδT细胞、NKT细胞、巨噬细胞等产生,可诱导机体产生多种细胞因子、趋化因子以及炎症相关效应物,参与机体抗感染、肿瘤及自身免疫性疾病的发生及发展[1-3],近年来大量的研究显示 γδT 细胞能大量的产生 IL-17[4],γδT 细胞产生IL-17受多种因素的影响,且和IL-17相关的疾病有着密切的联系[3]。结核杆菌早期分泌抗原-6(Early secreted antigenic target-6,ESAT-6)是结核杆菌早期产生的分泌靶抗原,有多个T细胞抗原决定簇,有极强的免疫原性及抗原特异性,能激活γδT细胞的功能[5,6]。为了研究 ESAT-6 对 γδT 细胞 IL-17 表达的影响,本研究用ESAT-6刺激γδT细胞,并通过探讨STAT3通路对ESAT-6刺激γδT细胞IL-17的转录及表达的影响,从细胞内信号的角度更深入的解析ESAT-6刺激γδT细胞的作用机制。
1 材料与方法
1.1 材料 ESAT-6抗原、STAT3通路特异性抑制剂S3I-201购自美国Sigma公司,Trizon RNA提取试剂盒、Taq DNA聚合酶、dNTP、markerDL1000等PCR试剂及IL-17、STAT3引物购自大连宝生物TaKaRa公司,Western blot配胶试剂盒购自碧云天生物技术研究所,IP蛋白裂解液购自南京凯基生物科技发展有限公司,尼龙毛柱购自日本WAKO公司,淋巴细胞分离液购自中国医学科学院生物工程研究所,白细胞介素-2(IL-2)购自Peprotech公司,Anti-human gamma delta TCR-FITC、Mouse IgG1 K Isotype Control FITC购自美国eBioscience公司,IL-17酶联免疫吸附试验试剂盒购自美国Sigma公司,STAT3抗体购自购自Abcam公司,RPMI1640干粉、胎牛血清购自美国Gibco公司,流式细胞仪(FCM)购自美国Beckman Coulter公司。
1.2 方法
1.2.1 外周血单个核细胞的制备 抽取健康志愿者血液40 ml,与Hank's液40 ml混匀后,取消毒灭菌的50 ml离心管2只,加入20 ml淋巴细胞分离液,将混匀的血液加入淋巴细胞分离液面上,注意保持分界面清晰。以2 000 r/min离心15 min,吸取第二层环状乳白色淋巴细胞层,将吸取细胞加入5 ml PBS,以800 r/min,离心洗涤3 次,每次10 min,所得白色细胞沉淀即为外周血单个核淋巴细胞(PBMC),将所得的单个核淋巴细胞转入50 ml培养瓶中,加入3 ml含有10%的RPMI1640培养液,放置于5%、37℃恒温培养箱中培养。
1.2.2 尼龙毛柱分离T淋巴细胞 将尼龙毛柱用37℃PBS和含有10%的RPMI1640培养液进行浸润预湿处理,将培养3 d的PBMC细胞用完全培养基RPMI1640调整细胞浓度至108ml-1,加入经预湿处理的尼龙毛柱中,上样量约为1/3柱体积,再加入37℃的完全培养液 RPMI1640 5 ml,密封,放置于37℃、5%CO2恒温培养箱中孵育1 h,然后用 RPMI1640冲洗尼龙毛柱,收集所得细胞即为外周血T淋巴细胞。
1.2.3 γδT细胞分离纯化及培养 将所得的外周血T淋巴细胞用PBS调整细胞浓度至108ml-1,加入Anti-human gamma delta TCR-FITC荧光抗体,以Mouse IgG1 K Isotype Control FITC荧光抗体为同型阴性对照,在37℃、5%CO2恒温培养箱中孵育1 h,用流式细胞仪分离纯化γδT细胞,即将消毒灭菌的一次性分离管插入浓缩的细胞中,将所有的T淋巴细胞经一次性管道吸入流式细胞仪内,由于FITC是属于绿色荧光,经绿色荧光通道出来后在另一端进入准备好的流式管内就可以收集到绿色荧光标记的纯度较高的γδT细胞(全过程需要注意使用一次性分离管,并且流式细胞仪需要提前消毒,避免污染),并检测 γδT细胞的纯度。将分离获取的 γδT细胞培养于50 ml培养瓶中,加入3 ml完全培养基RPMI1640,同时加入唑来磷酸(终浓度为300 pg/ml)、IL-2(终浓度为200 I/ml)刺激γδT细胞扩增,每隔2天换一次液,并同时加入同等浓度的唑来磷酸及IL-2,培养12天后,用RPMI1640调整细胞浓度至105ml-1备用。
1.2.4 分组处理γδT细胞 将γδT细胞培养于6孔板中,每孔中加入2×105个细胞,培养24 h后,随机分为四组:对照组(不加入ESAT-6及S3I-201)、ESAT-6刺激组(20 μg/ml)、ESAT-6+S3I-201 组、S3I-201组(S3I-201浓度为30 μmol/L),将处理好的细胞放置于5%CO2、37℃的恒温培养箱中培养24 h,每个实验组设置5个复孔,重复5次。
1.2.5 PCR检测IL-17基因转录 将各处理组的细胞用Trizol法提取总RNA,并用紫外分光光度仪测RNAOD260 nm/OD280 nm值,确保比值介于1.8~2.0之间。并参照TaKaRa逆转录说明书获得cDNA,以两步法进行RT-PCR,按照PCR说明书配制反应液:SYBR®Prime EX TaqTMⅡ(2 ×)12.5 μl,PCR Forward Primer 10 μmol/L,PCR Reverse Prime 10 μm,cDNA 2 μl,并以 DEPC 水调整总反应液至25 μl。设置 94℃预变性 3 min、94℃变性 30 s、57℃退火(内参59℃退火)30 s、72℃延伸30 s(内参延伸50 s)、35个循环(内参30个循环)后再72℃延伸2 min,即得PCR扩增产物,以3%的琼脂糖电泳,用凝胶成像仪扫描成像。PCR引物见表1。
1.2.6 ELISA法检测培养液中IL-17的含量 各处理组细胞在恒温箱中培养24 h后,取各培养组50 ml培养液,参照IL-17 ELISA说明书检测IL-17的含量。
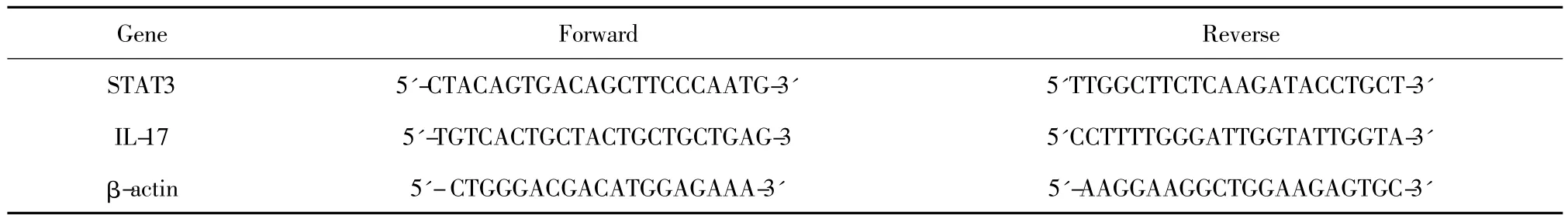
表1 PCR引物Tab.1 The primer of PCR
1.2.7 Western检测STAT3蛋白 将需要检测处理的γδT细胞提取总蛋白后,用BCA法检测蛋白浓度,加入上样buffer,用蛋白裂解液调整各实验组蛋白浓度至5 μg/ul,并在沸水中加热10 min。配制8%的分离胶及浓缩胶,每孔加入60 μg蛋白样品,电泳、切胶、并用PVDF膜转膜,用PBST配制的5%脱脂奶粉封闭1 h,再用5%脱脂奶粉按照1∶1 000(β-actin内参1∶3 000)稀释兔抗人STAT3一抗4℃过夜封闭,次日用PBST洗膜3次,每次10 min,用5%脱脂奶粉按照1∶5 000稀释加辣根过氧化物酶标记的山羊抗兔二抗,室温孵育1 h,再用PBST洗膜3次,每次10 min,然后用ECL作为发光试剂显影成像并拍照。
1.3 统计学处理 采用SPSS16.0进行统计学处理,结果以±s表示,组与组之间采用t检验,结果以P<0.05有统计学差异。
2 结果
2.1 γδT细胞的纯度 将外周血PBMC细胞培养3天后,用尼龙毛柱分离T淋巴细胞,再经流式细胞仪分选纯化γδT细胞,γδT细胞纯度可达(86.4±4.2)%(图1B),该纯度的γδT细胞可满足其功能研究,图1A为同型阴性对照,图1。
2.2 各处理组γδT细胞STAT3 mRNA转录 经加入不同干扰因子的各组细胞在培养24 h后,用PCR技术检测各组 STAT3 mRNA的表达,ESAT-6组STAT3 mRNA的表达较其余3组明显增加(P<0.01),ESAT-6+S3I-201组、S3I-201组较空白对照组STAT3 mRNA的减少有统计学意义(P<0.05),图2。
2.3 各处理组γδT细胞对STAT3蛋白表达 经不同处理后,各组 γδT细胞培养24 h后,用Western blot法检测γδT细胞STAT3蛋白的变化,ESAT-6组STAT3蛋白的表达较其余各组明显增强(P<0.01),ESAT-6+S3I-201组、S3I-201组STAT3蛋白的表达较空白对照组降低有统计学差异(P<0.05),图3。
2.4 各处理组γδT细胞IL-17 mRNA转录 各处理组γδT细胞在5%CO2、37℃恒温培养箱中培养24 h后,用PCR技术检测各组γδT细胞IL-17 mRNA含量的变化,PCR结果提示,ESAT-6组 IL-17mRNA的表达较其余各组明显增加(P<0.01),S3I-201组IL-17mRNA的表达较空白对照组、ESAT-6+S3I-201组减少有统计学意义(P<0.05),ESAT-6+S3I-201组IL-17mRNA的表达较空白对照增加有统计学意义(P<0.05),图4。
2.5 各实验组细胞培养液中IL-17含量的检测用ELISA法检测细胞培养液中IL-17的含量,结果提示ESAT-6组较其余三组IL-17的含量明显增加(P<0.01),ESAT-6+S3I-201组IL-17的含量较空白对照组增加有统计学意义(P<0.05),S3I-201组IL-17含量较ESAT-6+S3I-201组、空白对照组IL-17含量的减少有统计学意义(P<0.05),图5。
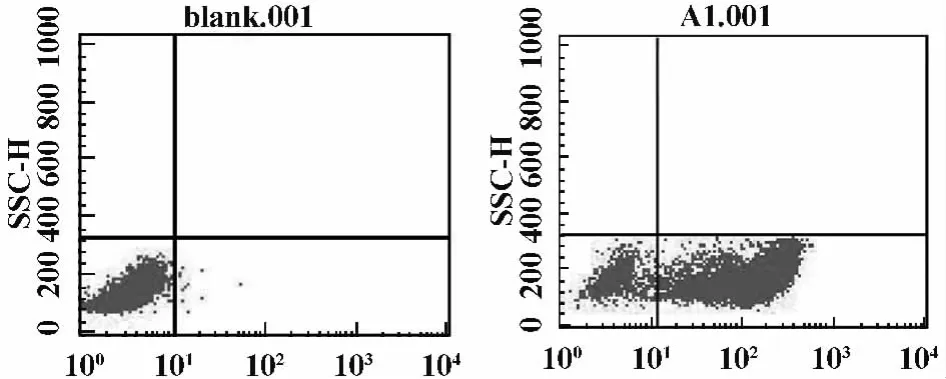
图1 流式细胞仪检测γδT细胞纯度Fig.1 The purity of γδT cells with flow cytometry

图2 PCR检测STAT3mRNA的表达Fig.2 The expression of STAT3mRNA detected by PCR
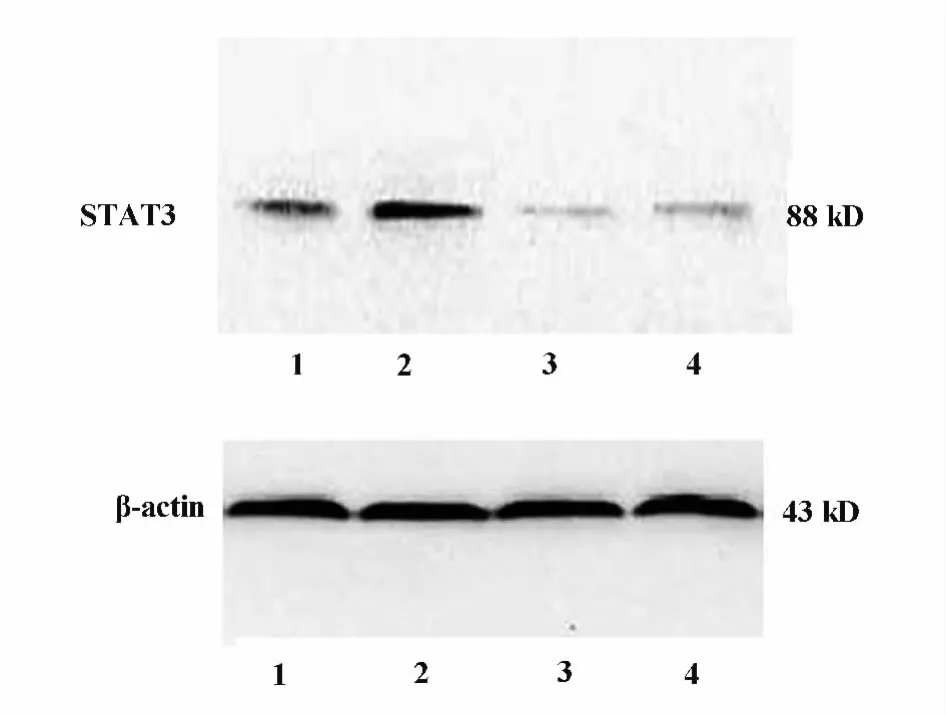
图3 Western blot检测STAT3的表达Fig.3 The expression of STAT3 protein tested by Western blot
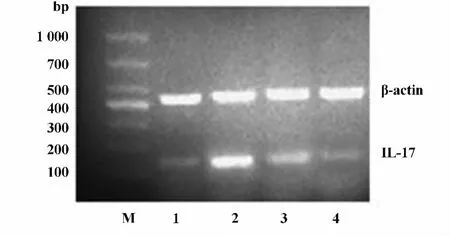
图4 PCR检测IL-17mRNA的表达Fig.4 The expression of IL-17mRNA detected by PCR
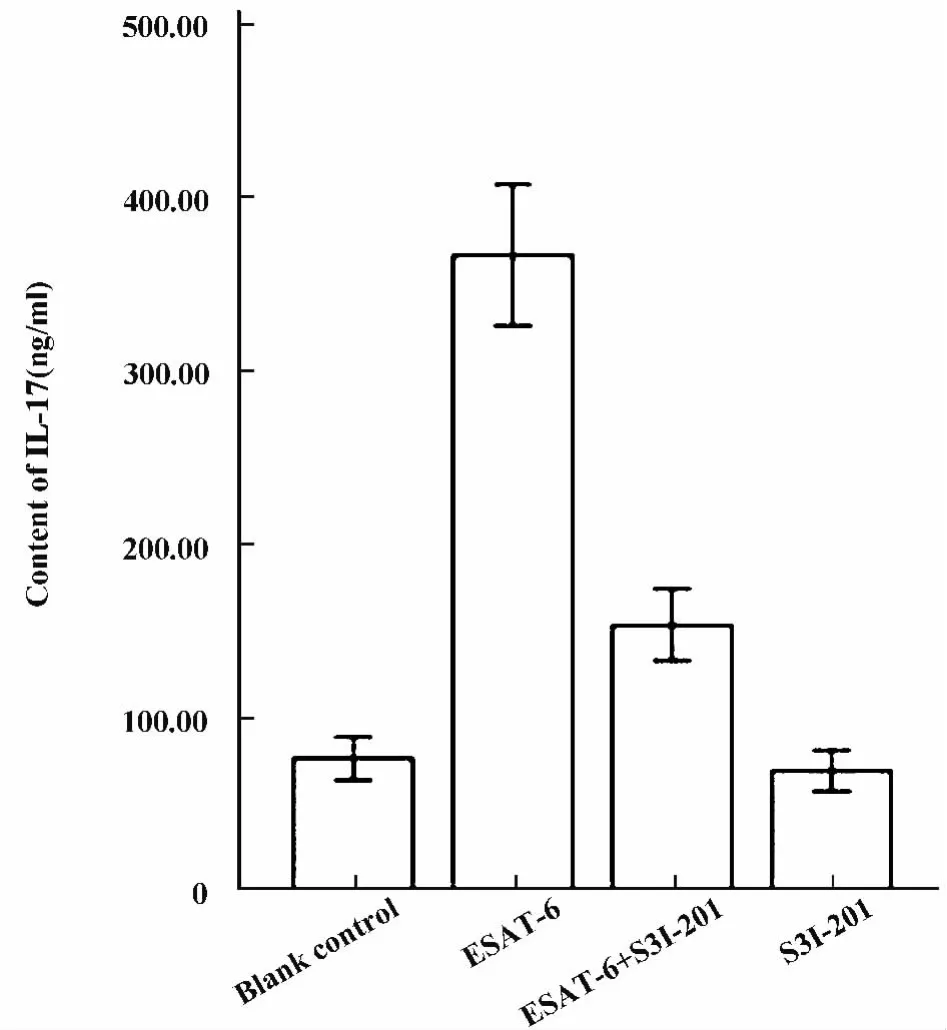
图5 细胞培养液IL-17的含量Fig.5 The expression IL-17 tested by ELISA
3 讨论
不同群体的T细胞有着不同的表面标志、来源、功能及生物学意义,根据其表面TCR受体的不同,将T淋巴细胞分为 αβT细胞和 γδT细胞,其中γδT细胞约占人外周血T淋巴细胞的0.5%-10%,且以Vγ9Vδ2 型 γδT 细胞为主,属于CD4+、CD8+双阴性细胞,其抗原的提呈及激活不受MHC限制,作用介于固有免疫与适应性免疫之间[6],在机体抗感染、肿瘤及自身免疫性疾病中发挥着重要的作用。
ESAT-6是致病性结核分枝杆菌早期分泌的靶抗原,具有很强的抗原特异性及免疫原性,有多个T细胞抗原决定簇,能特异性激活 γδT细胞的功能[7]。
IL-17由TH17细胞分泌,有研究表明γδT细胞亦是体内重要的IL-17来源,甚至比TH17细胞产生更多、更迅速[8]。IL-17与机体防御、自身免疫性疾病、肿瘤有着密切的联系,在机体抗感染中,通过局部刺激来提高 CXCL1、CXCL8、G-CSF、CXCL9 等趋化因子,将中性粒细胞诱导至炎症部位,从而发挥生物学效应[9,10];但同时也加重了局部的炎症反应,实验显示IL-17可与其他的细胞因子如IFN-γ、TNF-α、IL-1 等起协同作用,放大炎症效应[10,11]。在肿瘤方面,IL-17可促进血管表皮细胞生长因子的生成,有利于血管的形成,促进肿瘤的生长[12];然而,IL-17亦可同时诱导其他的淋巴细胞到肿瘤部位,促进其他免疫细胞分泌淋巴因子,对肿瘤细胞起到杀伤作用。
STAT3途径是经典的信号转导与转录途径,能够快速地将信号从细胞外传到细胞内。本实验通过加入STAT3特异性抑制剂,Western blot及PCR可发现STAT3减少,并且可同时观察到IL-17在上清液中的含量也随之减少;有意思的是本实验同时观察到ESAT-6+S3I-201刺激组,尽管STAT-3在mRNA及蛋白表达水平均下调,但IL-17在mRNA水平及上清液中的含量较空白对照组及S3I-201组的增加有统计学意义,提示ESAT-6刺激γδT细胞产生IL-17与STAT3通路关系密切;此结果不排除ESAT-6还可以通过其他的途径刺激γδT细胞产生IL-17,有研究发现IL-1及IL-23等淋巴因子也可促进γδT细胞产生 IL-17[13],ESAT-6 刺激 γδT 细胞后,是否导致γδT细胞分泌 IL-1、IL-23等淋巴因子,进而促进IL-17的产生值得进一步研究。
本实验显示,ESAT-6能刺激γδT细胞产生大量的IL-17,且IL-17的产生与STAT3通路密切相关,也解析了炎症反应与信号通路及免疫细胞之间存在的相互联系。通过本实验的研究,在IL-17相关疾病的发生发展过程中,可通过药物在信号通路水平阻断STAT3的活化来减少IL-17的表达,也可通过外周药物的刺激,活化γδT细胞等淋巴细胞来增加IL-17的表达,从而实现IL-17不同的生物学作用,为治疗相关疾病提供一定的临床思路。
[1]Curtis MM,Way SS.Interleukin-17 in host defence against bacterial,mycobacterial and fungal pathogens [J].Immunology,2009,126(2):177-185.
[2]Miyahara Y,Odunsi K,Chen W,et al.Generation and regulation of human CD4+IL-17-producing T cells in ovarian cancer [J].Proc Nat1 Acad Sci USA,2008,105(40):15505-15510.
[3]Steinman L.Mixed results with modulation of TH-17 cells in human autoimmunediseases [J].Nat Immunol,2010,11(1):41-44.
[4]Murdoch JR,Lloyd CM.Resolution of allergic airway inflammation and airway hyperreactivity is mediated by IL-17-producing{gamma}{delta}T cells[J].Am J Respir crit Care Med,2010,182(4):464-476.
[5]Renshaw P S,Lightbody K L,Veverka V et al.Structure and function of the complex formed by the tuberculosis virulence factors CFP-10 and ESAT-6[J].EMBO J,2005,24(14):2491-2498.
[6]Holtmeier W,Kabelitz D.gammadelta T cells link innate and adaptive immune responses[J].Immunol Allergy,2005,86:151-183.
[7]何愉胜,杜先智.卡介苗与ESAT-6激活的γδT细胞表达抗原提呈细胞表型和功能的研究[J].中国免疫学杂志,2011,27(3):204-208.
[8]Huber M,Heink S,Grothe H et al.A Th17-like developmental process leads to CD8(+)Tc17 cells with reduced cytotoxic activity [J].Eur J Immunol,2009,39(7):1716-1725.
[9]Li J,Mo HY,Xiong G et al.Tumor microenvironment macrophage inhibitory factor directs the accumulation of interleukin-17-producing tumor-infiltrating lymphocytes and predicts favorable survival in nasopharyngeal carcinoma patients[J].J Biol Chem,2012,287(42):35484-35495.
[10]Lee JW,Wang P,Kattah MG,et al.Differential regulation of chemokines by IL-17 in colonic epithelial cells [J].J Immunol,2008,181(9):6536-6545.
[11]Hamada S,Umemura M.Shiono T,et al.IL-17A produced by gammadelta T cells plays a critical role in innate immunity against listeria monocytogenes infection in the liver [J].J Immunol,2008,181(5):3456-3463.
[12]Honorati MC,Neri S,Cattini,et al.Interleukin-17,a regulator of angiogenic factor release by synovial fibroblasts [J].Osteoarthritis Cartilage,2006,14(4):345-352.
[13]Sutton CE,Lalor SJ,Sweeney CM,et al.Interleukin-1 and IL-23 induce innate IL-17 production from gammadelta T cells,amplifying Th17 responses and autoimmunity[J].Immunity,2009,31(2):331-341.

