FKBP52在反复体外受精种植失败患者种植窗期子宫内膜的表达研究
谭真,彭丽英,朱文杰,赖宝玲,付志红,李雪梅,唐雪莲
(南方医科大学附属深圳市妇幼保健院,深圳 518048)
提高胚胎种植率是体外受精(IVF)助孕技术的一大挑战。胚胎质量和子宫内膜容受性是影响胚胎种植的两大重要因素,寻求预测与评估子宫内膜对胚胎容受性的客观方法,有助于减少胚胎移植的盲目性[1]。近年来使用基因芯片和蛋白质组学技术描绘了胚胎种植窗期人子宫内膜的基因和蛋白的表达图谱,为使用生化标志物预测种植期子宫内膜容受性提供了有利条件。
已有研究发现,FKBP52与孕激素受体(PR)结合能大大提高孕酮(P)与PR的亲和力,增强PR活性,尤其是种植窗期FKBP52在子宫内膜组织的表达呈现时空特异性[2-3]。Tranguch等[4-5]发现,FKBP52基因敲除小鼠胚胎植入完全失败,提示FKBP52是影响胚胎植入和子宫内膜容受性的非常重要的蛋白。目前国内外对FKBP52的研究主要集中在动物实验方面,且FKBP52在种植期的细胞定位和定量表达尚不明确。本研究检测FKBP52蛋白在人子宫内膜的表达情况,探讨其与人子宫内膜容受性之间的关系,为临床提高胚胎种植率提供理论基础和实验依据。
资料与方法
一、研究对象
选择2013年8月至2014年3月在我院生殖中心接受体外受精-胚胎移植(IVF-ET)治疗、连续3周期并移植至少6个优质胚胎仍未获得临床妊娠者20例(研究组)。同期募集正常女性志愿者15例(对照组),要求其近年有正常生育史,无卵巢手术史,3个月内无激素治疗及宫腔操作史;无子宫内膜异位症、输卵管积水、子宫肌瘤、子宫腺肌瘤或多囊卵巢综合征等疾病。所有参与者年龄25~35岁,月经规律,基础内分泌正常,B超显示正常子宫形态,卵泡晚期内膜三线征明显,厚度≥8mm。本研究经本院伦理委员会批准,所有参与者签署知情同意书。
二、研究方法
1.监测排卵和分组:入组者于月经第10天开始阴道B超监测卵泡发育,至卵泡直径达15mm以上时,每天检测卵泡大小及尿黄体生成素(LH)峰监测排卵,尿LH峰日为卵泡晚期,排卵+7d为种植窗期,收取研究组妇女种植窗期子宫内膜标本(组1),并分别收取对照组卵泡晚期(组2)和种植窗期(组3)的子宫内膜标本。
2.标本采集和处理方法:用直径0.3cm的内膜取样器(GYNETICS,比利时)采集子宫腔中段内膜标本,置于4℃生理盐水,洗去血污,干纱布块吸去水分后分成2份:1份迅速放入-80℃冰箱中保存,用于实时荧光定量聚合酶链式反应(RT-PCR)检测;1份放入4%甲醛中固定,用于免疫组织化学测定,同日抽血测定血清雌二醇(E2)和孕酮(P)水平。
3.RT-PCR检测:采用 Trizol试剂盒(Invitrogen,美国)提取子宫内膜组织总RNA,并测量其RNA浓度及纯度,控制A260/A280在1.8~2.0范围。采用 RevertAid First Strand cDNA Synthesis试剂盒(Fermentas,加拿大)进行逆转录,取总RNA 2μg,OligodT18 1μl逆转录,反应总体积20μl。FKBP52引物序列:上游 5′-CATTGCCATAGCCACCATGAA-3′,下游5′-TCCAGTGCAACCTCCACGATA-3′,扩增产物长度252bp。同时以GAPDH为内参,其引物序列上游为5′-CAAGGTCATCCATGACAACTTTG-3′,下游为5′-GTCCACCACCCTGTTGCTGTAG-3′,扩增产物长度475bp,引物均由南京金思瑞公司合成。PCR反应条件:95℃3min预变性,94℃20s变性,59℃20s退火,72℃30s延伸,共40个循环。监测记录数据,自动计算软件融点曲线分析,采用ABI7300型PCR仪(ABI,美国)检出结果。按下列公式计算样本中FKBP52mRNA 的相对表达量[6]:△Ct(目的基因)=Ct(目的基因)-Ct(内参基因);△△Ct=△Ct(待测样本)-△Ct(参照样本);目的基因的相对表达量为2-△△Ct。
4.免疫组织化学检测:标本按常规脱水、透明、浸蜡后进行包埋成石蜡块。采用链霉菌抗生物素蛋白-过氧化物酶连接法(SP法)检测FKBP52蛋白的表达及定位。操作方法按SP法试剂盒(北京中杉金桥)说明书进行。石蜡切片厚3μm,常规脱蜡、水化、封闭,滴加一抗。一抗为兔抗人FKBP52多克隆抗体(Abcam,英国),工作稀释度1∶100,4℃冰箱过夜。再滴加羊抗兔IgG(SP-9001,北京中杉金桥)二抗,3,3′-二氨基联苯胺(DAB,武汉博士德)显色,苏木素复染、脱水、中性树胶封片。阳性表达为细胞核或细胞浆染成黄色或棕黄色。阴性对照用磷酸盐缓冲液(PBS)代替一抗。每张切片在显微镜(Olympus,日本)下随机选取互不重复的5个视野(×400倍),采用Image-proplus6.0软件对图像进行分析,测定每个视野的积分光密度值(IOD),求其平均值,记为FKBP52蛋白的表达量。
三、统计学处理
结 果
一、各组的一般情况比较
对照组(组2、3)和研究组(组1)的平均年龄、体重指数(BMI)、月经周期、基础的卵泡刺激素(FSH)、LH、E2、P、泌乳素(PRL)和睾酮(T)及黄体期的E2、P水平比较,差异均无统计学意义(P分别为 0.463、0.618、0.809、0.404、0.328、0.504、0.517、0.660、0.187、0.664和0.305)(表1)。
表1 对照组和研究组的一般情况(±s)
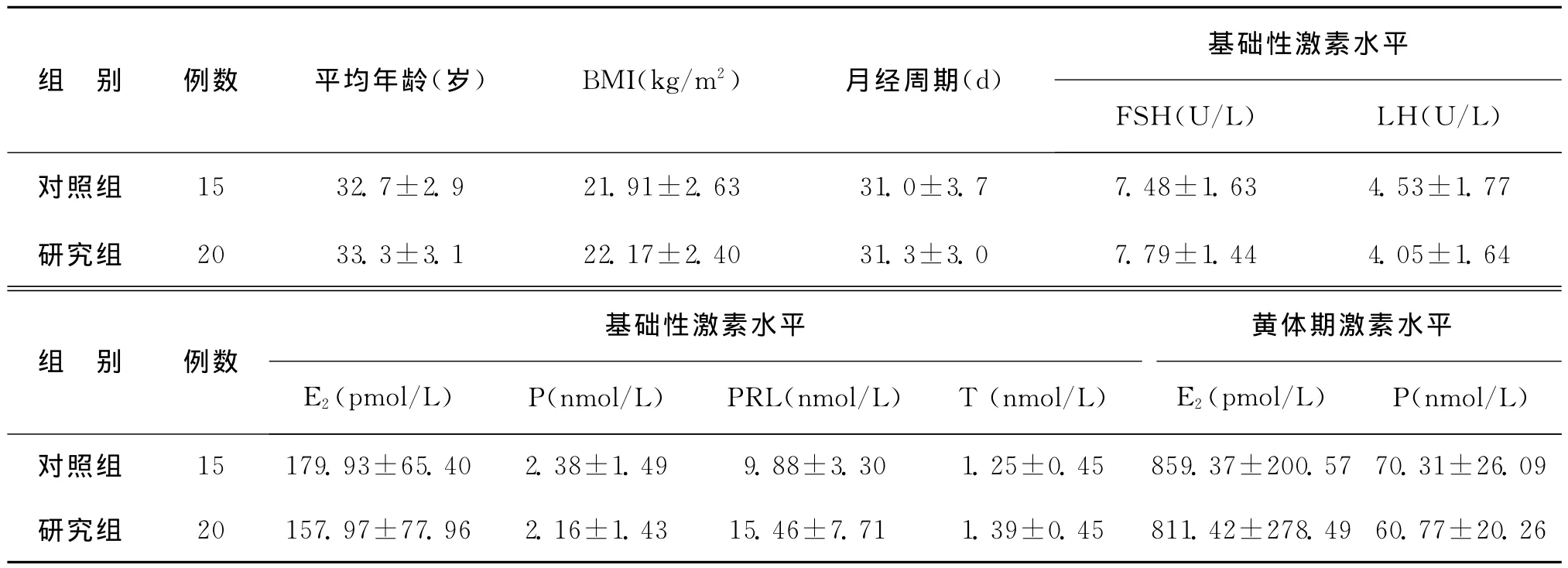
表1 对照组和研究组的一般情况(±s)
组 别 例数 平均年龄(岁) BMI(kg/m2) 月经周期(d)基础性激素水平FSH(U/L) LH(U/L)对照组 15 32.7±2.9 21.91±2.63 31.0±3.7 7.48±1.63 4.53±1.77研究组 20 33.3±3.1 22.17±2.40 31.3±3.0 7.79±1.44 4.05±1.64组 别 例数基础性激素水平 黄体期激素水平E2(pmol/L) P(nmol/L) PRL(nmol/L) T (nmol/L) E2(pmol/L) P(nmol/L)对照组 15 179.93±65.40 2.38±1.49 9.88±3.30 1.25±0.45 859.37±200.57 70.31±26.09研究组 20 157.97±77.96 2.16±1.43 15.46±7.71 1.39±0.45 811.42±278.49 60.77±20.26
二、FKBP52mRNA的表达情况
在实验过程中,采用RT-PCR检测,在三组中均有FKBP52mRNA表达,FKBP52基因和内参基因GAPDH的溶解曲线峰均为特异的单峰,熔点温度(波峰对应的温度)分别为85.7℃和88.5℃,表明扩增产物有特异性。组1的平均FKBP52mRNA表达水平低于组3,组2的FKBP52mRNA表达值亦低于组3,但三组间比较差异均无统计学意义(P>0.05)(表2)。
表2 不同组FKBP52mRNA表达量及蛋白IOD值结果(±s)
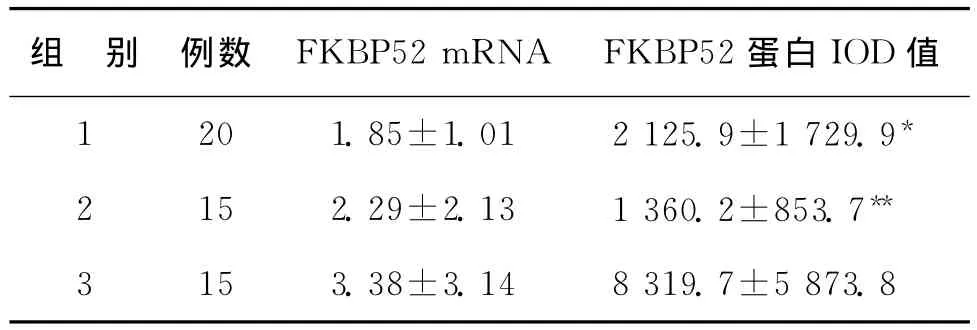
表2 不同组FKBP52mRNA表达量及蛋白IOD值结果(±s)
注:与组3比较,*P<0.05,**P<0.01
组 别 例数 FKBP52mRNA FKBP52蛋白IOD值1 20 1.85±1.01 2 125.9±1 729.9*2 15 2.29±2.13 1 360.2±853.7**3 15 3.38±3.14 8 319.7±5 873.8
三、FKBP52蛋白的表达及定位情况
免疫组织化学结果显示,FKBP52蛋白主要表达于子宫内膜腺上皮的胞核及胞浆,间质细胞表达极少。组1以胞核表达明显(图1A),组2以胞浆表达明显(图1B),组3中胞核及胞浆均表达明显(图1C)。Image-proplus6.0软件图像分析结果,组3的平均IOD值显著大于组1(P<0.05)和组2(P<0.01)(表2)。
四、FKBP52mRNA及蛋白的表达与黄体期E2、P的关系
统计学分析结果显示:子宫内膜FKBP52 mRNA的表达与雌、孕激素水平无相关性(r=0.340,P=0.436;r=0.201,P=0.413),FKBP52蛋白的表达与雌、孕激素水平也无相关性(r=0.283,P=0.367;r=0.240,P=0.394)(表3)。
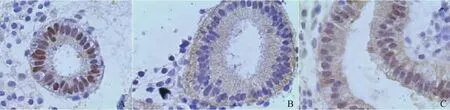
图1 FKBP52蛋白在3组的表达情况(SP法+苏木素复染 ×400)
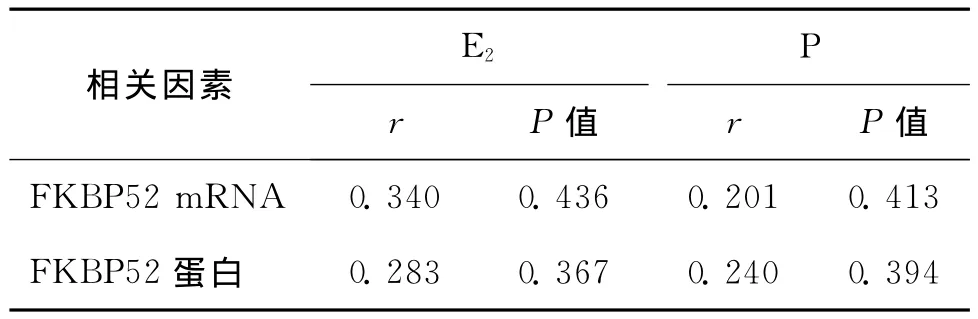
表3 种植窗期FKBP52表达量与E2、P的关系
讨 论
在IVF-ET过程中,常常好的胚胎质量、好的内膜、好的激素水平情况下仍然会发生不明原因的反复种植失败,而对之临床上依然缺乏有效的解决手段。近年来从分子生物学角度探寻其中关键基因和蛋白质以作为标志物,旨在指导临床成为目前研究的热点。
自1985年第1次发现FKBP52蛋白以来,越来越多的研究者重视FKBP52的研究。Lebeau等[7]研究发现,从兔肝脏中克隆出FKBP52的cDNA序列,能使FKBP52结合甾体激素受体,调节激素受体功能,增强转导信号通路。Dey等[8]研究发现,缺少PR的小鼠可见排卵、受精和种植失败,但在FKBP52基因敲除的小鼠仅由于缺乏子宫内膜容受性而引起种植失败。采用蛋白质组学技术研究,发现人子宫内膜FKBP52在“种植窗”前期和“种植窗”期的表达存在差异[9]。FKBP52在子宫内膜对胚胎容受性起着重要作用,不管动物还是人类,相继得到了证明。本实验旨在对反复体外受精种植失败患者子宫内膜上FKBP52的表达的相关因素进行研究,以正常妇女“种植窗”前期和“种植窗”期为对照,发现“种植窗”前期和“种植窗”期FKBP52蛋白均有表达,其主要表达于子宫内膜腺上皮的胞核及胞浆,间质细胞几乎无表达。文献报道,胚胎植入过程中FKBP52首先定位于胞浆,与PR结合形成复合物,再由胞浆内的动力蛋白快速转运到胞核与P结合调节多种基因的表达[10]。本研究显示,正常妇女子宫内膜FKBP52蛋白于胞浆和胞核均有表达,与文献[10]报道一致;而反复体外受精种植失败患者种植窗期FKBP52蛋白的表达仅定位于胞核,有别于正常的定位模式,或许这是不能成功种植的原因之一。
本组免疫组化结果还显示,反复体外受精种植失败患者子宫内膜FKBP52蛋白的表达显著低于正常育龄妇女,差异有统计学意义(P<0.05)。胚胎种植是一个非常复杂的动态过程,这一过程在特定的时空范围内发生,即“种植窗”。种植窗期一系列细胞因子、生长因子和转录因子等复杂而又精确的定位和变化以及胚胎与子宫内膜容受性之间非常缜密的对话机制是胚胎成功植入的关键[11]。本研究结果提示,反复体外受精种植失败患者子宫内膜FKBP52蛋白的异常定位及低表达可能影响了胚胎与子宫内膜之间的精密对话,从而导致种植失败,但其具体影响机制尚不清楚,还有待进一步研究。RT-PCR检测结果与免疫组化结果相一致,从不同侧面反映了FKBP52表达与子宫内膜容受性的紧密相关性,推测FKBP52表达异常是胚胎种植失败的重要相关因素。而FKBP52表达与血清雌孕激素高低无显著相关性,今后应加大研究的样本量,并需进一步阐明子宫内膜雌孕激素受体与FKBP52蛋白表达之间关系,以对结论作进一步验证。
[1]Tan BK,Vandekerckhove P,Kennedy R,et al.Investigation and current management of recurrent IVF treatment failure in the UK[J].BJOG,2005,112:773-780.
[2]Daikoku T,Tranguch S,Friedman DB,et al.Proteomic analysis identifies Immunophilin FK506binding protein 4(FKBP52)as a downstream target of Hoxa10in the periimplantation mouse uterus[J].Mol Endocrinol,2005,19:683-697.
[3]Davies TH,Sánchez ER.FKBP52[J].Int J Biochem Cell Biol,2005,37:42-47.
[4]Tranguch S,Cheung-Flynn J,Daikoku T,et al.Cochaperone immunophilin FKBP52is critical to uterine receptivity for embryo implantation[J].Proc Natl Acad Sci U S A,2005,102:14326-14331.
[5]Tranguch S,Wang H,Daikoku T,et al.FKBP52deficiencyconferred uterine progesterone resistance is genetic background and pregnancy stage specific[J].J Clin Invest,2007,117:1824-1834.
[6]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta CCT)Method[J].Methods,2001,25:402-408.
[7]Lebeau MC,Massol N,Herrick J,et al.P59,an hsp 90-binding protein.Cloning and sequencing of its cDNA and preparation of a peptide-directed polyclonal antibody[J].J Biol Chem,1992,267:4281-4284.
[8]Tranguch S,Smith DF,Dey SK.Progesterone receptor requires a co-chaperone for signaling in uterine biology and implantation[J/OL].Reprod Biomed Online,2006,13:651-660.
[9]Li J,Tan Z,Li M,et al.Proteomic analysis of endometrium in fertile women during the prereceptive and receptive phases after luteinizing hormone surge[J].Fertil Steril,2011,95:1161-1163.
[10]Galigniana MD,Radanyi C,Renoir JM,et al.Evidence that the peptidylprolyl isomerase domain of the hsp90-binding immunophilin FKBP52is involved in both dynein interaction and glucocorticoid receptor movement to the nucleus[J].J Biol Chem,2001,276:14884-14889.
[11]van Mourik MS,Macklon NS,Heijnen CJ.Embryonic implantation:cytokines,adhesion molecules,and immune cells in establishing an implantation environment[J].J Leukoc Biol,2009,85:4-19.

