男方染色体平衡易位不育夫妇行体外受精-胚胎移植术后的临床妊娠结局
林奇,刘红杰,沈树秋,郭楚苹,蔡靖,尹彪,邹淑玲,叶燕萍,曾勇,*
(1.深圳市围着床期生殖免疫重点实验室,深圳 518045;2.深圳中山生殖与遗传研究所 ,深圳 518045;3.深圳中山泌尿外科医院生殖医学中心,深圳 518045)
约有10%~15%的育龄夫妇存在不育问题,其中男性因素约占50%。据统计,不育男性患者染色体异常率较已育男性高8~10倍,10%的不育男性可能伴有遗传异常,主要表现为染色体异常或相关遗传基因的异常[1],其中染色体平衡易位是临床上常见的一种染色体畸形,也是引起不孕不育的重要原因之一。以往针对染色体平衡易位引起的不育没有很好的治疗方法,但随着辅助生殖技术(ART)的发展,目前已可通过胚胎植入前遗传学诊断技术(PGD)进行治疗,从而获得染色体正常的后代或平衡易位携带者。然而,国内具有开展PGD治疗资质及技术能力的中心很少,费用昂贵且周期长,患者难以承受,以至许多患者放弃了PGD治疗,而宁愿承担风险选择常规体外受精或卵胞浆内单精子注射-胚胎移植(IVF/ICSI-ET),然后通过产前诊断筛选得到健康的后代。但对于这类患者接受常规IVF/ICSI的妊娠结局如何,是否会增加流产、畸形后代产生的机率,国内外鲜有报道。本文对36例放弃PGD治疗而进行常规IVF/ICSI的男性染色体平衡易位携带者进行研究,其临床妊娠结局与染色体正常的不育夫妇相比较,为此类患者的治疗及遗传咨询提供指导。
资料与方法
一、研究对象
2010年1月至2011年12月在我院生殖中心就诊并完成IVF/ICSI-ET治疗周期的不孕不育患者。研究对象分为观察组与对照组。其中观察组共36例:男方为染色体平衡易位携带者;对照组共751例:夫妇双方染色体核型均正常的不育夫妇。
二、研究方法
1.染色体检查:所有进入常规IVF-ET或ICSI-ET治疗周期的患者均进行外周血淋巴细胞染色体核型分析的检查。核型分析按《人类细胞遗传学国际命名体制》(ISCN 2009)进行。
2.签署风险知情同意书:所有研究对象均按卫生部制定的辅助生育技术规范进入周期,并签署知情同意书。对染色体平衡易位携带者通过遗传咨询详细告知其染色体畸形的风险,并建议患者妊娠后必须进行产前诊断和优生咨询。
3.IVF/ICSI-ET:所有患者均采用本中心制定的常规长方案进行控制性促排卵。于黄体中期用促性腺激素释放激素激动剂(GnRH-a)(Diphereline,博福-益普生,法国)开始降调节,下1次月经周期的第3天或第5天开始每日肌肉注射重组人卵泡刺激素(r-hFSH)(Gonal-F,默克雪兰诺,德国)促排卵,采用阴道B超及尿黄体生成素(LH)监测,至卵泡发育成熟,即B超实时显像见双卵巢中有2个或2个以上卵泡直径>18mm时,肌注人绒毛膜促性腺激素(HCG)(Profasi,默克雪兰诺,德国)10 000U。肌注HCG 34~36h后,在阴道B超引导下行经阴道穿刺负压抽吸取卵术,记录获卵数。
女方取卵当天,男方手淫法取精,精液液化后通过密度梯度离心法进行优化处理,根据精液情况进行IVF或ICSI。观察受精情况及受精后胚胎卵裂和发育情况。受精后第3天根据本中心制定的胚胎评分系统评判胚胎分级,选择2~3个优质胚胎(或评分最佳的胚胎)移植。剩余的优质胚胎采用慢速程序化冷冻法全部冷冻。对于新鲜移植未成功妊娠的患者,若还有可利用的冷冻胚胎,则建议行冷冻胚胎移植(FET)。自然周期下监测排卵,在肌注HCG后第4天或排卵后第4天进行卵裂期胚胎复苏移植术,选择2~3个评分最佳的冷冻胚胎移植。进行新鲜或冷冻胚胎移植术后均给予黄体酮支持,用药至尿妊娠试验当日,尿妊娠试验阳性者继续予黄体酮支持。
4.妊娠结局随访:胚胎移植14d后如果妊娠试验阳性,3周后B超观察妊娠囊和胎心搏动,见妊娠囊统计为临床妊娠。嘱患者妊娠中期进行胎儿染色体检查,并随访患者及胎儿临床结局,记录减胎、胚胎停育、早期流产、晚期流产、引产、死胎、畸胎、出生缺陷、胎儿染色体核型等情况。
5.临床资料收集:收集观察组和对照组的新鲜移植周期及冷冻移植周期资料进行统计。主要统计指标包括患者的病例数、取卵周期数、移植周期数、女方平均年龄、平均获卵数、生化妊娠率、临床妊娠率、胚胎着床率、多胎妊娠周期数、流产周期数(包括早期流产和晚期流产)、活胎分娩周期数等。
三、统计学分析
应用SPSS 13.0统计软件,女方平均年龄、平均获卵数、平均移植胚胎数以(±s)表示,组间女方平均年龄、平均获卵数的比较采用方差分析,组间平均移植胚胎数的比较采用t检验,组间率的比较应用χ2检验或Fish精确检验,P<0.05为差异有统计学意义。
结 果
一、36例染色体平衡易位男性患者外周血染色体核型及妊娠史
36例男性平衡易位患者中有15例为常规IVF治疗周期,21例为ICSI治疗周期;其中相互易位23例,罗伯逊易位13例。36对不孕不育夫妇中22例为原发性不育,14例为继发不育,其中6例有不良妊娠、生育史(表1)。
二、两组新鲜胚胎移植周期临床结果的比较
36例男方携带染色体平衡易位的夫妇共完成38个新鲜胚胎移植治疗周期,与染色体正常的对照组夫妇(751例)进行统计分析。两组间女方平均年龄、平均获卵数、平均移植胚胎数、生化妊娠率、临床妊娠率、胚胎着床率、多胎妊娠周期百分率、自然流产率、活胎分娩周期数百分率均无显著性差异(P>0.05)(表2)。
三、两组FET周期临床结果的比较
有11例男方携带染色体平衡易位的夫妇进行了13个FET治疗周期,其中12个周期是进行新鲜胚胎移植治疗周期后未能成功获得婴儿的患者,只有1个周期是新鲜胚胎移植成功的患者。染色体对照组:进行新鲜胚胎移植治疗周期后未能成功的染色体正常患者128例,共进行了175个FET周期。因观察组样本量太少,相关临床指标未做统计学分析(表3)。
四、观察组行IVF-ET临床妊娠后随访结果
36例男方染色体平衡易位的不育症夫妇,共完成38个新鲜胚胎移植治疗周期、13个FET治疗周期,其中有24个周期获得临床妊娠,早期自然流产5个周期,总计18对夫妇成功分娩了24个婴儿,每取卵周期活胎分娩率达47.4%(18/38)。所有临床妊娠病例均积极做了产前诊断,随访未见晚期流产、死胎、畸胎或出生畸形儿的病例。24例临床妊娠的ET治疗周期临床结局及胎儿染色体核型见表4。
讨 论
染色体平衡易位是临床上最常见的一种染色体结构畸形之一,主要有相互易位、罗伯逊易位、复杂易位等;其中,相互易位最为常见,在群体中相互易位的发生率约为1/500,罗伯逊易位发生率约为1/900[2];其在严重少、弱、畸形精子症患者,自然流产或伴有不良生育史的患者中发生率更高,可高达2%以上[3-4]。本研究36例病例均为非同源常染色体间相互易位或罗伯逊易位男性不育患者,其中有21例因男方伴有严重少弱畸形精子症行ICSI治疗周期。36例不孕不育夫妇中有22例为原发性不育,6例伴有不良妊娠、生育史,提示染色体平衡易位可引起男性患者精液质量差、生育力低下或无效妊娠增加。在国外此类患者常借助于PGD的方法来获得健康的后代,但鉴于PGD的技术难度、费用成本及安全性等问题,PGD在国内并没有得到普及。而对于该类患者行常规IVF-ET或ICSI-ET的临床结局却未见报道,本研究对男方携带染色体平衡易位的患者行常规IVF/ICSI-ET的结局进行了分析。研究结果显示,36例男方染色体平衡易位的不育症夫妇,共完成38个取卵周期,其中有24个周期获得临床妊娠,在获得临床妊娠的病例中,除5例早期流产外,其余病例均成功分娩健康后代,未见晚期流产、死胎、畸胎或出生缺陷儿等严重的不良妊娠结局,总计18对夫妇成功分娩了24个婴儿,每取卵周期活胎分娩率达47.4%(18/38)。说明在常规IVFET或ICSI-ET治疗周期下,通过移植2~3个优质胚胎,男方携带染色体平衡易位的不孕不育患者也可获得较为满意的妊娠成功率,而且发生不良妊娠或分娩异常后代的几率比理论上的概率要低得多,有以下几点理论可以支持我们的结果:

表1 36例染色体相互易位不育症患者染色体核型及妊娠史
表2 各组新鲜胚胎移植周期临床结果[(±s),%(n)]
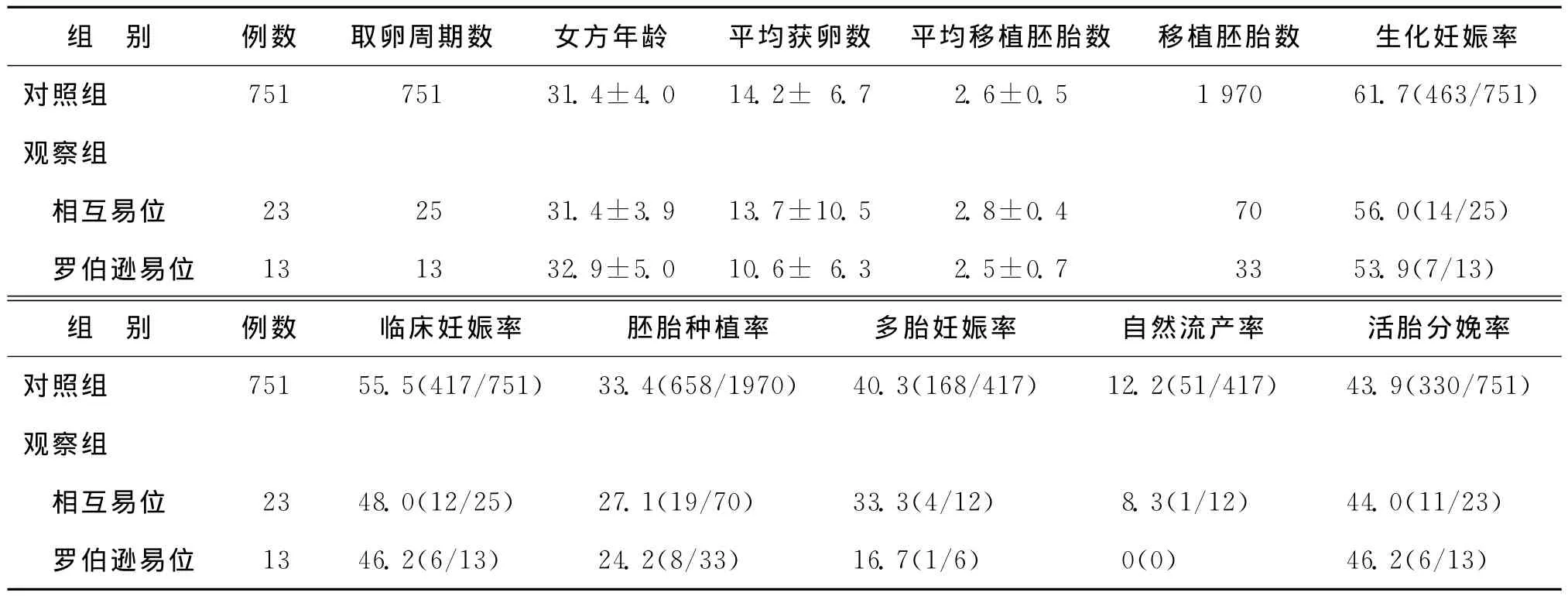
表2 各组新鲜胚胎移植周期临床结果[(±s),%(n)]
别 例数 取卵周期数 女方年龄 平均获卵数 平均移植胚胎数 移植胚胎数 生化妊娠率对照组 751 751 31.4±4.0 14.2± 6.7 2.6±0.5 1 970 61.7(463/751)组观察组相互易位 23 25 31.4±3.9 13.7±10.5 2.8±0.4 70 56.0(14/25)罗伯逊易位 13 13 32.9±5.0 10.6± 6.3 2.5±0.7 33 53.9(7/13)组 别 例数 临床妊娠率 胚胎种植率 多胎妊娠率 自然流产率 活胎分娩率对照组 751 55.5(417/751) 33.4(658/1970) 40.3(168/417) 12.2(51/417) 43.9(330/751)观察组相互易位 23 48.0(12/25) 27.1(19/70) 33.3(4/12) 8.3(1/12) 44.0(11/23)罗伯逊易位 13 46.2(6/13) 24.2(8/33) 16.7(1/6) 0(0) 46.2(6/13)
表3 各组FET周期临床结果比较[(±s),%(n)]
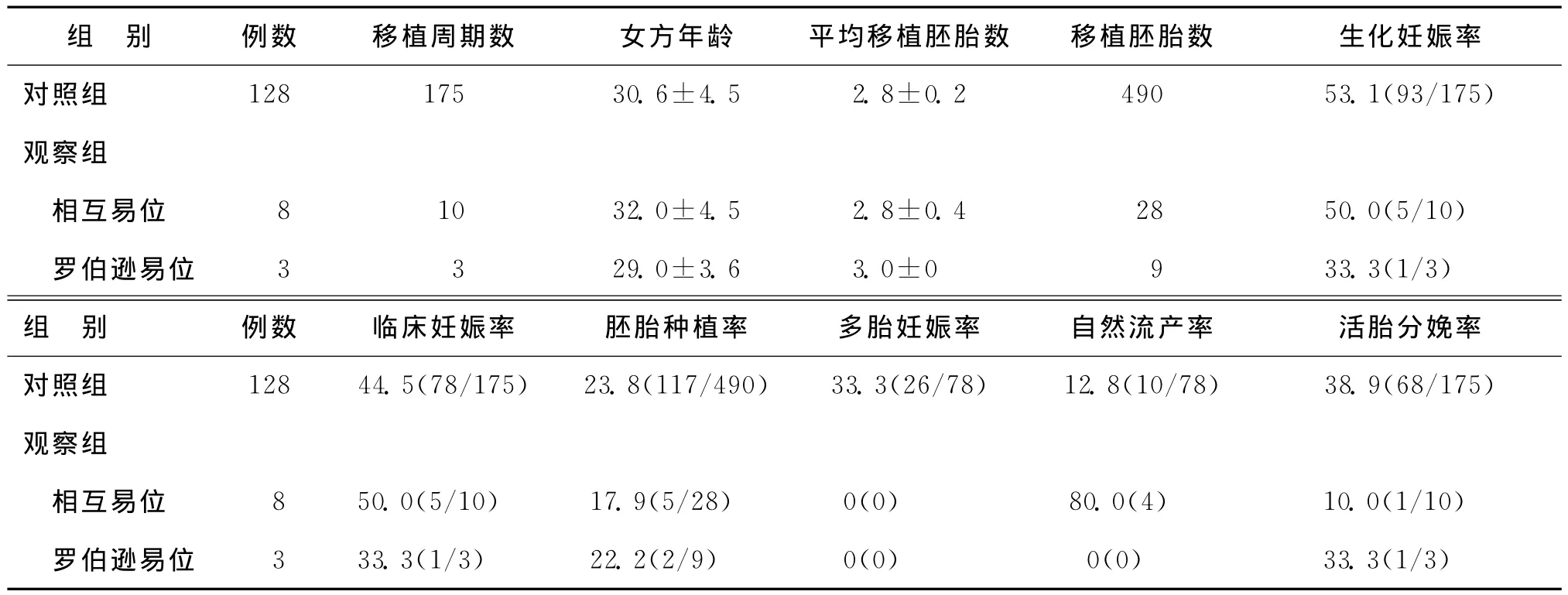
表3 各组FET周期临床结果比较[(±s),%(n)]
别 例数 移植周期数 女方年龄 平均移植胚胎数 移植胚胎数 生化妊娠率对照组 128 175 30.6±4.5 2.8±0.2 490 53.1(93/175)组观察组相互易位 8 10 32.0±4.5 2.8±0.4 28 50.0(5/10)罗伯逊易位 3 3 29.0±3.6 3.0±0 9 33.3(1/3)组例数 临床妊娠率 胚胎种植率 多胎妊娠率 自然流产率 活胎分娩率对照组 128 44.5(78/175) 23.8(117/490) 33.3(26/78) 12.8(10/78) 38.9(68/175)别观察组相互易位 8 50.0(5/10) 17.9(5/28) 0(0) 80.0(4) 10.0(1/10)罗伯逊易位 3 33.3(1/3) 22.2(2/9) 0(0) 0(0) 33.3(1/3)
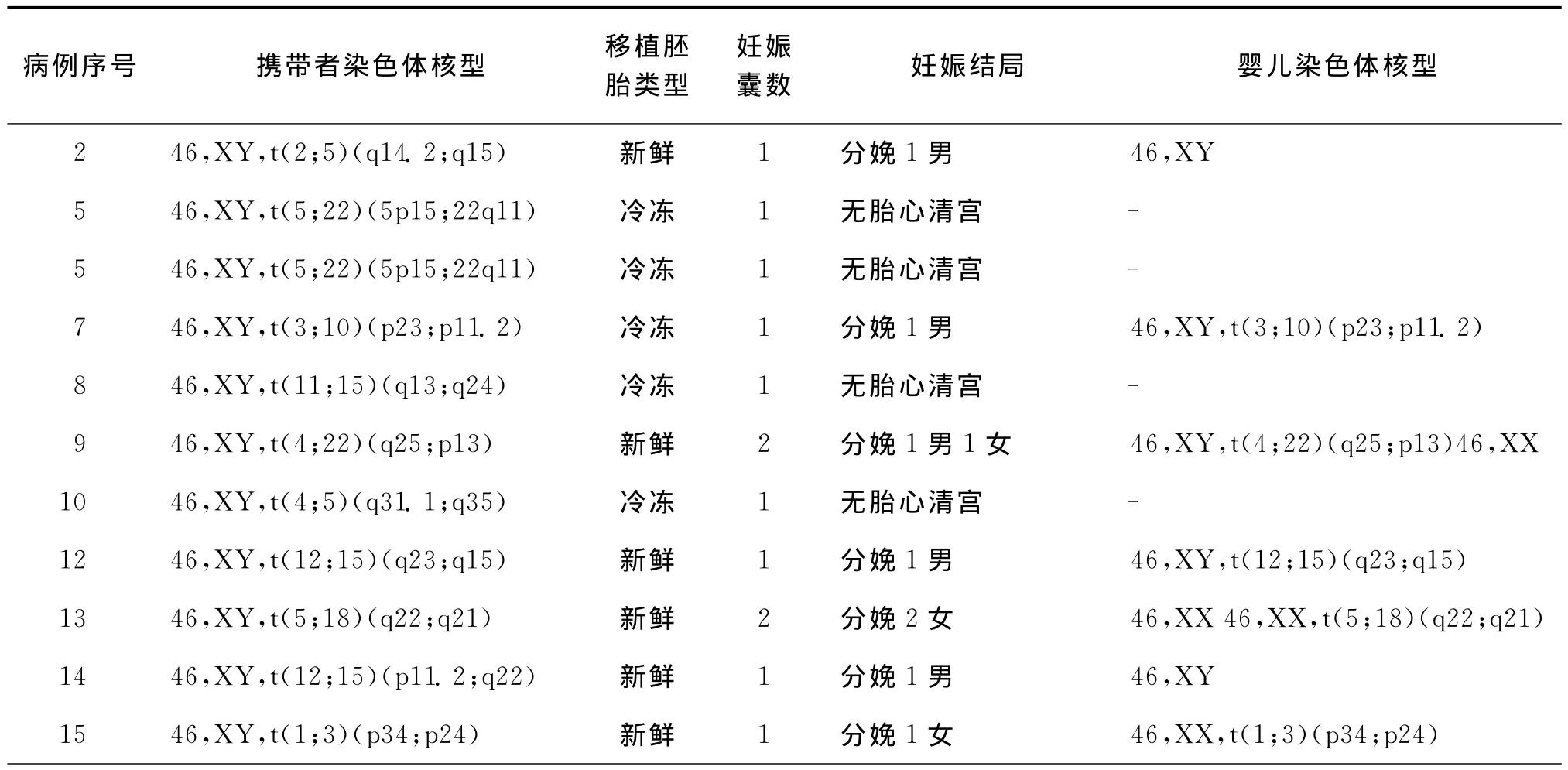
表4 24例临床妊娠的临床结局及胎儿染色体核型
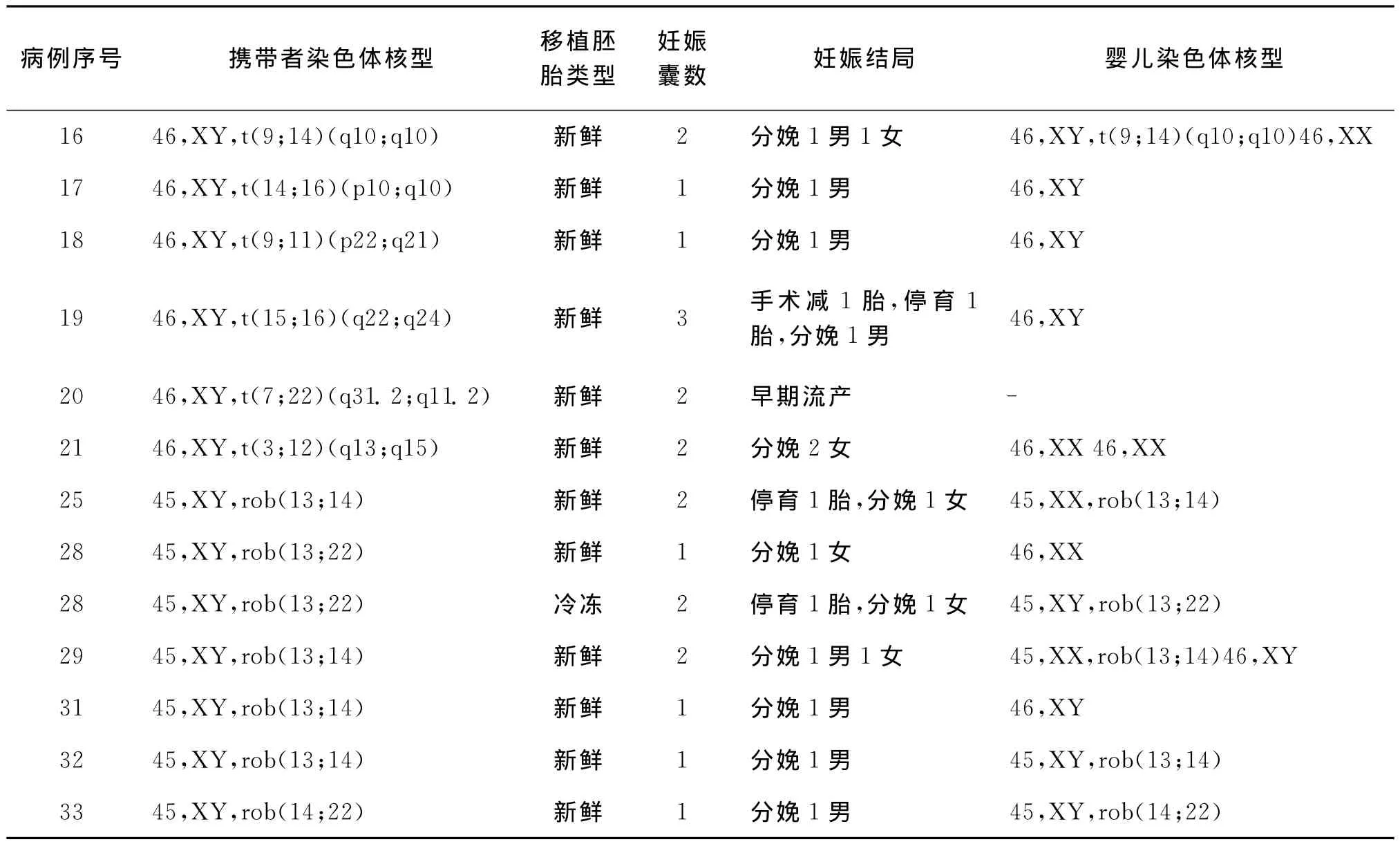
续表
第一,原始生殖细胞通过减数分裂后可帮助淘汰一部分有严重遗传缺陷的配子[5-6]。本中心曾对4例平衡易位患者进行精子FISH分析,发现染色体正常或平衡的比例远高于预期[7],说明生殖细胞经过了减数分裂后可淘汰一部分有严重遗传缺陷的配子。有研究表明,常染色体的畸变可导致同源染色体配对异常,造成减数分裂前期不能联会,从而使精子生成阻滞在精母细胞水平而不能继续分化成精子[8]。第二,IVF获得的胚胎中,优质胚胎中染色体正常胚胎的比例高于非优质胚胎[9]。由于IVF治疗可以获得较多的胚胎,通过选择优质胚胎移植可减少染色体异常胚胎受孕的机会,而多胚胎移植使得IVF治疗下的人工周期比自然周期下获得的妊娠几率大大提高。第三,胚胎本身也存在自然选择,染色体异常的胚胎会发生停育或早期流产以防止异常胎儿的出生。理论上,染色体平衡易位可产生不平衡染色体病患儿,但在临床上染色体平衡易位携带者产生不平衡染色体病患儿的概率并不高[10-11],大部分染色体异常的胚胎无法着床或随着女性月经周期来临而被清除。即使是个别染色体异常的胚胎获得了临床妊娠,大多数也会在妊娠早期(孕3月内)发生流产而被清除[12]。本文5例流产病例均发生在早期,未见染色体异常新生儿出生,说明经过多胚胎移植后的自然选择,染色体平衡易位患者发生流产、死胎或畸胎的几率并不高。
本研究中,新鲜胚胎移植周期观察组的生化妊娠率、临床妊娠率、胚胎着床率、多胎妊娠周期百分率、活胎分娩率等指标均要较染色体正常对照组有所偏低,但差异无统计学意义。说明携带染色体平衡易位可能会对常规IVF或ICSI治疗的临床结局有一定的影响,但不显著。新鲜胚胎移植未能成功妊娠的患者,在行FET周期后也可获得与对照组相似的临床妊娠率,但自然流产率明显偏高。这可能与FET周期的胚胎质量有关,由于大多数患者的形态最好的胚胎均在新鲜周期被移植,而形态差的胚胎本身可能存在染色体异常的几率会高[5],尤其是在平衡易位携带者的胚胎中可能异常比例会更高。另外,本结果中相互易位患者与罗氏易位患者之间新鲜胚胎移植周期的临床妊娠结局并无明显差异,说明染色体平衡易位的类型对患者常规IVF/ICSI临床妊娠结局的影响并不明显。但由于本研究中观察组样本量太少,目前尚不能断定以上推断是否正确,因此仍需进一步的大样本观察研究。
近几年来在国内外公开发表的有关平衡易位携带者经IVF后进行ET治疗的文献资料中,所有均是通过PGD方式选择胚胎后再进行移植的,因为传统的观点认为如果不进行胚胎植入前诊断患者妊娠风险会很高[13]。然而PGD技术的使用仍然存在很多局限性:由于早期胚胎卵裂球存在较多的嵌合体,影响到PGD诊断的准确性[14];PGD周期中常造成胚胎大量的浪费以及胚胎活检后因无胚胎移植而取消的周期增加[15-16];PGD技术对胚胎造成的损伤及其技术安全性也是一个值得关注的问题[17-18]。因此,PGD的有效性及其临床应用的意义受到了质疑[19-20]。本研究探讨了男性染色体平衡易位携带者行常规IVF/ICSI而非PGD的妊娠结局,为这类患者的遗传咨询以及关于PGD技术的争论提供临床数据。但是由于缺少行PGD患者的临床数据,而只是在不行PGD的情况下平衡易位携带者与非携带者的比较,本研究又存在一定的局限性。
本研究仅回顾性分析了男方携带染色体平衡易位的不孕不育患者做常规IVF/ICSI的妊娠结局,要想得到准确的结论,还需要加大样本量,以及同类患者行PGD和常规IVF/ICSI的数据比较。但至少本文结论可以提示我们:若男方染色体平衡易位的携带者行常规IVF/ICSI周期治疗,可得到与非携带者相似的妊娠结局。对于无法做PGD治疗的平衡易位携带者,也可以选择尝试常规IVF/ICSI周期进行辅助生育治疗。在IVF-ET过程中,生殖细胞减数分裂的配子筛选,胚胎体外发育的自然选择和多胚胎移植,以及子宫内胚胎着床时的优胜劣汰都是能够获得理想的活婴出生率的重要原因。
[1]蔡靖,尹彪,曾勇 .男性不育的遗传咨询及辅助生殖技术治疗策略[J].国际生殖健康/计划生育杂志,2012,31:381-387,416.
[2]夏家辉,主编 .医学遗传学[M].北京:人民卫生出版社,2004.143-146.
[3]谭跃球,朱文兵,李麓芸,等 .367例不育男性的染色体分析[J].生殖医学杂志,2000,9:272-275.
[4]王雅文,韩维田,关长吉,等 .中国东北地区人群中不良孕产夫妇的细胞遗传学分析[J].国际遗传学杂志,2009,32:161-167,212.
[5]Carp H,Guetta E,Dorf H,et al.Embryonic karyotype in recurrent miscarriage with parental karyotypic aberrations[J].Fertil Steril,2006,85:446-450.
[6]Douglas T.Carrell.The Genetics of Male Infertility[M].New Jersey:HUMANA PRESS,2007.129-145,320-325.
[7]曾勇,胡晓东,林奇,等 .染色体平衡易位患者精子染色体荧光原位杂交分析[J].中华男科学杂志,2007,13:867-870.
[8]曾勇,胡晓东,蔡靖,等 .染色体异常对男性生精功能的影响[J].中国男科学杂志,2006,20:17-20.
[9]林蕾,孙丽,刘萍,等 .精子染色体异常与男性不育及辅助生殖技术妊娠结局的关系[J].生殖医学杂志,2009,18:406-410.
[10]Carp H,Feldman B,Oelsner G,et al.Parental karyotype and subsequent live births in recurrent miscarriage[J].Fertil Steril,2004,81:1296-1301.
[11]Findikli N,Kahraman S,Saglam Y,et al.Embryo aneuploidy screening for repeated implantation failure and unexplained recurrent miscarriage[J/OL].Reprod Biomed Online,2006,13:38-46.
[12]Young L.Introduction to Risk Calculation in Genetic Counseling[M].3rd Edition.New York:Oxford University Press,2007.227-229.
[13]李宏军,李志强 .胚胎着床前遗传学诊断概况[J].生殖医学杂志,2002,11:124-127.
[14]Santos MA,Teklenburg G,Macklon NS,et al.The fate of the mosaic embryo:chromosomal constitution and development of Day 4,5and 8human embryos[J].Hum Reprod,2010,25:1916-1926.
[15]Keymolen K,Staessen C,Verpoest W,et al.Preimplantation genetic diagnosis in female and male carriers of reciprocal translocations:clinical outcome until delivery of 312cycles[J].Eur J Hum Genet,2012,20:376-380.
[16]Goossens V,Traeger-Synodinos J,Coonen E,et al.ESHRE PGD Consortium data collection XI:cycles from January to December 2008with pregnancy follow-up to October 2009[J].Hum Reprod,2012,27:1887-911.
[17]LaBonte ML.An analysis of US fertility centre educational materials suggests that informed consent for preimplantation genetic diagnosis may be inadequate[J].J Med Ethics,2012,38:479-484.
[18]SenGupta SB, Delhanty JD. Preimplantation genetic diagnosis:recent triumphs and remaining challenges[J].Expert Rev Mol Diagn,2012,12:585-592.
[19]Das M,Holzer HE.Recurrent implantation failure:gamete and embryo factors[J].Fertil Steril,2012,97:1021-1027.
[20]Harper JC,Wilton L,Traeger-Synodinos J,et al.The ESHRE PGD Consortium:10years of data collection[J].Hum Reprod Update,2012,18:234-247.

