邓恩桉幼苗生长和光合特性对盐胁迫的响应
林 益,瓮 颖,李贺鹏,岳春雷,张晓勉,高智慧,杨 乐
(1.浙江省台州市园林绿化管理处,浙江 台州 318000;2.浙江省林业科学研究院,浙江 杭州 310023;3.浙江省林业技术推广总站,浙江 杭州 310020)
近年来,土壤盐碱化已成为一个世界关注的焦点问题,解决土地盐碱化问题已成为全球性难题。盐碱胁迫严重限制了树木的生存与生长,是许多地区发展农林业生产的瓶颈[1]。目前我国拥有现代盐渍土、残余盐渍土和潜在盐渍土约9.9×108hm2,主要分布在沿海及干旱和半干旱地区[2]。土壤盐分是限制植物生长和生产的主要环境因子[3],盐胁迫对植物造成的伤害是多方面的,包括渗透胁迫、离子毒害和细胞内离子平衡的破坏等,使植物生长受到抑制,光合速率下降,衰老加速,植株最终死亡等[4~5]。盐碱土改良的措施包括水利改良、化学改良、农业改良和生物改良等,其中通过选育和培育耐盐植物品种来适应盐碱环境并最终达到改善环境的目的,是一项更加经济有效的生物措施[6~7]。
邓恩桉(Eucalyptus dunnii)为桃金娘科桉属的双蒴盖亚属树种,是一种自然分布区狭窄的高大乔木,天然分布于澳大利亚邻近新南威尔士州的北部海岸及沿海地区的热带雨林和昆士兰州东南部边境的土质肥沃地区,一般树高40 ~ 50 m,树干高而通直,树冠多枝。邓恩桉在美国、巴西和中国等地皆有引种分布,目前已在广西桂林、浙北、福建建阳、江苏南京、云南楚雄等地引种栽植[8]。目前,有研究人员邓恩桉在低温胁迫[9~11]、自然条件下的光合特性[12~13]以及磷胁迫对其酸性磷酸酶活性的影响[14]等方面进行了一些研究,但盐胁迫生理生态方面尚未见报导。
盐胁迫下植物的光合等生理方面会受到明显影响,维持光合功能是植物耐盐的重要机理之一。幼苗期对非生物胁迫很敏感,是初步鉴定植物耐盐性的理想阶段。本实验通过对邓恩桉幼苗进行不同浓度NaCl处理,研究盐胁迫下幼苗生长、光合特性及相关生理生态的变化,探讨邓恩桉叶片光合对盐胁迫响应特征,初步鉴定邓恩桉耐盐性,以期为滨海盐碱地造林的树种选择提供科学依据。
1 材料与方法
1.1 试验材料
选取的试验材料为1年实生苗。在进行耐盐试验前,对所有树种进行盆栽适应试验,于2011年5月中旬完成盆栽试验,盆栽树种在温室大棚内完成。花盆选用规格为:上口直径25.5 cm,下口直径16.0 cm,高19.0 cm。栽培基质由苗圃熟土,其理化特性见表1。正常浇水培育,并进行适当管护。经过近3个月的适应后,选取长势一致的苗木进行NaCl胁迫处理。试验设置1个对照和3个强度的胁迫处理,即对照组(浇水)(CK)、0.3%、0.6%和0.9%浓度的NaCl,每组试验各设置3组重复。

表1 邓恩桉幼苗栽培基质的理化特性Table1 Physio-chemical properties of culture substrate for E.dunnii seedlings
1.2 光合—光响应曲线和叶绿素荧光参数的测定
利用 LI-6400便携式光合作用测定系统(Licor,USA)对光响应曲线进行测定。选取自顶端向下的第 3、第4片叶片,采用标准叶室(2 cm×3 cm)并使用红蓝光源(red blue 6400-02B),设定光合有效辐射为0、20、50、100、200、400、600、800、1 000、1 200、1 500 和 2 000 μmol·m-2·s-1。
选用标准荧光叶室(6400-40 Default Flurometer)进行叶绿素荧光参数的测定。首先采用配套的暗适应叶夹对各个处理相同部位功能叶进行30min的遮光处理,立即测定其初始荧光(Fo)、最大荧光(Fm)、光化学效率(Fv/Fm)。选取的叶片与光合—光响应曲线测量的相同。
测量实验每隔10 d测定一次,即2011年8月12日、8月22日、9月3日和9月14日,均为晴朗天气。
1.3 叶绿素含量的测定
选取与测定光合作用和叶绿素荧光相同位置和发育阶段的叶片,用纯丙酮、无水乙醇和蒸馏水的混合液法提取叶绿素,并用紫外分光光度计测定吸光值,然后根据公式计算得出叶绿素总含量[15]。
1.4 数据处理
应用SPSS 13.0统计分析软件进行统计分析,并采用LSD法进行多重比较和显著性检验;用Origin7.5进行数据图绘制。
2 结果与分析
2.1 盐度胁迫对邓恩桉幼苗生长
胁迫后第3天,0.6%和0.9%处理组的叶片稍微变黄并打蔫,顶端枝条开始侧倒。第6天,0.6%处理组的1株幼苗叶片全部变枯,其它2株叶片打蔫;0.9%处理组的2株幼苗叶片全部变枯、变干,1株叶片黄化打蔫。第9天,0.3%处理组的幼苗叶片稍微打蔫;0.6%处理组的1株幼苗黄化、死亡,其它2株叶片打蔫;0.9%处理组的3株幼苗全部死亡。第12至第15天,0.6%处理组的 1株幼苗的枝条顶端部分叶片干枯,1株幼苗叶片打蔫。第19至第21天,0.6%处理组的2株幼苗全部死亡,1株幼苗部分叶片出现枯斑。第28天,0.3%处理组的1株幼苗的部分叶片出现小片干枯,其它幼苗叶片稍显蔫;0.6%处理组的1株幼苗近三分之一的叶片干枯。第32天,0.3%处理组的1株幼苗的有些叶片干枯,部分叶片尖端干枯,其它幼苗叶片稍显蔫;0.6%处理组的幼苗全部死亡。第41至第45天,0.3%处理组的1株幼苗近三分之一的叶片干枯,其它2株幼苗叶片出现干斑。第55天,0.3%处理组的1株幼苗近一半的叶片干枯,其它2株幼苗的干枯叶片稍有增加。第67天,0.3%处理组的1株幼苗几乎全部叶片干枯,其它2株幼苗的干枯叶片约占全株的六分之一。第74天,0.3%处理组的1株幼苗死亡,其它2株幼苗的干枯叶片稍有增加,但仍正常生长。

图1 盐胁迫对邓恩桉幼苗叶片总叶绿素含量的影响(P < 0.05)Figure1 Effect of NaCl stress on total chlorophyll content in leaves of E.dunnii seedling
2.2 盐度胁迫对邓恩桉幼苗生长总叶绿素含量的影响
随着胁迫时间的延长和浓度的增加,邓恩桉的叶绿素含量呈不同程度的下降趋势(图1)。各处理的叶绿素含量在不同处理时间和浓度条件下都显著低于对照(P < 0.05),0.6%的处理组显著低于0.3%的处理组(P <0.05);0.3%的处理组的叶绿素含量除了第40天的显著低于前期外,其它各时间段差异不显著;0.6%处理组的叶绿素含量在第30天时显著低于第10天时的叶绿素含量(P < 0.05),明显低于第20天的叶绿素含量,但差异不显著(P > 0.05)。说明在长时间盐胁迫下,叶绿素被破坏,分解加速;盐浓度越高,叶绿素含量越低。
2.3 盐胁迫对桉树幼苗光响应曲线的影响
植物的光合—光响应曲线是其光合作用随着PAR而改变的系列反应曲线。一般情况下,植物光合速率(Pn)总是随着盐度浓度的增加而明显下降(图2)。从图2A可知,在处理后的第10天,不同盐胁迫的邓恩桉幼苗Pn随着PAR的增加呈现一定差异;在PAR < 200 µmol·m-2·s-1时,各胁迫阶段Pn增加迅速;之后随着PAR的增加,除对照的Pn呈现平缓上升,PAR在1 000 µmol·m-2·s-1附近时达到最大值,之后呈现逐渐降低的变化趋势外,0.3%和0.6%的处理组Pn变化平缓且略有波动;盐胁迫后的Pn在PAR > 100 µmol·m-2·s-1后明显低于对照,说明盐胁迫明显抑制了植物的光合作用。在处理后的第20天,对照组的Pn与第10天的变化趋势相似,只是PAR在800 µmol·m-2·s-1附近时达到最大值,之后呈现逐渐降低的变化趋势;0.3%和0.6%的处理组Pn与第10天相比基本相似,但下降的变化趋势更为明显,Pn基本在0附近波动,但PAR在1 500 µmol·m-2·s-1附近时都有明显的上升趋势,之后呈下降的变化趋势(图2B)。在处理后的第30天,对照组的Pn与第10天和第20天的变化趋势相似,但在Pn达到最大值后的逐渐降低的变化趋势稍低于前两个时期;0.3%和0.6%的处理组Pn变化平缓且波动,特别是0.6%的处理组Pn的波动更为显著(图2C)。在处理后的第40天,对照组的Pn与前期的变化趋势基本相似;0.3%处理组Pn在PAR < 100 µmol·m-2·s-1时呈现明显上升,之后随着PAR的增加基本变化不明显,但稍有波动(图2D)。这说明盐胁迫导致邓恩桉幼苗光合作用减弱。
2.4 盐胁迫对桉树幼苗叶片叶绿素荧光的影响
Fv/Fm是PSⅡ最大光化学量子产量,其大小反映了PSⅡ反应中心内初光能的转换效率(最大转换效率),胁迫条件下该参数明显下降,是反映光抑制程度的良好指标。Fv/Fo则反映了PSⅡ的潜在活性,二者是光化学反应状况评价的两个重要参数。在本试验中盐胁迫下Fv/Fm呈下降趋势(图3),其中在第10天时,0.3%和0.6%的处理组显著降低(P < 0.01),平均降幅分别为4.2%和4.8%,但两者之间差异不显著(P > 0.05)。第20天时,对照组的Fv/Fm显著高于盐胁迫的处理组(P < 0.01),0.3%和0.6%的处理组平均降幅分别为3.1%和5.6%,盐胁迫处理组间差异不显著(P > 0.05);并且与第10天的胁迫处理相比差异不显著(P> 0.05)。随着处理时间的延长呈明显下降趋势,第30天时,0.3%和0.6%的处理组显著下降(P< 0.01),平均降幅分别为6.9%和7.6%;0.3%处理组的Fv/Fm与第10天和第20天相比出现下降,但差异不显著(P > 0.05);0.6%处理组的Fv/Fm与第10天和第20天相比出现显著下降,且与第10天的处理差异显著(P < 0.05),但与第20天的处理差异不显著(P > 0.05)。第 40天时,0.6%处理组全部死亡;0.3%处理组与第30天相比显著上升(P < 0.05),但仍显著低于对照(P < 0.01)。

图2 盐胁迫对邓恩桉幼苗叶片Pn-PAR的影响Figure2 Effect of NaCl stress on net photosynthetic rate (Pn) and photosynthetically available radiation(PAR) in leaves of E.dunnii seedling

图3 盐胁迫对桉树幼苗叶片PSⅡ最大光化学效率的影响(P < 0.05)Figure3 Effect of NaCl stress on maximal photochemical eficiency of PSⅡ(Fv/Fm) in leaves of E.dunnii seedling
盐胁迫下Fv/Fo的变化趋势与Fv/Fm相似(图4)。各处理的Fv/Fo都显著低于对照(P<0.05),随着处理时间的延长,呈逐渐降低的变化趋势,0.3%的处理组在第40天时呈明显上升趋势,且显著高于第30天的Fv/Fo(P < 0.05),说明邓恩桉幼苗已基本适应低盐度环境。
3 结论与讨论
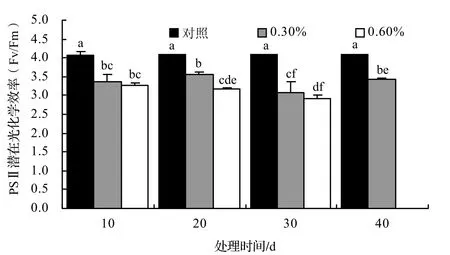
图4 盐胁迫对桉树幼苗叶片PSⅡ潜在光化学效率的影响(P < 0.05)Figure4 Effect of NaCl stress on pontential photochemical efficiency of PSⅡ(Fv/Fo)in leaves of E.dunnii seedling
通常情况下,生长抑制是植物对盐渍响应最敏感的过程[16],但适度盐能促进和不影响一些植物的生长,如耐盐植物厚叶石斑木[17]等。在盐胁迫条件下,植株的存活率是表现植株抗盐能力的可靠指标[7]。本研究结果显示:幼苗期内在 0.6%及其以上的盐胁迫都致使邓恩桉死亡,0.3%浓度的胁迫也使幼苗生长受到显著影响,其中1株幼苗死亡,但也有调查发现邓恩桉可以在钱塘江海塘含盐量达 0.5%以上重盐碱地生长的报道[18],这可能是植物在幼苗期对非生物的胁迫反应更为敏感的缘故[19]。
植物叶片叶绿素含量是衡量植物在耐盐性的重要生理指标之一。目前对盐胁迫下植物叶绿素含量变化的机理尚未形成统一的认识,一些研究证实土壤盐胁迫可能破坏植物叶绿体结构,使体内叶绿素含量下降,引起植株光合能力减弱[20~21];但也有学者认为,低钠盐可以增加植物体内叶绿素含量[4,22]。本试验研究结果显示,盐胁迫下总叶绿素含量均呈现下降趋势,且随着胁迫强度的增加,总叶绿素下降显著,同时随着处理时间的延长,总叶绿素含量呈明显下降趋势;另外盐胁迫显著降低了邓恩桉的光合能力,同时随着胁迫强度的增加及处理时间的延长,植物光合速率呈明显下降趋势。这与前人研究的结论[20~21]相一致,主要原因是在盐碱胁迫条件下,随胁迫强度的增加,叶绿素与蛋白质之间的结合变松,使更多的叶绿素遭到破坏,进而导致光合作用降低。
叶绿素荧光信号可反映逆境因子对光合作用的影响[23],有关NaC1处理对PSⅡ活性的影响,目前缺乏统一的认识[24]。在叶绿素荧光参数中,Fv/Fm反映了开放的PSⅡ反应中心捕获激发能的效率,是研究植物胁迫的重要参数,任何影响PSⅡ效能的环境胁迫均会使Fv/Fm降低[25]。如盐旱胁迫导致葡萄的Fv/Fm和Fv/Fo降低[26]。本研究中,随着盐胁迫程度的加强和时间的延长,Fv/Fm和Fv/Fo均明显下降,表明NaC1胁迫破坏叶绿体光合机构,PSⅡ反应中心受损,抑制光合作用的原初反应,阻碍光合电子传递的过程,明显降低PSⅡ原初光能转换效率,抑制PSⅡ潜在活性[27~28],最终影响光合机构的作用,导致净光合速率的显著下降。另外,Fv/Fm和Fv/Fo受到抑制,可保证植物在盐胁迫下生存时对能量的需求,这是对植物生存和环境的适应有重要意义。
综上所述,邓恩桉幼苗可耐受较低盐度环境,在盐度 0.3%的条件下能够保持一定生长;盐度浓度在 0.6%及其以上时,邓恩桉幼苗生长受到显著影响,并致死;盐胁迫通过破坏叶片叶绿素,损伤PSⅡ反应中心,最终导致植物的光合作用下降。因此在沿海造林工程中,特别是盐度较高的区域,不宜选取邓恩桉幼苗,生长年限稍长的大苗可能会更好些。
[1]张忠辉,林士杰,吕忠明,等.树木耐盐碱性研究进展[J].中国农学通报,2011,27(28):9-14.
[2]张建锋,张旭东,周金星,等.世界盐碱地资源及其改良利用的基本措施[J].水土保持研究,2005,12(6):28-30.
[3]Allakhverdiev SI, Sakamoto A, Nishiyama Y,et al.Ionic and osmotic effects of NaCl-induced inactivation of photosystems I and II in Synechococcus sp[J].Plant Physiol, 2000, 123(3):1 047-1 056.
[4]Munns R.Physiological processes limiting plant growth in saline soils: Some dogmas and hypotheses [J].Plant, cell and Environ, 1993, 16(1):15-24.
[5]秦景,贺康宁,谭国栋,等.NaCl胁迫对沙棘和银水牛果幼苗生长及光合特性的影响[J].应用生态学报,2009,20(4):791-797.
[6]Marcum KB.Salinity tolerance mechanisms of grasses in the subfamily chloridoideae [J].Crop Sci, 1999, 39(4):1 153-1 160.
[7]张川红,沈应柏,尹伟伦,等.盐胁迫对几种苗木生长及光合作用的影响[J].林业科学,2002,38(2):27-31.
[8]宗亦臣,郑勇奇,常金财.邓恩桉国内引种和繁育技术研究进展[J].中国农学通报,2010,26(5):82-86.
[9]刘建,叶露,周坚,等.夜间低温对2种桉树幼苗光合特性的影响[J].西北植物学报,2007,27(10):2 024-2 028.
[10]刘建,黄宏富,朱光泰,等.尾叶桉、邓恩桉幼苗对低温胁迫的光合生理响应[J].林业科技开发,2008,22(6):51-53.
[11]刘建,项东云,陈健波,等.低温胁迫对桉树光合和叶绿素荧光参数的影响[J].桉树科技,2009,26(1):1-6.
[12]苏冬梅,廖飞勇.夏季自然高温对桉树光合速率和暗呼吸速率的影响[J].生态科学,2001(20):21-24.
[13]王力朋,何茜,齐涛,等.桉树人工林生长与光合特性的季节变化[J].广西林业科技,2011,27(5):63-66.
[14]冯丽贞,黄勇,马祥庆.磷胁迫对不同桉树品种酸性磷酸酶活性的影响[J].热带作物学报,2008,29(2):131-135.
[15]陈福明,陈顺伟.混合液法测定叶绿素含量的研究[J].浙江林业科技,1984,4(1):4-8.
[16]Munns R.Comparative physiology of salt and water stress [J].Plant, Cell and Environ, 2002, 25(2):239-250.
[17]裘丽珍,黄有军,黄坚钦,等.不同耐盐性植物在盐胁迫下的生长与生理特性比较研究[J].浙江大学学报(农业与生命科学版),2006,32(4):420-427.
[18]高良,俞金清,许基全.邓恩桉:海塘盐碱地绿化的优良树种[J].中国林业,2009(2A):47.
[19]陈健妙,掷青松,刘兆普,等.麻疯树(Jatropha curcasL.)幼苗生长和光合作用对盐胁迫的响应[J].生态学报,29(3):1 356-1 365.
[20]王素平,李娟,郭世荣,等.NaC1胁迫对黄瓜幼苗植株生长和光合特性的影响[J].西北植物学报,2006,26(3):455-461.
[21]汪贵斌,曹福亮.盐分和水分胁迫对落羽杉幼苗的生长量及营养元素含量的影响[J].林业科学,2004,40(6):56-62.
[22]Munns R, Temmat A.whole-plant responses to salinity[J].Aust J Plant Physiol, 1986, 13(1):143-160.
[23]高芸,程智慧,孟焕文.NaC1处理对番茄幼苗光合作用和叶绿素荧光的影响[J].干旱地区农业研究,2008,26(1):194-199.
[24]朱新广,张其德.NaC1对光合作用影响的研究进展[J].植物学通报,1999,16(4):332-338.
[25]李敦海,宋立荣,刘永定.念珠藻葛仙米叶绿素荧光与水分胁迫的关系[J].植物生理学通讯,2000(3):205-208.
[26]邢庆振,郁松林,牛雅萍,等.盐胁迫对葡萄幼苗光合及叶绿素荧光特性的影响[J].干旱地区农业研究,2011,29(3):96-100.
[27]Everard JD, Gucci R, Kann SC,et a1.Gas exchange and carbon partitioning in the leaves of celery (Apium graveolens L.) at various levels of root zone salinity [J].Plant Physiol, 1994, 106(1):281-292.
[28]Shabala S N, Shabala S I, Martynenko A I,et a1.Salinity effect on bioelectric activity growth Na+accumulation and chlorophyll fluorcscence of corn leaves: a comparison survey and prospects for screening[J].Aust J Plant Physiol, 1998, 25(5):609-6l6.

