江苏安徽地区鹅源沙门菌的分离鉴定及耐药性分析
査 华,石火英,尚 竟,晋海云,刘 伊,王 婉
(扬州大学兽医学院病理教研室禽类预防医学教育部重点实验室,江苏 扬州 225009)
沙门菌是一种对人和动物都非常重要的致病菌,它不但可引起多种畜禽疾病,造成全身性败血症和肠炎,还可以作为食源性疾病的病原体,引起人类胃肠炎和食物中毒[1,2]。禽源沙门菌是严重危害我国禽业的重要传染病,可造成种蛋孵化率、雏禽存活率和禽生产性能下降等问题[3]。鸡白痢沙门菌是禽源沙门菌中的一种,在各种年龄鸡只都可发病。抗生素是防治鸡白痢重要措施,但抗生素的滥用造成了鸡白痢沙门菌的耐药性逐年上升[4-,5]。虽有文献报道鹅源沙门菌诊断和防治,但针对鹅源沙门菌的实验室诊断、分型和耐药性分析却较为罕见[6]。本研究对2012年6月-2013年1月江苏、安徽地区的532份鹅源病料、泄殖腔棉拭子进行了沙门菌的分离,并对鉴定出的15株鹅源沙门菌进行血清型分型及药物敏感性试验,以期对鹅源沙门菌新近分离株的流行分布及耐药性提供试验依据。
1 材料与方法
1.1 病料来源 扬州大学动物医院来源的江苏、安徽地区鹅源病料,汇集江苏、安徽地区鹅的扬州市活禽市场所采集的鹅泄殖腔棉拭子。
1.2 质控菌株及主要试剂 药敏试验大肠杆菌标准质控菌株ATCC25922,由实验室保存。沙门菌属诊断血清(60种),购自兰州生物制品研究所;PCR相关试剂,购自宝生物工程(大连)有限公司;亚硒酸盐胱氨酸(SC)增菌液,麦康凯培养基、S.S.培养基(沙门、志贺氏菌属琼脂培养基),购自上海生工生物工程技术服务有限公司;肠杆菌科细菌生化鉴定管及成套试剂,购自杭州天和微生物试剂有限公司。
1.3 药敏纸片 头孢曲松(30μg),四环素(30 μg),壮观霉素(100μg),头孢西丁(30μg),链霉素(10μg),氯霉素(30μg),头孢孟多(30μg),卡那霉素(30μg),复方新诺明(23.75μg),磺胺异噁唑(300μg),羧苄青霉素(100μg),庆大霉素(10 μg),甲氧苄啶(5μg),萘啶酸(30μg),氨苄西林(10μg),头孢噻肟(30μg),环丙沙星(5μg),阿莫西林-克拉维酸(20μg)等18种药敏纸片,均购自杭州天和微生物试剂有限公司。
1.4 细菌分离、纯化及革兰染色 以常规无菌操作方法剖检病死鸡,取病料、泄殖腔样品置于SC肉汤中,37℃摇床增菌18~24 h;转接于麦康凯培养基,置于37℃培养箱培养18~48 h,挑取可疑菌落于S.S.及麦康凯培养基进行分离纯化。将纯化菌直接涂片,按革兰染色程序(草酸铵结晶紫液1 min,碘液1min,95%酒精15~30 s,沙黄复染液1 min)操作后,在光学显微镜下观察菌体形态。
1.5 PCR鉴定沙门菌属 针对沙门菌肠毒素STN基因设计引物,上游引物 P1:5′-CTTTGGTCGTA⁃AAATAAGGCG-3′,下游引物P2:5′-TGCCCAAAG CAGAGAGATTC-3′[7]。PCR体系为25 μL,模板为纯化后的疑似沙门菌单菌落提取的DNA。扩增程序为94℃ 5 min;94℃ 1min、55℃ 1min、72℃ 1 min,25个循环;72℃10min。扩增产物经琼脂糖凝胶电泳检测。
1.6 生化试验鉴定沙门菌 PCR鉴定为阳性的分离株,进行硫化氢、苯丙氨酸、赖氨酸、鸟氨酸、棉子糖等15种生化指标的测定。
1.7 血清学分型 对STN基因扩增为阳性、生化试验符合沙门菌特性的分离株,再次纯化,涂布于LB培养基,按照中华人民共和国国家标准GB 4 789.4~2010,进行血清型鉴定[8]。
O抗原鉴定:用A-F多价O血清进行玻板凝集实验,同时设以生理盐水对照。生理盐水不凝集而O多价血清凝集者,用O9;O4;O10;O7;O8;O2和O11因子血清做凝集试验。根据试验结果,判定O群。
H抗原鉴定:生理盐水对照为阴性者,进行H多价1、H多价2、H多价3、H多价4血清进行鉴定,对于阳性者,再用对应的H复合血清及H单因子血清逐一检查,以确定H第一相及第二相H抗原。每一个H抗原成分的最后确定均应根据H单因子血清的检查结果,没有H单因子血清的要用两个H复合因子血清进行核对。
1.8 药物敏感性试验 对鉴定出的鹅源沙门菌分离株,通过琼脂纸片扩散法(Kirby-Bauer,K-B)进行头孢曲松、四环素、壮观霉素、头孢西丁等18种抗菌药物的敏感性试验,以大肠杆菌ATCC25922作为质控菌株,按CLSI2009版的标准进行结果判定[9]。
1.9 动物试验 筛选2株所分离沙门菌优势菌(鸡白痢沙门菌)S1084和S1088,对1日龄SPF雏鸡进行致死性试验,腹腔注射200μL/只(约含菌量1×109CFU),每组10只,并设置阴性对照组,注射后观察2周,记录死亡情况,并剖检死亡鸡只,取肝、脾在麦康凯培养基、S.S.培养基进行细菌分离,37℃培养18~48 h,观察菌落形态并用O9单因子血清进行鉴定。
2 结果与分析
2.1 分离菌培养特性与形态特征 病料接种后,可见在麦康凯培养基均形成无色、半透明、边缘整齐、光滑型圆形小菌落;在S.S.培养基形成白色或中心带黑色的边缘整齐、光滑、圆形小菌落;革兰染色镜检可观察到散在排列的红色短小杆菌,符合沙门菌的特征。
2.2 PCR鉴定结果 在初步分离的疑似沙门菌中,采用针对沙门菌肠毒素STN基因的引物进行PCR扩增,其中有15个分离株基因组DNA中能够扩增出约260 bp DNA片段,与沙门菌预期扩增结果一致,表明所分离菌中有15株为沙门菌。
2.3 生化试验 分离株能产生硫化氢,利用木糖、鸟氨酸、赖氨酸、M.R.、葡萄糖产气、山梨醇,而其余指标如V-P、动力、侧金盏花醇等为阴性。
2.4 血清型鉴定 经血清型鉴定,所分离15株沙门菌中,10株为鸡白痢沙门菌,2株为德尔卑沙门菌,1株为汤卜逊沙门菌,1株为鼠伤寒沙门菌,1株为里吉尔沙门菌。沙门菌分布情况如表1。
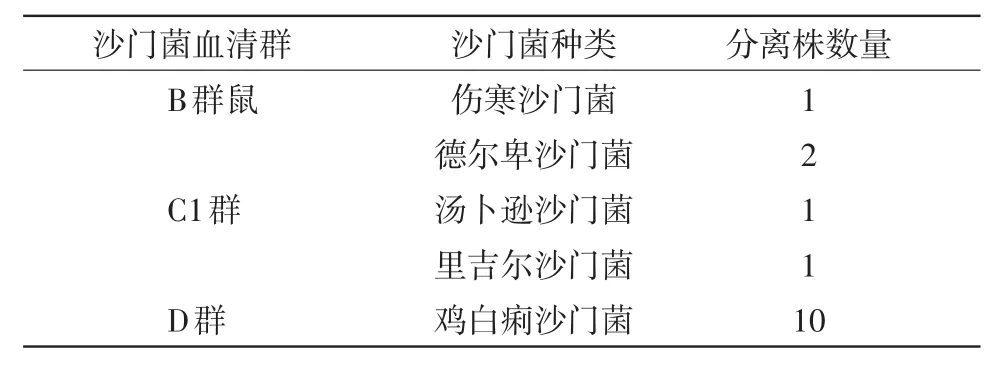
表1 鹅源沙门菌分离株的分布情况
2.5 药物敏感性试验结果 所鉴定15个鹅源沙门菌分离株的18种抗菌药物的药物敏感性试验结果显示,分离株对萘啶酸全部耐药,对羧苄青霉素、氨苄西林、链霉素和磺胺异噁唑也具有很高的耐药性,耐药率分别为93.33%、86.67%、80%和80%;而对头孢曲松、头孢西丁和卡那霉素耐药性较低,各抗菌药物分布菌数及所占比例见表2。除个别分离株耐药性较低外,86.67%的分离株为多重耐药菌,且多为7耐菌和8耐菌,表型为TETSTR-SUL-CAR-NAL-AMP-AMX和STR-CE-SULCAR-NAL-AMP-AMX,8耐分离株表型分别为TET-STR-CE-SUL-CAR-NAL-AMP-AMX、SPTSTR-SXT-SUL-CAR-TMP-NAL-AMP和STR-CECAR-TMP-NAL-AMP-CTX-AMX;甚至出现14耐和15耐的高度耐药菌,分离株表型见表3。
2.6 致死性试验结果 1日龄雏鸡接种S1084和S1088后24 h内即出现死亡,其余死亡鸡分布在攻毒后6 d内,而在7~14 d期间未见鸡死亡,所攻毒鸡的死亡总数分别为10只和8只,阴性对照组鸡生长健康。剖检死亡雏鸡,并进行肝和脾的沙门菌分离,在麦康凯和S.S.培养基所培养细菌均符合沙门菌菌落形态,O9血清鉴定纯化后细菌,都为强阳性凝集,且健康组鸡肝、脾内未分离到细菌,表明攻毒组确为鸡白痢沙门菌感染,进而说明鹅源鸡白痢沙门菌对雏鸡具有很高的致病性。
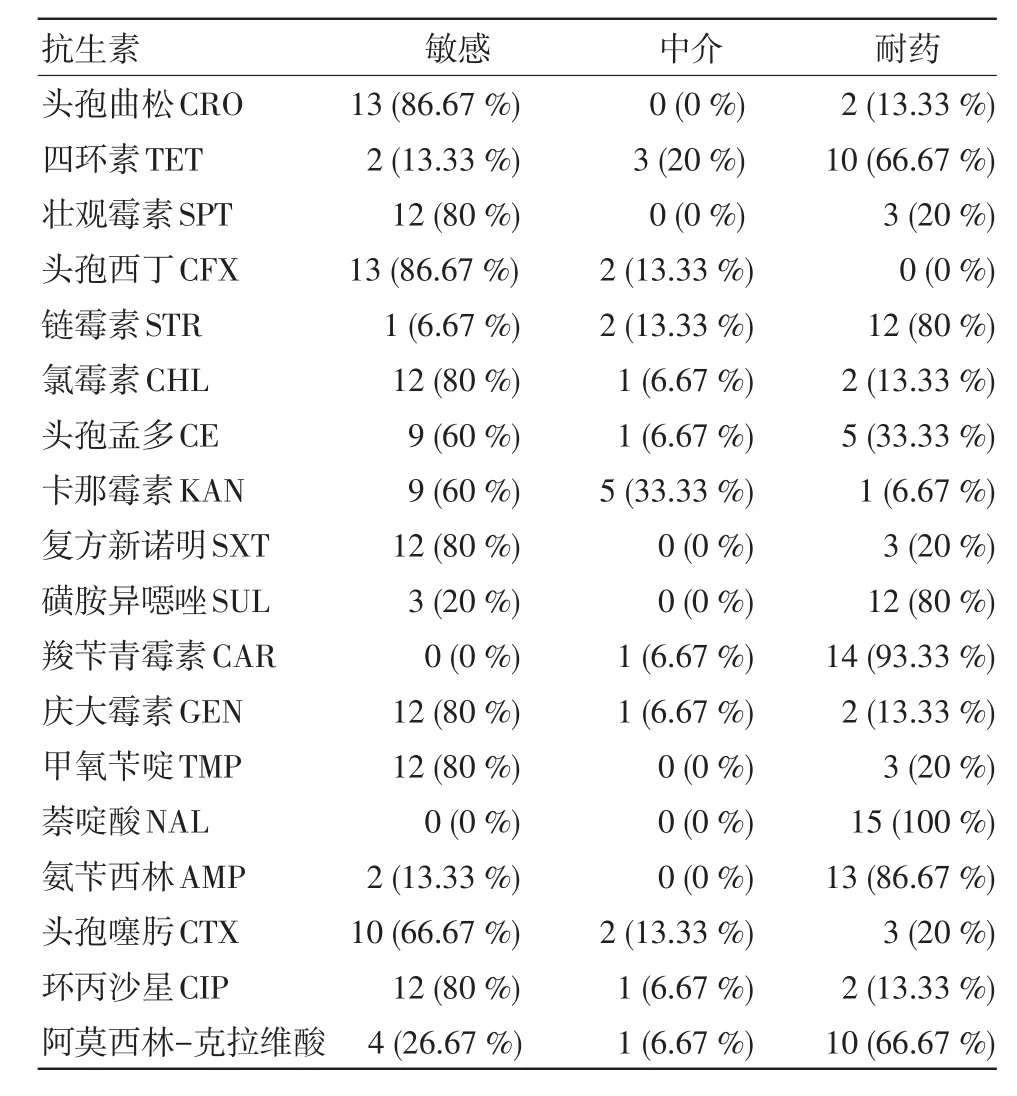
表2 鹅源沙门菌抗菌药物分布菌数及所占比例统计

表3 鹅源沙门菌的耐药表型
3 讨论
禽源沙门菌是危害我国养禽业的重要传染病病原,给家禽养殖和蛋类生产带来严重的经济损失。目前沙门菌防治以抗生素治疗和生物防控为主,但部分地区抗生素的滥用也造成了禽源沙门菌耐药性的上升。近年来,有报道沙门菌的流行病学和耐药监测,但针对鹅源沙门菌的流行、亚型分布和耐药监测却比较少见[6,10]。本研究通过分子生物学方法与传统方法结合,对鹅源病料、棉拭子进行沙门菌的分离鉴定和多重耐药性分析,共鉴定新近鹅源沙门菌15株,阳性率为2.82%,分布于B群、C1群和D群,其中鸡白痢沙门菌占多数(66.67%)。药敏结果显示,分离株对萘啶酸全部耐药,对羧苄青霉素、氨苄西林、链霉素和磺胺异噁唑耐药性也很强,由于动物源的沙门菌耐药机制将会影响人类健康,因此,兽医临床工作者应控制抗菌药物的使用和用量。在全部鹅源沙门菌中,86.67%的分离株为多重耐药性菌,且耐药性很强,甚至出现15耐的罕见多重耐药菌(为德尔卑沙门菌)。值得注意的是,所有鹅源鸡白痢沙门菌耐药性在7耐及7耐以上,其水平传播很可能使鸡具有很高的耐药性和致病性,既而对养鸡业的雏鸡繁殖和蛋类生产造成重大经济损失,故建议进行鸡和鹅的分群饲养,并对鹅源鸡白痢沙门菌进行长期的耐药监测。
[1] NeSBITT A,Ravel A,Murry R,et al.Integrated surveillance and potential sources of Salmonella Enteritidis in human cases in Canada from 2003 to 2009[J].Epidemiol Infect,2012,140(10):1757-1772.
[2] Severi E,Booth L,Johnson S,etal.Large outbreak of Salmonel⁃la Enteritidis PT8 in Portsmouth,U K,associated with a restau⁃rant[J].Epidemiol Infect,2011,14:1-9.
[3] Bao H,Zhang H,Wang R.Isolation and characterization of bac⁃teriophages of Salmonella enterica serovar Pullorum[J].Poult Sci,2011,90(10):2370-2377.
[4] Threlfall E J,Fisher IS,Berghold C,et al.Antimicrobial drug resistance in isolates of Salmonella enterica from cases of salmo⁃ nellosis in humans in Europe in 2000: results of international multicentre surveillance[J]. Euro Surveill,2003,8(2):41-45.
[5] Pan ZM,Wang X Q,Zhang XM,etal.Changes in antimicrobi⁃al resistance among Salmonella enterica subspecies enterica se⁃rovar Pullorum isolates in China from 1962 to 2007[J].Veteri⁃nary Microbiology,2009,136(3-4):387-392.
[6] 金海林,赵权.鹅沙门菌病的诊断与防治[J].中国兽医杂志,2012,48(2):87-88.
[7] 刘蓓蓓.沙门菌PCR检测方法的建立及其初步应用[D].扬州:扬州大学,2009.
[8] Popoff M,Le Minor L.Antigenic formulas of the Salmonella se⁃rovars,WHO Collaborating Centre for Reference and Research on Salmonella[z].World Health Organ,2001.
[9] Clinical and Laboratory Standard Institute.Performance stan⁃dards for Antimicrobial Susceptibility Testing[S].Nineteenth In⁃formational Supplement,2009:M100-S19.
[10]孙化露,姜逸,李树纯,等.动物源性沙门菌的血清型、生物被膜形成能力和耐药性分析[J].畜牧兽医学报,2012,43(10):1630-1638.

