不同极性红枣多酚的抗氧化活性比较*
王毕妮,黄庆瑗,高慧,程妮,曹炜
(西北大学化工学院 食品工程系,陕西西安,710069)
红枣(Ziziphus jujube Mill)为鼠李科枣属植物,是我国的特色果品之一,具有很高的营养及保健功效,是天然的药食同源果品,也是我国特有的功能性食品资源。我国红枣资源丰富,是最大的红枣出口国,全国红枣栽培面积在1.5万hm2以上,每年出口鲜枣达40万t,约有0.47万t干枣出口美国,每年创汇收入500万美元。红枣不仅营养丰富,还含有多种生物活性物质,如多糖[1]、三萜类[2]、生物碱[3]和多酚类[4-8]等,具有很高的药用保健价值,作为营养保健品备受人们青睐。多酚是植物体内重要的次生代谢产物,已被证实具有广泛的生物活性,包括抗氧化、抗炎、抗癌、抗肿瘤、抗病毒、抗血栓形成和抗动脉硬化等多种生理功能[9-11],因其自身的安全性已成为近年来食品科学的研究热点。
目前对红枣多酚的抗氧化活性研究多集中于其粗提物的抗氧化活性评价方面,所得提取物纯度低,活性低,不利于后期强效多酚保健食品的开发。为增加红枣多酚提取物中强效多酚的含量,需确定其抗氧化活性部位。已有多项研究报道[12-16],不同极性溶剂通过液-液萃取的方法可以实现不同极性多酚的分离,从而筛选出强效多酚的存在部位,利于获取。有关此法分离红枣多酚尚未见报道。
本研究采用液-液萃取法对红枣多酚粗提物中不同极性多酚进行分离,并比较不同极性红枣多酚的提取率、总酚含量及其抗氧化活性,以确定红枣强效多酚的有效部位。
1 材料与方法
1.1 材料与试剂
红枣,购自于陕西佳县,全红期采摘,采摘后置于50℃烘干,包装后置于冰箱保存。
DPPH(1,1苯基-2-苦肼基自由基)、没食子酸、芦丁、Trolox(水溶性VE)、TPTZ(三吡啶三吖嗪),均购自 Sigma公司(Sigma-Aldrich,Steinheim,Germany);其余试剂均为国产分析纯。
1.2 仪器与设备
721-分光光度计,上海精密科学仪器有限公司;HH-2数显恒温水浴锅,国华电器有限公司;KQ-100型超声波清洗机;电子分析天平,北京塞多利斯天平有限公司;低速大容量多管离心机,上海安亭科学仪器厂。
水为超纯水(purified by Milli-Q system(Millipore,Bedford,MA,USA))。
1.3 实验方法
1.3.1 不同极性红枣多酚的提取分离
取红枣5 kg,加入10倍体积分数 80%甲醇溶液,1 000 W超声室温下提取30 min,2 000 g离心10 min后收集上清液,残渣以同样方法重复提取2次,合并各提取液,35℃下真空浓缩脱除甲醇后,得红枣多酚粗提液。然后向红枣多酚粗提液中加入等体积的石油醚,充分振荡后于分液漏斗中分层,得石油醚层和水层;在水层中再加入等体积的三氯甲烷,振荡后分层,得三氯甲烷层和水层;同样的方法,再在水层中依次加入乙酸乙酯和正丁醇,分别得到乙酸乙酯层、正丁醇层和水层,每种溶剂萃取重复五次。将各极性部位萃取液合并、真空浓缩,水层进行真空冷冻干燥,即可得到不同极性的红枣多酚提取物。
1.3.2 总酚含量的测定
采用Folin-Ciocalteu比色法[17]。准确移取适当稀释的各样品液0.2 mL,分别加入稀释1倍的Folin酚试剂0.5 mL,混匀,再加入质量分数10% 的Na2CO3溶液1.5 mL,然后用蒸馏水定容至10 mL,混合均匀,75℃下反应10 min后于760 nm波长处测定吸光值。结果以红枣各提取物中含有相当没食子酸的毫克数表示(mg GAE/g)。
1.3.3 总抗氧化能力的测定
采用FRAP(ferric reducing antioxidant power)法[18]。取各样品液25 μL,加入4.0 mL TPTZ 工作液(由300 mol/L pH 3.6的醋酸盐缓冲液25 mL,10 mmol/L TPTZ 溶液 2.5 mL,20 mmol/L FeCl3溶液2.5mL组成),混匀后37℃反应10 min,593 nm测定吸光度,以1.0 mmol/L Trolox为标准,样品总抗氧化能力以达到同样吸光度所需的Trolox的量(μmol)表示(μmol Trolox Equivalent(TE)/g)。
1.3.4 DPPH自由基清除能力的测定
按照Atoui等的方法进行测定[19]。准确移取各样品液稀释1倍后,取25 μL于试管中,加入0.1 mmoL/L DPPH溶液4.0 mL,再用蒸馏水定容至10 mL,常温避光反应30 min后于517 nm波长处测定吸光值。以乙醇作对照,DPPH·清除能力以其清除率表示。各部分粗提物的DPPH·清除率可根据吸光值通过以下公式计算:
DPPH·的清除率/% =(1-A1/A0)×100
式中:A1为样品组的吸光值,A0为对照组的吸光值。
1.3.5 Fe2+络合能力的测定
按照Nandita等的方法进行测定[20]。准确吸取样品溶液1 600 μL,加入1 mmol/L FeSO4溶液200 μL,1 mmol/L Ferozine 试剂 400 μL,并用甲醇定容至4 mL,混匀后反应10 min,在562 nm处测吸收值。以不加样品溶液为空白对照,以Na2EDTA为阳性对照,结果表示为每克提取物相当于Na2EDTA的毫克数。
1.4 统计分析
所有测得的实验数据都以3个重复的均值士标准差来表示。数据分析通过SAS(version 8.0)完成。采用Duncan多元回归方法分析0.05水平上均值的显著性差异。
2 结果与分析
2.1 不同极性红枣多酚的总酚含量
红枣中多酚成分复杂,采用不同极性有机溶剂萃取可以实现多酚的分离(表1)。萃取溶剂的极性越大,多酚的提取率越高,总酚含量也越高。尤其是水层提取物,多酚的提取率达到32.52%,是乙酸乙酯层的近5倍;其总酚含量也最高,是正丁醇层的3倍多,是乙酸乙酯层的近8倍。可见,红枣多酚主要以极性酚为主,其具体组成还需进一步深入分析。

表1 不同极性红枣多酚的提取率及总酚含量Table 1 Extraction rates and total phenolic contents of jujube polyphenols with different polarities
2.2 不同极性红枣多酚的总抗氧化能力
食品功能活性成分研究的关键不是提取出更多的成分,而是得到更多具有高活性的功能成分。因此,在采用不同极性有机溶剂分离多酚时,还需考虑各极性部位提取物的抗氧化活性,以利于后续强效多酚的分离。从图1可以看出,按照有机溶剂极性由小到大的顺序,各极性部位提取物的总抗氧化能力呈递增的顺序。水层多酚提取物的总抗氧化能力(809.941 μmol TE/g)是正丁醇层的2.5倍多,且远远强于其他各弱极性部位。

图1 不同极性红枣多酚的总抗氧化能力比较Fig.1 Comparison of total antioxidant capacities of jujube polyphenols with different polarities
2.3 不同极性红枣多酚的DPPH·清除能力
以Vc作为阳性对照,与各极性部位红枣多酚提取物的DPPH·清除能力的比较结果如图2所示。由图2可见,随着萃取溶剂极性的增强,其提取物的DPPH·清除能力也逐渐增强。其中石油醚层、三氯甲烷层和乙酸乙酯层多酚提取物清除DPPH·的能力显著弱于等量的Vc(P<0.05),正丁醇层不显著高于Vc(P>0.05),而水层提取物的DPPH·清除能力达90%以上,是Vc的2倍多。可见红枣多酚水层提取物对DPPH·具有很强的清除能力。
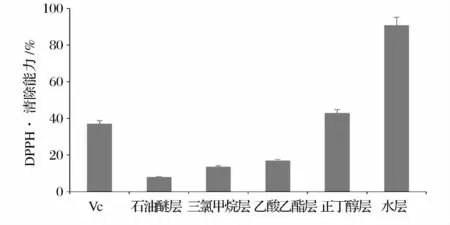
图2 不同极性红枣多酚的DPPH自由基清除能力比较Fig.2 Comparison of DPPH radical scavenging capacities of jujube polyphenols with different polarities
2.4 不同极性红枣多酚的Fe2+络合能力
Fenton反应中,Fe2+能够催化 H2O2的氧化反应,生成羟基自由基;而多酚类物质可络合Fe2+,降低Fenton反应的反应速率,进而降低羟基自由基的生成速率,实现其抗氧化作用。如图3所示,萃取红枣多酚的有机溶剂的极性越强,其提取物对Fe2+的络合能力越强。水层多酚提取物的Fe2+络合能力最强(130.359 mgNa2EDTA/g),是正丁醇层的2倍多,乙酸乙酯层和三氯甲烷层间无显著性差异(P>0.05),石油醚层最弱,仅为水层的14%。

图3 不同极性红枣多酚对Fe2+络合能力的比较Fig.3 Comparison of complexing capacities to Fe2+of jujube polyphenols with different polarities
2.5 相关性分析
对红枣中不同极性多酚的总酚含量与其抗氧化活性进行相关性分析,结果发现,总酚含量与各抗氧化活性评价指标均呈一定的正相关性(R>0.981),且各抗氧化活性评价指标间也表现较强的正相关(R>0.992),表明不同极性红枣多酚的抗氧化活性主要与其总酚含量有关。
3 结论
不同极性红枣多酚的提取率、总酚含量和抗氧化活性存在着显著差异,萃取溶剂的极性越强,总酚含量越高、抗氧化活性越强,即水层>正丁醇层>乙酸乙酯层>三氯甲烷层>石油醚层。采用不同极性有机溶剂分级萃取的方法可以使红枣多酚按极性有效分离,增加萃取溶剂的极性有利于提高强效多酚的含量,可先去除提取物中的弱极性部位,使总酚含量最高、抗氧化活性最强的水层多酚得到富集,以获得较高抗氧化活性的红枣多酚,这为高抗氧化活性红枣多酚的组成分析及分离鉴定奠定了基础,此部位的其他生物活性还有待于进一步研究。
[1]赵智慧,刘孟军,屠鹏飞.金丝小枣水溶性粗多糖性质研究[J]. 河北农业大学学报,2010,33(5):58-61.
[2]GUO S,DUAN J A,TANG Y P,et al.High-performance liquid chromatography two wavelength detection of triterpenoid acids from the fruits of Ziziphus jujuba containing various cultivars in different regions and classification using chemometric analysis[J].Journal of Pharmaceutical and Biomedical Analysis,2009,49(5):1 296 -1 302.
[3]孙灵霞,张秋会,陈锦屏.红枣的保健作用及其综合利用[J].农产品加工,2008(4):55-57.
[4]ZHANG H,JIANG L,YE S,et al.Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube(Ziziphus jujuba Mill.)from China[J].Food Chemistry Toxicology,2010,48:1 461 -1 465.
[5]Choi S H,Ahn J B,Kim H J,et al.Changes in free amino acid,protein,and flavonoid content in jujube(Ziziphus jujube)fruit during eight stages of growth and antioxidative and cancer cell inhibitory effects by extracts[J].Journal of Agricultural and Food Chemistry,2012,60:10 245 -10 255.
[6]CHEN J P,LI Z G,Maiwulanjiang M,et al.Chemical and biological assessment of Ziziphus jujuba fruits from China:different geographical sources and developmental stages[J].Journal of Agricultural and Food Chemistry,2013,61:7 315-7 324.
[7]WANG B N,LIU H F,ZHENG J B,et al.Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J].Journal of Agricultural and Food Chemistry,2011,59:1 288 -1 292.
[8]GAO Q H,WU C S,WANG M.The jujube(Ziziphus Jujuba Mill.)fruit:a review of current knowledge of fruit composition and health benefits[J].Journal of Agricultural and Food Chemistry,2013,61:3 351 -3 363.
[9]González-Gallego J,García-Mediavilla M V,Sánchez-Campos S,et al.Fruit polyphenols,immunity and inflammation[J].British Journal of Nutrition,2010,104:S15 - S27.
[10]Rubió L,Motilva M J,Romero M P.Recent advances in biologically active compounds in herbs and spices:a review of the most effective antioxidant and anti-inflammatory active principles[J].Critical reviews in food science and nutrition,2013,53(9):943 -953.
[11]Khurana S,Venkataraman K,Hollingsworth A,et al.Polyphenols:benefits to the cardiovascular system in health and in aging[J].Nutrients,2013,5:3 779 -3 827.
[12]向进乐,李志西,李欢,等.枳椇果梗不同极性多酚及抗氧化活性研究[J].食品科学,2011,32(15):25-29.
[13]牛鹏飞,仇农学,杜寅.苹果渣中不同极性多酚的分离及体外抗氧化活性研究[J].农业工程学报,2008,24(3):238-242.
[14]张粹兰,张名位,廖森泰,等.荔枝果肉不同极性多酚提取及其抗氧化活性比较[J].华南师范大学学报:自然科学版,2011(4):116-120.
[15]潘乔丹,黄元河,杜清华,等.核桃根和枝不同极性成分的抗氧化活性[J].江苏农业科学,2013,41(10):262-264.
[16]杨龙,刁文超,王成荣.西兰花多酚纯化、不同极性组分分离及其抗氧化活性研究[J].中国食品学报,2013,13(4):33 -42.
[17]Hinneburg I,Dorman H,Hiltunen R.Antioxidant activities of extracts from selected culinary herbs and spices[J].Food Chemistry,2006,97:122 -129.
[18]Benzie I F,Strain J J.The ferric reducing ability of plasma as a measure of“antioxidant power”:the FRAP assay[J].Anal Biochem,1996,239:70 -76.
[19]Atoui A K,Mansouri A,Boskou G,et al.Tea and herbal infusions:Their antioxidant activity and phenolic profile[J].Food Chemistry,2005,89:27 -36.
[20]Nandita S,Rajini P S.Free radical scavenging activity of an aquenus extract of potato peel[J].Food Chemistry,2004,85:611 -616.

