磷酸化STAT5、FOXP3在急性白血病患者骨髓中的表达及意义
张健,廖建军,吴良银,钱春艳,何凤屏
(粤北人民医院检验科,广东 韶关 512025)
信号转导和转录激活子(signal transducers and activator of transcriptions,STATs)是一类能与靶基因调控区DNA结合的胞质蛋白,有七个成员:STATL-4、STAT5A、STAT5B 和 STAT6,其中 STAT5广泛表达于造血系统。检测白血病细胞内磷酸化STAT5(P-STAT5)的水平,对进一步阐明STAT5异常活化与白血病的关系具有重要意义[1]。叉状头/翅膀状螺旋转录因子(forkhead/winged helixtran scription factor3,FOXP3)是当前公认的调节性T细胞(Treg)特异性标记分子,在肿瘤免疫抑制及逃逸机制中起重要作用,新近研究还发现,FOXP3表达与STAT5的调控有关[2]。本研究采用蛋白磷酸化流式细胞术(flow cytometry,FCM)检测急性白血病(Acute leukemia,AL)患者骨髓中单个核细胞核内表达的P-STAT5和FOXP3水平,探讨两者在发病中的作用及其相关性,为急性白血病的发病机制研究及分子免疫治疗提供可靠依据。
1 材料与方法
1.1 研究对象 2013年4月至2014年3月广东粤北人民医院血液内科45例急性白血病患者(AL),其中急性髓系白血病(AML)29例,急性淋巴细胞白血病(ALL)16例,患者年龄17~70岁,平均43.2岁,男性21例,女性24例。所有急性白血病患者化疗前经骨髓穿刺病理检查结合FCM免疫表型分析证实,诊断均符合张之南主编的《血液病诊断及疗效标准》之国内诊疗标准[3]。对照组12名,男6例,女6例,年龄18~67岁,平均42.5岁,均无血液系统和免疫系统疾病。
1.2 试剂和仪器 FITC标记的抗人CD4抗体,APC标记的抗人CD25抗体,PE标记鼠抗人PY(694)STAT5单抗及其各自同型对照购自美国BD公司。PE标记的抗人FOXP3抗体及同型对照购自美国eBioscience公司。Perfix-p试剂盒(含配套的固定、溶血和透膜剂),美国贝克曼公司。人淋巴细胞分离液,上海华精高科技有限公司。流式细胞仪(BD FACSCalibur)为美国BD公司产品。
1.3 方法 肝素抗凝管采集骨髓液2ml,用淋巴细胞分离液提取骨髓单个核细胞,调整细胞密度至1×107/ml。各取骨髓单个核细胞悬液50μl于标本试管中,加入50μl固定液(Fix buffer),振荡摇匀后,室温孵育10min。加入500μl Lysis solution,充分混匀后,37℃水浴箱孵育15min,待红细胞完全裂解。加入1ml冷的洗涤液(PBS,2~6℃),离心(2000r/min,4min)弃上清后加入1ml90%甲醇冰上破膜30min,离心倒掉上清,加入100μl冷的PBS重悬细胞。胞内抗体与膜表面抗体一起孵育,STAT5实验管加入鼠抗人PE-CY7 STAT5,对照管加入PE-CY7 MS IGG1各20μl。FOXP3实验管加入鼠抗人FITC标记的抗人CD4抗体,APC标记的抗人CD25抗体,PE标记的抗人FOXP3抗体,对照管加入FITC标记小鼠IgG2a、APC标记小鼠IgG2a、PE标记小鼠IgG2a单抗各 20μl,孵育 30min后洗涤,离心弃上清,加入 Resuspend buffer 500μl,上机FCM 检测,每管收集10000个细胞,记录阳性细胞百分率。
1.4 统计学处理 采用SPSS15.0统计软件进行分析,对正态分布的数据以(±s)表示;两组计量均数比较用独立样本t检验,部分计量资料相关性分析采用单因素线性相关分析。各数据统计分析均以P<0.05为差异有统计学意义。
2 结果
2.1 急性白血病各组及对照组P-STAT5、FOXP3的表达水平 AL患者组骨髓单个核细胞P-STAT5表达(2.35±0.82)%较对照组(0.58±0.16)%增高,差异具有统计学意义(P<0.05);AL患者组 Foxp3(3.98±1.17)%高于对照组(0.96±0.45)%,差异具有统计学意义(P<0.05)%;AML组P-STAT5及FOXP3水平(2.51±0.91)%,(3.72±1.12)%和 ALL组 P-STAT5及FOXP3水平 (2.27±0.78)%,(4.03±1.18)%比较无显著差异(P>0.05)。见表1。
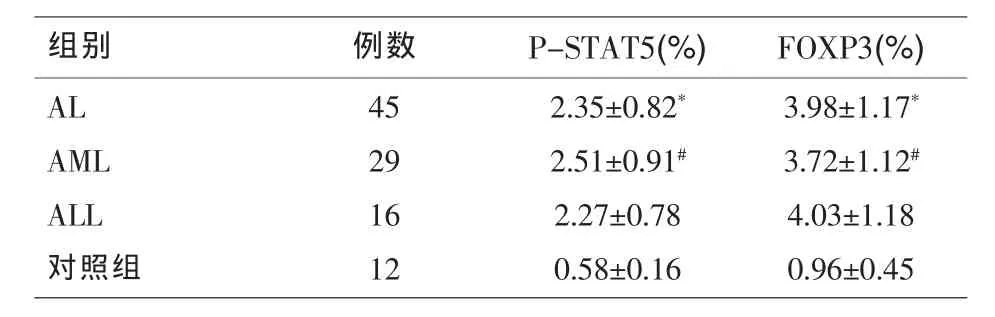
表1 各组P-STAT5、FOXP3的表达水平
2.2 急性白血病组P-STAT5与FOXP3相关性分析 线性相关性分析结果表明,AL患者P-STAT5及FOXP3水平显著正相关(r=0.81,P<0.05)。
3 讨论
急性白血病发病机制至今仍未完全明了,目前认为,造血细胞增殖、分化异常及机体抗肿瘤免疫功能受抑制,在疾病的发生、发展过程中起重要作用。STAT家族与JAK家族构成重要的JAKSTAT信号传导途径,在STAT家族中,STAT5由于在调节细胞增殖、分化及癌症相关信号途径中发挥重要的作用而引起了广泛的关注。STAT5与白血病关系密切,Heuser等[4]的研究表明,STAT5信号传导途径在白血病干细胞的自我更新中起一定作用;Lewis[5]等认为STAT5可能是白血病及骨髓增殖性疾病诊断的标志分子及治疗靶点;能够抑制STAT5活化的因子可能在预防和治疗癌症方面有作用[6]。目前与STAT5相关的主要研究在动物模型、培养细胞或基因水平较多[1,7],而STAT5被磷酸化激活后形成磷酸化STAT5(P-STAT5)进入细胞核调控靶基因表达的机理,仍在进一步研究当中[8]。我们应用蛋白磷酸化流式细胞术检测急性白血病患者骨髓中单个核细胞核内表达的P-STAT5,观察到AL患者组骨髓单个核细胞P-STAT5表达较对照组增高,差异具有统计学意义。国外Ikezoe等[9]发现P-STAT5在 AML患者CD34+CD38-细胞的表达高于CD34+CD38+细胞,国内刘炳楠等[10]在骨髓增生异常综合征(MDS)患者骨髓细胞内同样发现与增殖有关的P-STAT5增高,我们的结果与他们的发现相近且可相互补充,完善了在P-STAT5在恶性血液病方面研究的实验数据。
FOXP3又称叉状头/翅膀状螺旋转录因子,是新发现的调节性T细胞(Treg)特异性分子标记,作为一种转录抑制因子,FOXP3决定了Treg细胞的免疫抑制功能[11]。近年来大量研究认为白血病的发病与肿瘤的免疫逃逸有关,在慢性白血病中FOXP3阳性Treg细胞数明显高于正常人[12],吴小建等[13]发现骨髓增生异常综合征进展与FOXP3表达水平密切相关。我们在急性白血病骨髓细胞发现FOXP3表达水平明显高于对照组,差异具有统计学意义,进一步证实FOXP3水平的升高,导致机体抗肿瘤免疫功能降低,可能是急性白血病发生发展的重要因素。同时我们还观察到AML和ALL两组P-STAT5和FOXP3水平比较无显著差异,提示AML、ALL发病在信号转导、转录和免疫逃逸机制方面可能具有一定的同质性。
新近研究发现,STAT5在Treg的发育、增殖及转录因子FOXP3表达等方面均发挥重要作用,STAT5蛋白的活化对转录因子FOXP3的表达与调控起到关键作用,其机制可能是多种信号分子以Treg的特异性物质FOXP3为目标,通过STAT蛋白引发FOXP3表达,从而促使了在胸腺和外周Treg的存在[2,14,15]。尽管以往的诸多研究对PSTAT5蛋白和FOXP3的表达及其在白血病致病过程中的作用进行了大量探索,并且得到了较一致的观察结果,但将两者结合在白血病患者骨髓细胞上同时检测并进行相关性分析的报道尚未见到。目前,蛋白磷酸化流式细胞分析技术的应用为揭示病理的信号通路提供了一种可靠的方法[16,17]。随着磷酸化抗体和特异性单抗的出现,流式细胞术检测细胞内信号通路磷酸化蛋白技术的发展,可以更好的在蛋白水平对P-STAT5和FOXP3进行单细胞的水平研究,我们的结果显示,AL患者P-STAT5及FOXP3水平显著正相关(P<0.05),初步可以推测两者可能共同参与了该病的发生过程。
[1]Tam WF,Hahnel PS,Schuler A,et al.STAT5 is crucial to maintain leukemic stem cells in acute myelogenous leukemias induced by MOZ-TIF2[J].Cancer Res,2013,73(1):373-84.
[2]Ogawa C,Tone Y,Tsuda M,et al.TGF-beta-mediated Foxp3 gene expression is cooperatively regulated by Stat5,Creb,and AP-1 through CNS2[J].JImmunol,2014,192(1):475-83.
[3]张之南,沈悌.血液病诊断及疗效判断标准[M].北京:科学出版社,2007:103-105.
[4]Heuser M,Sly LM,Argiropoulos B,et al.Modeling the functional heterogeneity of leukemia stem cells:role of STAT5 in leukemia stem cell self-renewal[J].Blood,2009,114(19):3983-3993.
[5]Lewis RS,Ward AC.Stat5 as a diagnostic marker for leukemia[J].Expert Rev Mol Diagn,2008,8(1):73-82.
[6]Chien CM,Yang SH,Lin KL,et al.Novel indoloquinoline derivative,IQDMA,suppresses STAT5 phosphorylation and induces apoptosis in HL-60 cells[J].Chem Biol Interact,2008,176(1):40-47.
[7]Nishioka C,Ikezoe T,Yang J,et al.CD82 regulates STAT5/IL-10 and supports survival of acute myelogenous leukemia cells[J].Int J Cancer,2014,134(1):55-64.
[8]杨磊,韩曜平,顾志良.Stat5及JAK-Stat5通路 [J].生命科学,2012,24(07):680-685.
[9]Ikezoe T,Yang J,Nishioka C,et al.Inhibition of signal transducer and activator of transcription 5 by the inhibitor of janus kinases stimulates dormant human leukemia CD34+/CD38-cells and sensitizes them to antileukemia agents[J].Int J Cancer,2011,128(10):2317-2325.
[10]Liu BN,Fu R,Wang HQ,et al.STAT5 phosphorylation in CD34(+)CD38(-)CD123(+)bone marrow cells of the patients with myelodysplastic syndrome[J].Zhonghua Xue Ye Xue Za Zhi,2012,33(6):480-483.
[11]吴琼,李洁,方江春,等.CD4+CD25+Foxp3+/CD4+CD25+检测在急性髓系白血病中的应用 [J].实验与检验医学,2014,32(3):246-248,251.
[12]Rojas JM,Wang L,Owen S,et al.Naturally occurring CD4+CD25+FOXP3+T-regulatory cells are increased in chronic myeloid leukemia patients not in complete cytogenetic remission and can be immunosuppressive[J].Exp Hematol,2010,38(12):1209-1218.
[13]吴小建,黄芳媚,王勇.骨髓增生异常综合征患者CD4+CD25+调节性T细胞、调控基因FOXP3的表达及意义 [J].实用临床医学,2010,11(1):5-7,10.
[14]Chen Q,Kim YC,Laurence A,et al.IL-2 controls the stability of Foxp3 expression in TGF-beta-induced Foxp3+T cells in vivo[J].J Immunol,2011,186(11):6329-6337.
[15]Elias KM,Laurence A,Davidson TS,et al.Retinoic acid inhibits Th17 polarization and enhances FoxP3 expression through a Stat-3/Stat-5 independent signaling pathway[J].Blood,2008,111(3):1013-1020.
[16]李华梅,曾意茹,陈福雄,等.磷酸特异化流式细胞术检测骨髓白血病细胞磷酸化信号蛋白的实验研究[J].中国实验血液学杂志,2011,19(5):1176-1179.
[17]Blix ES,Irish JM,Husebekk A,et al.Phospho-specific flow cytometry identifies aberrant signaling in indolent B-cell lymphoma[J].BMCCancer,2012,12:478.

