氟喹诺酮类抗菌药物的药动学/药效学研究进展
刘倩,张晶,林立敏,2,卢克鹏,2,刘至红,宋洪涛#(.南京军区福州总医院药学科,福州 350025;2.沈阳药科大学药学院,沈阳 006)
氟喹诺酮类是在喹诺酮结构的基础上,6位引入氟原子、7位引入哌嗪环或其他衍生物后形成的新一代喹诺酮类药。该类药自出现以来,发展非常迅速,目前已发展到第四代。氟喹诺酮类抗菌药物抗菌谱广、抗菌活性强,通过与细菌DNA促旋酶、拓扑酶发生交互作用,影响DNA的合成而起到杀菌作用,对多种病原微生物和耐药菌株均具有良好的杀灭效果,在临床方面应用广泛。
1 喹诺酮类药的药动学/药效学(PK/PD)特征
大多数氟喹诺酮类药有良好的PK/PD特征:口服吸收好,生物利用度大约在吉米沙星的70%和左氧氟沙星的99%之间[1];口服吸收迅速,在1~2 h内达到峰浓度;与食物一起摄入能使氟喹诺酮类药的吸收延迟,但不影响其生物利用度和药-时曲线下面积(AUC)值[2],这一特性有利于其静脉-口服的序贯治疗,降低医疗费用;组织渗透性良好,组织和体液浓度常超过血清浓度,药物表观分布容积一般在1~7 kg/L之间,蛋白结合率在5%~73%之间[3]。
根据抗菌药物的杀菌作用特性,氟喹诺酮类药属于浓度依赖性抗菌药物,即药物的杀菌活力随药物浓度的增高而增加,其主要的PK/PD参数为峰浓度(cmax)/最低抑菌浓度(MIC)和AUC/MIC,此比值大小与该类药治疗感染的疗效、细菌的清除和防止细菌耐药性产生均密切相关。一般认为,氟喹诺酮类药的cmax/MIC达8~10时,可获得良好的临床和细菌学疗效,并可减少细菌对该类药物耐药性的产生。氟喹诺酮类药的抗菌活性存在菌种的特异性,如AUC/MIC对革兰阴性菌为100~125时可取得良好的疗效,对革兰阳性菌则为30~40。
最近有研究显示:氟喹诺酮类药对革兰阴性菌达到AUC/MIC 100~125的能力正在下降。Crandon JL等[4]通过研究来自美罗培南敏感性检测机构报道的MIC数据、Forrest等报道的环丙沙星的PK数据及Rebuck等报道的左氧氟沙星的PK数据计算累积响应分数(累积响应分数即达到特定AUC/MIC值的概率,Crandon JL将AUC/MIC值设为125),发现自2002年至2006年,左氧氟沙星及环丙沙星治疗大肠杆菌和肺炎克雷伯菌的累积响应分数逐年下降,而且环丙沙星的剂量从400 mg、q12h提高到400 mg、q8h,其累积响应分数并没有明显提高。这也许能说明微生物耐药性越来越严重,目前被推荐的给药剂量达不到PK/PD目标值。对于如何减少细菌对喹诺酮类药的耐药性,研究者持有多种观点。一种是使用其他抗菌药物,然而其他抗菌药物也有自身的缺点,如氨基糖苷类药因为其肾毒性、耳毒性受限。另一种观点是提高氟喹诺酮类药的剂量,然而提高剂量的同时也增加了发生不良反应的几率,尤其是对Q-T间期的延长作用。第三种观点是使用外排泵抑制剂,因为细胞膜外排泵功能的增强是氟喹诺酮类耐药性产生的重要机制[5],外排泵抑制剂可以降低外排泵对药物的泵出功能,从而降低其耐药性。外排泵抑制剂PAβN可以增强左氧氟沙星、环丙沙星对耐药的铜绿假单胞菌的抗菌活性[6-7]。利血平可抑制肠球菌耐药泵,增加环丙沙星对肠球菌的活性[8]。第四种观点是使用新型敏感的氟喹诺酮类药,如加替沙星、贝西沙星、莫西沙星等。新型品种与DNA拓扑异构酶亲和力更强,从而有更好的抗菌活性。
在一项环丙沙星治疗慢性阻塞性肺疾病的研究中发现,只有当MIC为0.125 μg/ml时,才能保证所有患者的血药浓度AUC/MIC达到目标值;当MIC为0.25 μg/ml时,有76%的患者达到目标值;当MIC为1 μg/ml时,达到目标值的患者数为0[9]。其他的研究也得到了类似的结果。在一项烧伤患者的研究中,当MIC为0.25 μg/ml时,只有63%的患者达到AUC/MIC目标值125[10]。在另一项环丙沙星治疗铜绿假单胞菌感染的研究中,当MIC为0.25 μg/ml和1 μg/ml时,达到目标AUC/MIC的概率分别为0.77和0[11]。因此,虽然环丙沙星被推荐的剂量为400 mg、q8h,但这只适用于MIC<0.25 μg/ml的微生物,对于铜绿假单胞菌等MIC较高的微生物来说,联合用药也许是最好的选择。Kontou P等[12]对莫西沙星和左氧氟沙星的研究发现,当MIC≤0.79 mg/L时,AUC/MIC对革兰阳性菌达到30~40;当MIC≤0.32 mg/L时,AUC/MIC对革兰阴性菌达到100~125。而对于左氧氟沙星这两项值略高(革兰阳性菌MIC为1.1 mg/L,革兰阴性菌MIC为0.38 mg/L)。值得注意的是,革兰阴性菌的MIC临界值低于欧洲药敏试验联合委员会公布的敏感折点。这项发现有重大的临床意义,因为当氟喹诺酮类药用于治疗某些有着较高MIC但实验室检测仍敏感的微生物时存在治疗失败的风险。
2 氟喹诺酮类药的抗生素后效应(PAE)
PAE指细菌与抗菌药物短暂接触后,当药物浓度降低至MIC以下或消除后,细菌生长仍受到抑制的效应。在对氟喹诺酮类药体外PAE研究发现,随着药物浓度的增加,PAE均有增加的趋势,在4倍MIC时,PAE明显延长,详见表1[13]、表2(表中“-”表示无此数据)[14]。氟喹诺酮类药虽然有很强的浓度依赖性,但过高的浓度并不能使PAE不断增加。有研究显示,环丙沙星在8 MIC、16 MIC两个药物浓度下对肺炎克雷伯菌的PAE分别为(6.6±1.3)、(7.2±1.5)h,对绿脓杆菌的PAE分别为(7.8±0.8)、(8.5±0.6)h[15]。
因此,在保证氟喹诺酮类药的体内最高有效血药浓度不超过最低中毒浓度的前提下,应尽可能提高血药浓度,反映在临床上就是提高单次给药剂量。同时,由于PAE的增加,可以相应延长给药间隔、减少给药次数,以提高疗效,减少用药量,减轻患者的经济负担。但是,当超过一定限度继续增加药量时,PAE不再延长,反而会增加药物毒副反应,给患者造成不必要的伤害。
表1 3种氟喹诺酮类药对粪肠球菌的PAE(,n=50)
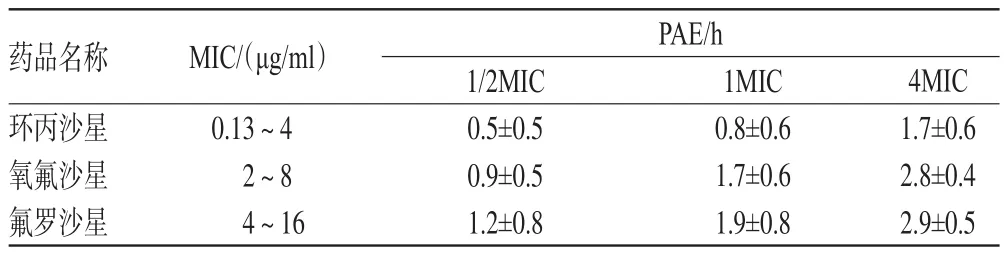
表1 3种氟喹诺酮类药对粪肠球菌的PAE(,n=50)
药品名称环丙沙星氧氟沙星氟罗沙星PAE/h MIC/(μg/ml)0.13~42~84~164MIC 1.7±0.62.8±0.42.9±0.51/2MIC 0.5±0.50.9±0.51.2±0.81MIC 0.8±0.61.7±0.61.9±0.8
表2 5种氟喹诺酮类药对铜绿假单胞菌的PAE(,n=50)
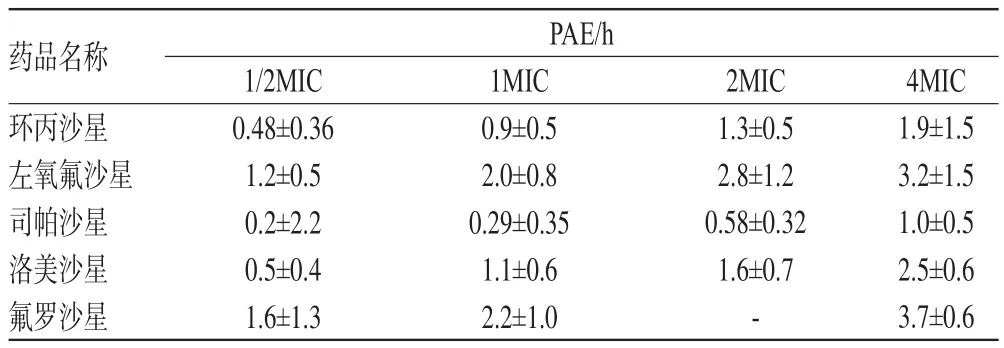
表2 5种氟喹诺酮类药对铜绿假单胞菌的PAE(,n=50)
药品名称环丙沙星左氧氟沙星司帕沙星洛美沙星氟罗沙星PAE/h 1/2MIC 0.48±0.361.2±0.50.2±2.20.5±0.41.6±1.31MIC 0.9±0.52.0±0.80.29±0.351.1±0.62.2±1.02MIC 1.3±0.52.8±1.20.58±0.321.6±0.7-4MIC 1.9±1.53.2±1.51.0±0.52.5±0.63.7±0.6
3 氟喹诺酮类药的突变选择窗(MSW)
突变浓度(MPC)是指防止耐药突变株被选择性富集所需的最低抗菌药物浓度,代表一个严格限制耐药突变株选择的抗菌药物浓度阈值[16]。也就是说,当抗菌药物浓度在MPC以上时,敏感菌株和耐药菌株生长都会受抑制或被杀灭。Olofsson SK等[17]研究大肠埃希菌对环丙沙星的耐药选择情况发现,对于野生菌株,AUC/MPC和选择性富集非常相关,当AUC/MPC≥22时可有效防止耐药菌株选择性富集。Homma T等[18]研究肺炎链球菌对莫西沙星耐药性的选择情况得到了与Olofsson SK相似的结论,即当AUC/MPC>13.4或cmax/MPC>1.2时,不会有耐药性选择的发生,但当上述两个值分别小于0.84和0.08时,将产生耐药菌株富集。因此,基于AUC/MPC和cmax/MPC的PK/PD参数更有利于预防耐药菌株的产生。
MPC与MIC之间的浓度范围即为MSW。如果抗菌药物的浓度位于MSW范围内,耐药突变菌株可被选择性富集扩增。MSW越宽,越易出现细菌耐药,因此关闭或缩小MSW将有助于防止耐药产生。荆靓艳等[19]采用标准琼脂平板稀释法测定了6种喹诺酮类药对金黄色葡萄球菌的MIC、MPC(见表3)。由表3可知,莫西沙星、卡德沙星和加替沙星对金黄色葡萄球菌的MPC较低,MSW范围较窄,抑制耐药菌株能力强;莫西沙星和卡德沙星的血cmax明显高于MPC,服药期间血药浓度易超出MSW,不易产生耐药菌;环丙沙星和左氧氟沙星的MPC值远远高于血cmax,MSW范围较宽,其在预防耐药菌的产生方面不具优势。

表3 6种喹诺酮类药对金黄色葡萄球菌的MIC、MPC
4 MSW理论的应用
MPC治疗策略关键是使药物浓度达到MSW的上限并保持在MSW以上。如在对42株环丙沙星敏感的金黄色葡萄球菌的研究中,莫西沙星的血cmax是MPC90的9倍,其半衰期(t1/2)为12 h(400 mg/d,给药1次),在整个给药期间血cmax均高于MPC90;加替沙星的血cmax是MPC90的6.06倍,其t1/2为7.56 h,整个给药期间血cmax亦均高于MPC90,因此单药治疗即可获得良好的临床疗效[20]。
对于大多数药物来说,要么血浆或组织浓度很难超过MPC,要么该浓度会引起严重的毒性反应,这种情况下不适宜单药治疗。MSW理论认为,当两种作用机制不同的抗菌药物同时处于各自MIC之上时,细菌只有发生两种耐药突变才能生长,因此联合用药大大提高了疗效。郭蓓宁等[21]对临床分离的25珠肺炎链球菌进行MPC测定并结合PK参数,认为莫西沙星400 mg、qd+左氧氟沙星500 mg、qd的给药方案有望防止肺炎链球菌突变。
5 几种常用的氟喹诺酮类药
5.1 莫西沙星
莫西沙星属于8-甲氧基取代氟喹诺酮类药,是第四代氟喹诺酮类药中抗菌活性最强的成员之一。由于分子结构的改进,使其可同时干扰拓扑异构酶Ⅱ和拓扑异构酶Ⅳ,这不仅保留了对革兰阴性菌良好的杀菌活性,同时对革兰阳性菌的杀菌活性也得到显著增强。莫西沙星对无论是否耐青霉素及大环内酯类药的肺炎链球菌都有良好的抗菌活性,对耐氟喹诺酮类药的肺炎链球菌的敏感性较其他氟喹诺酮类药高8~32倍。其抗菌谱几乎覆盖了大部分呼吸道感染的主要致病菌。该药的PK特征良好、口服吸收迅速,绝对生物利用度总计约90%;与血浆蛋白结合率为50%,在组织体液中分布广泛,能迅速渗透入组织,尤其是肺泡巨噬细胞、支气管黏膜及分泌物中,具有较强的杀菌作用。因此,莫西沙星是临床上治疗呼吸系统感染的一线药物。曾春芳[22]对比莫西沙星和左氧氟沙星治疗下呼吸道感染时发现,莫西沙星治疗组在临床疗效及细菌清除率方面均优于左氧氟沙星组。侯刚等[23]对比莫西沙星和头孢呋辛联合阿奇霉素治疗成人支原体肺炎时发现,莫西沙星组与头孢呋辛联合阿奇霉素组有效性相当,但莫西沙星组72 h退热率优于对照组,平均退热时间短于对照组。
5.2 加替沙星
加替沙星属于8-甲氧基氟喹诺酮类外消旋体化合物,为第四代氟喹诺酮类药。该药对金黄色葡萄球菌(仅限于对甲氧西林敏感的菌株)、肺炎链球菌(对青霉素敏感的菌株)、大肠杆菌、流感和副流感嗜血杆菌、肺炎克雷伯杆菌、卡他莫拉菌、淋病奈瑟菌、奇异变形杆菌等均具有良好的杀菌活性。加替沙星口服吸收良好,并且不受饮食因素影响,绝对生物利用度约96%,蛋白结合率约20%;在体内代谢极低,主要以原形经肾脏排出,口服本品后48 h时药物原形在尿中的回收率达70%以上。该药主要用于由敏感病原体所致的各种感染性疾病,包括慢性支气管炎急性发作、急性鼻窦炎、社区获得性肺炎、单纯性尿路感染(膀胱炎)和复杂性尿路感染、急性肾盂肾炎、男性淋球菌性尿路炎症或直肠感染、女性淋球菌性宫颈感染。赖木乔等[24]对比加替沙星和左氧氟沙星治疗下呼吸道感染,结果加替沙星治愈率达90.63%,细菌清除率达96.88%,明显优于左氧氟沙星。徐冠雄等[25]分别采用加替沙星和头孢哌酮钠治疗尿路感染,结果加替沙星组总有效率为98.36%,高于头孢哌酮钠组的88.52%;前者不良反应发生率为3.25%,后者为13.11%。喹诺酮类药易引起血糖代谢紊乱,包括高血糖和低血糖,其中以加替沙星最为显著。2006年2月,美国食品和药物管理局(FDA)要求在产品的说明书中加入相关警告。生产企业在警告中提示:加替沙星不应该用于糖尿病患者,且老年人和肾功能不全的患者使用该产品更易引起血糖异常。目前虽不能完全了解其作用机制,但动物实验表明加替沙星不仅可以促进胰岛素释放,并通过阻断胰岛细胞ATP敏感的钾离子通道使患者出现血糖过低,而且可以使胰岛β细胞空泡化,降低胰岛素水平,而使血糖升高。
5.3 吉米沙星
吉米沙星是氟喹诺酮在C7位吡咯烷取代衍生物。本品对肺炎链球菌的抗菌活性为环丙沙星的30~60倍、左氧氟沙星的15~30倍,对金黄葡萄球菌的抗菌活性为环丙沙星的30倍,对化脓性链球菌、流感嗜血杆菌、卡他莫拉菌、大肠埃希菌、肺炎克雷伯菌等均具有良好的活性。吉米沙星口服在肠道内完全吸收,在体内分布广泛,易进入痰液或炎症体液,部分在肝代谢,25%~40%以原形由尿液中排出。张强[26]通过对泌尿系统反复感染患者的研究发现,吉米沙星治疗泌尿系统反复感染的疗效与左氧氟沙星相当,但细菌清除率明显较左氧氟沙星高。
5.4 芦氟沙星
芦氟沙星在上市的氟喹诺酮类药中作用时间最长,t1/2为57.9 h,给药96~108 h后尿中含药浓度仍然≥10 mg/L,高于一般尿路感染致病菌的MIC,且其代谢物有抗菌活性。所以,芦氟沙星大多用于尿路感染治疗,给药方案为每日1次。
6 结语
喹诺酮类药在临床上防治感染性疾病方面具有十分重要的意义。医药工作者应不断地加快相关研究,加强实践与理论的结合,既要合理地使用这类药,使之发挥最大的药效,又要保证将其引起的不良反应降至最低,从而真正为患者带来安全、可靠的福音。
[1]Fish DN,Chow AT.The clinical pharmacikinetics of levofloxacin[J].Clin Pharmacokinet,1997,32(2):101-119.
[2]陈雪华,何礼贤.氟喹诺酮类药物的药动学和药效学[J].中华医学信息导报,2004,19(10):20.
[3]Zhanel GG,Ennis K,Vercaigne L,et al.A critical review of the fluoroquinolones:focus on respiratory tract infections[J].Drugs,2002,62(1):13-59.
[4]Crandon JL,Kuti JL,Jones RN,et al.Comparison of 2002-2006 OPTAMA programs for US hospitals:focus on gram-negative resistance[J].Ann Pharmacother,2009,43(2):220-227.
[5]罗景慧,刘永刚,杨西晓,等.氟喹诺酮类抗菌药物耐药性与耐药机制的研究进展[J].抗感染药学,2013,10(2):86-91.
[6]Mavroidi A,Miriaqou V,Liakopoulos A,et al.Ciprofloxacin-resistant escherichia coli in central Greece:mechanisms of resistance and molecular identification[J].BMC Infect Dis,2012,12(1):371.
[7]Hassan WM,Hashim A,Domany R.Plasmid mediated quinolone resistance determinants qnr aac(6')-lb-cr,and qepin ESBL-producing escherichia coli clinical isolates form Egypt[J].India J Med Microbiol,2012,30(4):442-447.
[8]闫东辉,许淑珍,苏建荣.肠球菌GyrA基因突变和多重耐药泵与氟喹诺酮耐药性关系研究[J].首都医科大学学报,2012,33(2):162-164.
[9]Kontou P,Chatzika K,Pitsiou G,et al.Pharmacokinetics of ciprofloxacin and its penetration into bronchial secretions of mechanically ventilated patients with chronic obstructive pulmonary disease[J].Antimicrob Agents Che⁃mother,2011,55(9):4149-4153.
[10]Garrelts JC,Jost G,Kowalsky GF,et al.Ciprofloxacin pharmacokinetics in burn patients[J].Antimicrob Agents Chemother,1996,40(5):1153-1156.
[11] Zelenitsky S,Ariano R,HardingG,et al.Evaluating ciprofloxacin dosing for Pseudomonas aeruginosa infection by using clinical outcome-based Monte Carlo simulations[J].Antimicrob Agents Chemother,2005,49(10):4009-4014.
[12] Kontou P,Manika K,Chatzika K,et al.Pharmacokinetics of moxifloxacin and high-dose levofloxacin in severe lower respiratory tract infections[J].Inter J Antimicrob Agents,2013,42(3):262-267.
[13] 张志平,王睿,方翼,等.114种抗菌药物对铜绿假单胞菌的抗生素后效应[J].中国医院药学杂志,1999,19(11):61-65.
[14] 王睿,方翼,陈迁,等.粪肠球菌的抗生素后效应[J].中国医院药学杂志,1999,19(8):31-45.
[15] Tam VH,Kabbara S,Vo G,et al.Comparative pharmacodynamics of gentamicin against Staphylococcus aureus and Pseudomonas aeruginosa[J].Antimicrob Agents Che⁃mother,2006,50(8):26-28.
[16]Zhao Xi-lin,Drlica K.Restricting the selection of antibiotic-resistant mutant bacteria:measurement and potential use of the mutant selection window[J].J Infect Dis,2002,185(4):561-565.
[17] Olofsson SK,Marcusson LL,Komp Lindcren P,et al.Selection of ciprofloxacin resisitance in Escherichia coli in an in vitro kinetic model:relation between drug exposure and mutant prevention concentration[J].J Antimi⁃crob Chemother,2006,57(6):1116-1121.
[18] Homma T,Hori T,Sugimori G,et al.Pharmacodynamic assessment based on mutant prevention concentrations of fluoroquinolones to prevent the emergence of resistant mutants of Streptococcus pneumoniae[J].Antimicrob Agents Chemother,2007,51(11):3810-3815.
[19] 荆靓艳.比较6种氟喹诺酮类药物对金黄色葡萄球菌的防耐药变异浓度[J].中国临床药理学杂志,2011,9(27):11-12.
[20] 崔俊昌,刘又宁,王奋.氟喹诺酮类药物对临床分离金黄色葡萄球菌的防耐药变异浓度[J].中华医院感染学杂志,2005,15(6):611-614.
[21] 郭蓓宁,郁继诚,张菁,等.氟喹诺酮类药物对临床分离肺炎链球菌的防突变浓度[J].中国感染与化疗杂志,2010,10(1):13-16.
[22] 曾春芳.莫西沙星治疗下呼吸道感染临床疗效观察[J].中华全科医学,2012,10(1):36-37.
[23] 侯刚,封辰叶,尹燕,等.莫西沙星治疗成人支原体肺炎的临床疗效分析[J].实用药物与临床,2013,16(2):104-106.
[24] 赖木乔,梁小波,王任之,等.加替沙星与左氧氟沙星治疗急性下呼吸道感染的疗效观察[J].河北医学,2013,12(24):1076-1079.
[25] 徐冠雄.加替沙星和头孢哌酮对尿路感染疗效的对比分析[J].吉林医学,2013,34(27):5639.
[26] 张强.吉米沙星治疗泌尿系反复感染的临床疗效观察[J].中国药师,2010,13(8):1154-1155.

