迷走神经调控肝细胞癌发生发展的相关研究进展
吴黎雳,宦宏波,吴 林,邓 翔,温旭东,夏 锋
(重庆市第三军医大学西南医院全军肝胆外科研究所,重庆,400038)
目前,肝脏肿瘤占全球癌症病死原因的第三位[1-2]。关于影响肝细胞癌(HCC)发生发展因素的研究已经开展了数十年。各种原因引起的肝脏慢性炎症、HBV、HCV感染等是HCC发生的主要危险因素[3]。近年来,随着对肿瘤研究的不断深入,很多研究[4]发现,肿瘤发展不仅仅需要肿瘤组织中血管生成为肿瘤生长提供足够的养分,同时肿瘤微环境中神经末梢生成,形成肿瘤的神经支配[5-6],也是肿瘤发展不可或缺的条件之一。这一观点的提出,使得神经因素成为HCC研究的新方向。
支配肝脏的神经主要包括交感神经肝支和迷走神经肝支。交感神经末梢所释放的递质主要为去甲肾上腺素,是应激反应的主要递质。已有研究[7-9]证明,肝脏中交感神经的存在对于肝脏损伤过程中的炎症反应有促进作用,进而加重肝脏损伤。近年来的研究[10-11]已经表明迷走神经通过“胆碱能抗炎通路”对炎症反应有明确的抑制作用。迷走神经是否能通过抑制肝脏炎症反应进而抑制肝细胞癌的发生和发展,抑或通过其他途径直接或间接对肝细胞癌的发生、侵袭、转移和复发产生影响,还有待进一步的研究予以证明。本文将就近年来对迷走神经调控肝细胞癌的发生发展的研究成果做一综述,为下一步的研究理清思路,提出研究方向。
1 肝脏迷走神经支配
迷走神经为第10对脑神经,是脑神经中最长,分布最广的一对,含有感觉、运动和副交感神经纤维。支配呼吸、消化两个系统的绝大部分器官以及心脏的感觉、运动以及腺体的分泌。迷走神经含有4种纤维成分:①特殊内脏运动纤维;②一般内脏运动纤维;③一般内脏感觉纤维;④一般躯体感觉纤维。
迷走神经于舌咽神经根丝的下方自延髓橄榄的后方出入脑,经颈静脉孔出颅腔,之后下行于颈内、颈总动脉与颈内静脉之间的后方,经胸廓上口入胸腔。左、右迷走神经在胸腔内分别延续为迷走神经前、后干,并向下与食管一起穿过膈的食管裂孔进入腹腔。迷走神经前、后干于贲门附近分别发出胃前支、胃后支、肝支和腹腔支。
迷走神经肝支包含一般内脏运动纤维和一般内脏感觉纤维,行于小网膜内,随肝固有动脉走行,参与形成肝丛,分布至胆道和肝,与肝的分泌活动有关。一般内脏运动纤维末梢释放的递质是乙酰胆碱,其受体是胆碱能受体;而一般内脏感觉纤维末梢释放的递质包括P物质、降钙素基因相关肽和血管活性肠肽[12-13]。目前对迷走神经与肝细胞癌的关系研究也分别主要集中在上述两种神经纤维末梢所释放的递质及其受体上。
2 迷走神经末梢释放的神经递质及相应受体
2.1 迷走神经传出纤维递质-乙酰胆碱
在神经细胞中,乙酰胆碱是由胆碱和乙酰辅酶A在胆碱乙酰移位酶(胆碱乙酰化酶)的催化作用下合成的。由于该酶存在于胞浆中,因此乙酰胆碱在胞浆中合成,合成后由小泡摄取并贮存起来。随着迷走神经兴奋,含有乙酰胆碱的囊泡在迷走神经传出纤维末梢被释放入突触间隙。作用于突触后膜的胆碱能受体而发挥相应的病理生理作用。
乙酰胆碱受体包括毒蕈碱型受体(M受体)和烟碱型受体(N受体)2种。近年来对上述2大类胆碱能受体的研究,更进一步揭示了其分子结构及病理生理功能。为研究乙酰胆碱及其受体对肝细胞癌的影响奠定了基础。
2.1.1 毒蕈碱型胆碱能受体(mAChR)及其作用机制:毒蕈碱型胆碱能受体是一种典型的7次跨膜G蛋白偶联受体,定位在细胞膜上,可分为M1-M5,共5种亚型。根据他们与各个G蛋白家族偶联倾向性的不同,又可分为2个主要的功能类别。M1、M3、M5与 Gq/G11 相偶联,而 M2、M4 与 Gi/Go相偶联。这5种mAChRs在分布模式上也有不同特征。M1、M4、M5主要分布在中枢神经系统中,而M2、M3广泛分布于中枢神经系统及外周组织中。中枢神经内的mAChRs参与调节诸如认知、行为、感觉、活动和自主节律等重要的中枢功能[14-16]。分布于外周的 mAChRs既可以发挥诸如减慢心律、增加胃肠蠕动和腺体分泌等副交感作用,也可以与许多细胞膜内不同亚型G蛋白偶联,激活下游的胞内信号转导分子,如 Ca2+、MAPK、cAMP等,调节细胞的增殖、分化、转移和凋亡(如图1如示)。
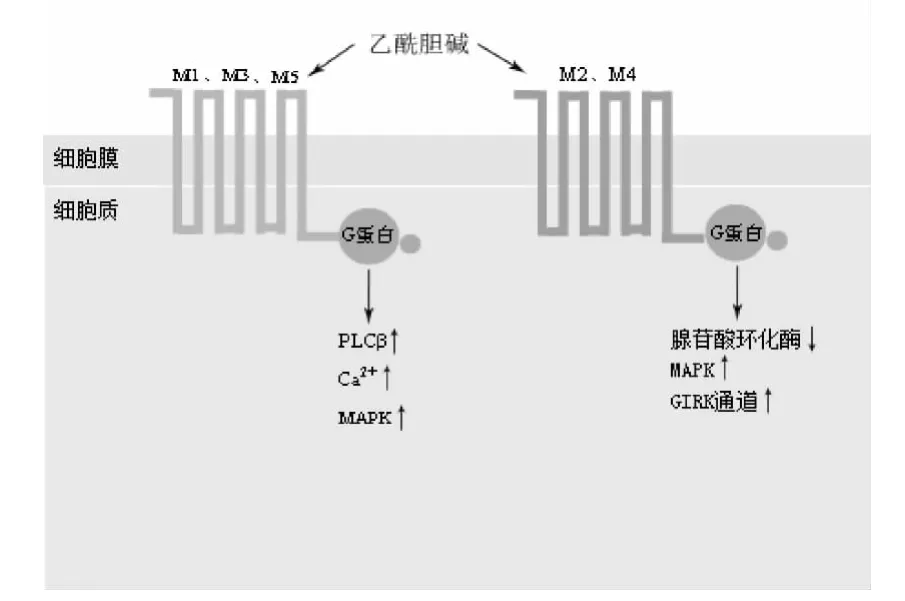
图1 M型胆碱能受体结构示意图
2.1.2 烟碱型胆碱能受体(nAChR)及其作用机制:nAChRs由于其分布的不同可分为神经性nAChRs及肌肉性nAChRs 2大类。目前的研究发现神经性nAChRs共有12个不同亚基(α2-α10 and β2-β4)[17]。5 个 α7、α8、α9 亚基构成同型五聚体,α2-α6、α10 亚基与 β2-β4 亚基,以不同的数量配比构成异型五聚体。肌肉性nAChRs则主要由 α1 亚基与 β1、γ、δ、ε 组成[18]。上述这些不同的五聚体定位在胞膜上,围成一个穿膜的离子通道(如图2所示)。nAChRs与其相应的配体结合后,离子通道开放,阳离子(Na+、K+、Ca2+)进入胞内。阳离子的进入使细胞膜去极化,去极化又使膜上的电压门控钙离子通道开放,导致胞外Ca2+内流使细胞膜进一步去极化。nAChRs和钙离子通道的共同作用,激活一系列不同的反应,包括神经递质、生长因子、血管生成因子和神经营养因子的释放等。胞内的阳离子浓度增加也可以直接激活胞内的信号转导级联放大效应,从而调节细胞增殖、分化、凋亡和转移[19-20]。
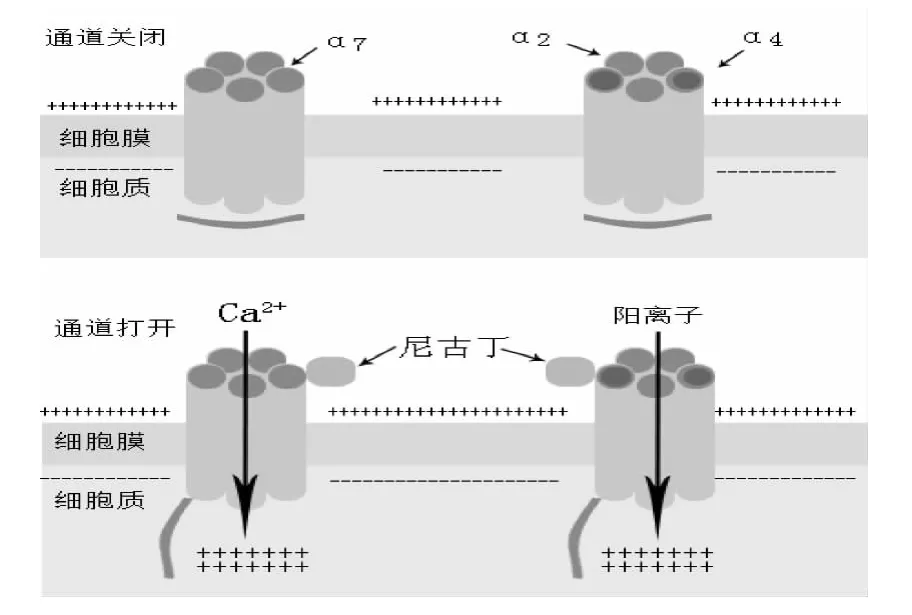
图2 N型胆碱能受体示意图
2.2 迷走神经传入神经纤维递质-P物质
P物质(SP)是一种十一肽,属速激肽家族的一员,可被迷走神经传入神经纤维表达、合成并释放,与神经源性炎症、痛觉和免疫反应的调节有关。SP与速激肽受体(包括NK-1、NK-2、NK-3受体)中的NK-1受体(NK-1R)具有高亲和力,所以NK-1R又称为P物质受体(SPR)。SP与NK-1R结合而发挥相应病理生理学作用。SP对肿瘤的发生和发长具有双向作用。具体表现为:完整的SP促进成瘤和炎症反应,而以脑啡肽酶(NEP)为代表的肽酶水解SP所产生的片段却起着抗炎和抗肿瘤的作用。迷走神经中的C纤维所含有的神经肽可使肽酶表达升高,降解SP以产生SP水解片段,从而发挥抗癌作用。迷走神经切断后,C纤维所含神经肽释放减少使周围细胞组织不能表达肽酶,导致SP水解片段减少。所以这种情况下虽然在肿瘤周围由于自身免症反应而聚集了大量可产生SP和脑啡肽酶的中性粒细胞,但切断迷走神经后,肽酶表达减少,即使SP含量大大增加,也发挥不了抗癌作用,相反还促进了肿瘤生长[21]。
3 迷走神经对脏器实体肿瘤的影响
由于迷走神经分布十分广泛,包括心、肺、乳腺、肝脏、胆囊、胰腺、胃、肠、前列腺等器官在内,均接受迷走神经的支配。所以近年来对相关脏器肿瘤的研究,也陆续发现迷走神经在肿瘤发生发展过程中起着重要的作用。
Magnon,C.等[22]发现,在前列腺癌肿瘤组织中有新生的迷走神经纤维长入,如果抑制肿瘤中迷走神经的生长,那么前列腺癌的侵袭转移能力就会明显下降。表明迷走神经对前列腺癌的侵袭转移具有明显的促进作用。另外,在对乳腺癌的研究中,Nuray Erin 等[21-23]应用塞马莫德腹腔注射和迷走神经切除术,分别兴奋和抑制迷走神经,验证了塞马莫德通过增加迷走神经传入纤维兴奋性,改变肿瘤及其周围的P物质和脑啡肽酶活性水平抑制了肿瘤的转移。Li,X.等[24]还在体外证实了释放P物质的感觉神经纤维为胰腺癌提供了神经侵噬的转移途径。
在很多临床实践中也逐渐发现,社会心理因素对脏器实体肿瘤的发生发展有明显的影响。长期处于精神抑郁或应激状态下的患者,肿瘤发生、转移和复发的几率明显高于心理调适能力强的患者。曾有学者提出这种神经精神因素对肿瘤的调控作用是通过影响免疫系统功能而实现的,但就上述研究成果来看,神经因素也可能直接作用于肿瘤实质细胞或改变肿瘤微环境中的某些因子而调控肿瘤的发生发展。所以今后对脏器实体肿瘤的研究应注意神经调控的影响,这也是与当前生物-心理-社会医学模式相适应的。迷走神经在脏器神经支配中的主要地位,决定了迷走神经调控应成为研究各脏器肿瘤发生发展的重要内容。
4 迷走神经对肝细胞癌的影响
由于迷走神经是支配肝脏的主要神经之一,而且迷走神经传出、传入神经纤维具有上文所叙述到的特性。那么,迷走神经末梢释放的递质及其相应的受体对HCC会产生怎样的影响?目前有一些学者对这个问题进行了初步的探讨。
4.1 乙酰胆碱及相应受体促进HCC发生
Yingjun Zhao等[25]通过对临床 HCC患者术后标本进行免疫组化染色、RT-PCR发现HCC细胞、癌旁肝组织、正常肝组织和人类肝癌细胞系均表达包括胆碱乙酰转移酶(CHAT)、乙酰胆碱脂酶(ACHE)、囊泡乙酰胆碱转运体(VAChT)、nAChRs、mAChRs在内的胆碱能系统主要组分。
同时,研究发现在 HCC中乙酰胆碱脂酶(ACHE)表达明显下降,而其余胆碱能系统组分与其他肝脏组织中的表达相比无明显差异。分别用携带ACHE基因及 ACHE-short hairpin RNA(shRNA)的 lentivirus转染到SMMC-7721及其他HCC细胞系中,分别构建出Lenti-ACHE和 LentishACHE细胞后检测细胞的增殖能力,最终说明了ACHE通过降低胞外ACh水平抑制HCC细胞增殖。同时也就说明了 ACh能够通过激活MAPK/ERK和 PI3K/Akt信号传导通路,介导ERK1/2和Akt磷酸化而促进HCC细胞增殖。但由于“胆碱能抗炎通路”的存在,单凭上述这一发现还不能断定迷走神经传出纤维的总体效应促进了HCC的生长,所以尚需进一步的研究予以证实。
4.2 乙酰胆碱通过雄激素受体促进肝细胞癌袭转移
Nie,H.等[26]利用 RT-PCR 在 19个 HCC 细胞系中检测到α7nAChR、M3mAChR表达。研究还发现ACh可以使SNU-449细胞中的雄激素受体(AR)表达上调,并用MMTV-luc reporter质粒对AR转录活性进行荧光素酶分析,表明ACh激活了AR的转录。在表达AR的细胞中通过lentiviral系统导入抗AR的shRNA以下调AR表达,而在不表达AR的细胞中用lentiviral过表达系统使ARneg细胞变为ARpos细胞,并分别用ACh及其拮抗剂处理细胞后发现,ACh能明显增强ARposHCC细胞的转移、侵袭能力。
这一发现初步解释了HCC发生率男性明显高于女性的现象。但是在对胆碱能受体的研究中,有学者发现α4β2nAChR和α7nAChR分别可以促进抑制性神经递质γ-氨基丁酸(GABA)和兴奋性神经递质多巴胺释放,GABA与多巴胺分别具有抑制和促进肿瘤发生发展的功能,而雌激素可以通过某种尚不清楚的机制使α4β2nAChR脱敏失活而导致GABA释放减少,不能抑制女性患者肿瘤的发生发展[6]。所以迷走神经对HCC侵袭转移和性别发生差异的影响也尚不能下定论。
4.3 P物质与NK-1受体结合促进HCC血管生成
J C Reubi等[27]利用核素示踪技术在大样本HCC病例标本中检测到P物质主要分布在大于100μm的肿瘤血管上。所以认为P物质对肿瘤中血管生成起作用,而对于HCC的发生和发展并没有直接效应。NK-1受体在肿瘤大血管中的上调,促进了肿瘤血管生成,并且通过调节肿瘤中的血流调控肿瘤的病理生理过程。
综上所述,目前的体外实验认为,无论是迷走神经传出纤维末梢释放的乙酰胆碱,还是迷走神经传入纤维末梢释放的P物质,均可以与相应受体结合产生促进HCC发生发展的作用。而针对这些递质和受体的拮抗剂均具有抑制HCC的效果。所以很多学者提出以迷走神经末梢释放的递质及相应受体作为HCC治疗的靶点。
5 展望
对于HCC而言,肿瘤组织中新生的迷走神经纤维是否是肿瘤发生和发展的主要影响因素?乙酰胆碱通过与哪种类型的胆碱能受体作用促进HCC的生长和侵袭转移?P物质是否只有通过促进血管生成等改变肿瘤微环境而促进HCC生长的作用?利用胆碱能系统和P物质的抗拮剂是否能有效抑制HCC的发生和发展?对这些问题的研究和解答将会为肿瘤发生发展的多因素理论提供新的证据,也将会为HCC的临床诊疗提供新的思路与方法。
[1]Jemal,A.,F.Bray,M.M.Center,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69.
[2]孙其恺,王伟,荚卫东,表观遗传修饰与肝癌的关系[J].中华消化外科杂志,2013.12(9):717.
[3]Forner,A.,J.M.Llovet,J.Bruix.Hepatocellular carcinoma[J].Lancet,2012.379(9822):1245.
[4]曾永毅,张翔,刘景丰,等.肝癌发生肺转移的危险因素分析[J].中华消化外科杂志,2013.12(9)668.
[5]Wess,J.,R.M.Eglen and D.Gautam,Muscarinic acetylcholine receptors:mutant mice provide new insights for drug development[J].Nat Rev Drug Discov,2007.6(9):721.
[6]Schuller,H.M.Is cancer triggered by altered signaling of nicotinic acetylcholine receptors?[J].Nat Rev Cancer,2009.9(3):195.
[7]曾议,夏锋,田峰,等.交感神经递质NE对内毒素诱导大鼠kupffer细胞 TNF-α/IL-1β表达的影响[J].肝胆外科杂志,2009,(6):458.
[8]曾议,夏锋,田峰,等.不同节段去交感神经对CCl4所致大鼠急性肝损伤的影响[J].中华实验外科杂志,2010,(9):1262.
[9]李果,夏锋,吴林,等.β肾上腺素能受体兴奋对大鼠急性肝损伤的影响[J].第三军医大学学报,2012,34(9):809.
[10]Vijayaraghavan,S.,A.Karami,S.Aeinehband,et al.Regulated Extracellular Choline Acetyltransferase Activity The Plausible Missing Link of the Distant Action of Acetylcholine in the Cholinergic Anti-Inflammatory Pathway[J].PLoS One,2013,8(6):65936.
[11]Lubbers,T.,J.J.De Haan,M.Hadfoune,et al.Lipid-en-riched enteral nutrition controls the inflammatory response in murine Gram-negative sepsis[J].Crit Care Med,2010.38(10):1996.
[12]Coleridge,J.C.and H.M.Coleridge,Afferent vagal C fibre innervation of the lungs and airways and its functional significance[J].Rev Physiol Biochem Pharmacol,1984,99:110.
[13]Dunzendorfer,S.C.J.Wiedermann.Neuropeptides and the immune system:focus on dendritic cells[J].Crit Rev Immunol,2001,21(6):523.
[14]Felder,C.C.,F.P.Bymaster,J.Ward,et al.Therapeutic opportunities for muscarinic receptors in the central nervous system[J].J Med Chem,2000,43(23):4333.
[15]Wein,A.J.Muscarinic acetylcholine receptor knockout mice:novel phenotypes and clinical implications[J].Urol,2005,173(6):2199.
[16]Eglen,R.M.Muscarinic receptor subtype pharmacology and physiology[J].Prog Med Chem,2005,43:105.
[17]O'Neill,M.J.,T.K.Murray,V.Lakics,et al.The role of neuronal nicotinic acetylcholine receptors in acute and chronic neurodegeneration[J].Curr Drug Targets CNS Neurol Disord,2002,1(4):399.
[18]Portugal,G.S.,T.J.Gould.Genetic variability in nicotinic acetylcholine receptors and nicotine addiction:converging evidence from human and animal research[J].Behav Brain Res,2008,193(1):1.
[19]Kunzelmann,K.,Ion channels and cancer[J].Membr Biol,2005,205(3):159.
[20]Roderick,H.L.,S.J.Cook.Ca2+signaling checkpoints in cancer:remodelling Ca2+for cancer cell proliferation and survival[J].Nat Rev Cancer,2008,8(5):361.
[21]Erin,N.,G.Akdas Barkan,J.F.Harms,et al.Vagotomy enhances experimental metastases of 4THMpc breast cancer cells and alters substance P level[J].Regul Pept,2008,151(1/3):35.
[22]Magnon,C.,S.J.Hall,J.Lin,et al.Autonomic nerve development contributes to prostate cancer progression[J].Science,2013,341(6142):1236361.
[23]Erin,N.,O.Duymus,S.Ozturk,et al.Activation of vagus nerve by semapimod alters substance P levels and decreases breast cancer metastasis[J].Regul Pept,2012,179(1/3):101.
[24]Li,X.,G.Ma,Q.Ma,et al.Neurotransmitter substance P mediates pancreatic cancer perineural invasion via NK-1R in cancer cells[J].Mol Cancer Res,2013,11(3):294.
[25]Zhao,Y.,X.Wang,T.Wang,et al.Acetylcholinesterase,a key prognostic predictor for hepatocellular carcinoma,suppresses cell growth and induces chemosensitization[J].Hepatology,2011,53(2):493.
[26]Nie,H.,Q.Cao,L.Zhu,et al.Acetylcholine acts on androgen receptor to promote the migration and invasion but inhibit the apoptosis of human hepatocarcinoma[J].PLoS One,2013,8(4):61678.
[27]Reubi,J.C.,A.Zimmermann,S.Jonas,et al.Regulatory peptide receptors in human hepatocellular carcinomas[J].Gut,1999,45(5):766.

