PIAS-1基因真核表达质粒的构建与鉴定
秦会影,王海琳,刘 钰,张 培
(1.兰州大学第一临床学院妇科,甘肃兰州,73000;2.甘肃省人民医院妇科,甘肃兰州,73000)
RNA干涉(RNAi)由美国科学家Andrew Fire和Craig Mello[1]于1998年正式提出,其原理为利用同源性的双链RNA(dsRNA)诱导序列特异性的目标基因的沉寂,迅速阻断基因活性。siRNA起决定作用,是对特定信使RNA(mRNA)进行降解的指导要素[2-3]。细胞因子是一类能够传递细胞信息,介导和调节免疫、炎症反应的小分子多肽[4],Jak-stat通路是一条重要的介导细胞因子信号转导的通路,在细胞因子信号转导中有决定意义。而Jak-stat在发挥其信号转导的同时也启动了该途径的负反馈性抑制环路,从而调节Jakstat通路动态平衡[5-6]。Stat活化抑制蛋白 PIAS可直接结合并抑制stat蛋白[7],通过影响stat蛋白磷酸化而改变JAK-STAT通路[8]。相关研究表明,多种肿瘤均存在JAK-STAT的异常表达,且和肿瘤的侵袭转移、血管生成、耐药及预后有关。为此,该实验通过以siRNA为工具,以Plko.1作载体,以人源PIAS-1为模板,构建Plko.1-PIAS-1重组质粒,为肿瘤治疗的研究奠定基础。
1 材料和方法
1.1 主要材料与试剂
载体质粒 Plko.1、大肠杆菌DH5a由兰州大学结核病研究中心保存;质粒小提及无内毒素大提试剂盒、胶回收纯化试剂盒、限制性内切酶Age1酶、DNA makerⅣ购自北京天根生化科技有限公司;T4连接酶、限制性内切酶EcoR1酶、T4连接酶、pfu酶、2×Premix酶、6×loading buffer购自大连Takara有限公司;恒温摇床、高压蒸汽锅、湘仪离心机、低温离心机beckman、水浴锅、PCR仪、冰盒。
1.2 方法
1.2.1 引物设计并退火:人源的PIAS-1基因位点为 NM-016166.1,CDs区 97-2052,pLKO.1 质粒酶切位点为AgeⅠ,EcoRⅠ,据siRNA设计原则,载体特点,设计上游引物为5'-CCGGAAGCAAATGGTTATGAGCCTTCTCGAGAAGGCTCATA ACCATTTGCTTTTTTTG-3'下游引物为:5'AATTCAAAAAAAGCAAATGGTTATGAGCCTTCTCGAG AAGGCTCATAACCATTTGCTT-3',由 大 连 Takara有限公司设计并合成。将引物稀释为0.010D/μL,按以下体系将上下游引物退火形成双链即shRNA Oligos,上下游引物各1μL、退火Buffer 1μL、ddH2O 7μL,其中退火 Buffer:10 mM Tris pH 8.0,50 mM NaCl,1 mM EDTA,于94℃5 min,30℃ 90 min然后冷却至室温(约1 h),将冷却后产物置于4℃保存。
1.2.2 质粒扩增及酶切:① 质粒扩增:将质粒转化至过夜的感受态细胞中,提取质粒核酸电泳验证;② 质粒酶切:AgeⅠ及EcoRⅠ分别预酶切,10 ×buffero 2μL,质粒 DNA 1μL,酶(AgeⅠ/EcoRⅠ)1μL,加水补足20μL体系,37℃,4h,均可切开;遂双酶切:质粒 DNA 10μL,AgeⅠ酶和 EcoRⅠ酶各 1μL,10 ×buffero 2μL,加水补足20μL,37℃,4h,核酸电泳显示两条条带即7.000 bp和1.900 bp,双酶切成功,遂使用双酶切进行大量酶切,并将酶切产物胶回收纯化。
1.2.3 重组质粒构建:将 shRNA Oligos及Plko.1酶切产物按以下体系连接:10×T4DNA Ligase buffer 1.5μL,T4DNA Ligase lμL 质粒DNA 酶切产物5.5μL,shRNA Oligos12μL,16 ℃,连接过夜(12~16 h),以siRNA为引物,将连接产物进行 PCR 检测,体系:重组质粒 0.5μL、2 ×Premix酶10μL、上游引物0.5μL、下游引物0.5μL,加水 8.5μL 补足 20μL,94 ℃ 5 min、94℃ 30 s、50℃ 30 s、72℃ 30 s、72℃ 7 min 4℃保存。并送大连Takara测序。
2 结果
质粒pLK 0.1长度为8901 bp,质粒浓度较高,核酸电泳图未见明显杂带,见图1。质粒分别经AGE1和EcoR1酶切,后经琼脂糖凝胶电泳检测到大小约为7000 bp、1900 bp的2个片段,见图2。将引物与重组质粒PCR检测证明pLK 0.1-PIAS-1构建成功,见图3。将重组质粒送大连Takara测序,测序图谱见图4。测序结果与Gen-Bank上公布的基因序列完全一致,经测序验证,成功构建了PIAS-1 siRNA干扰载体Plko.1-PIAS-1,并测序鉴定克隆正确,见图4。

图1 质粒pLK 0.1质粒胶回收纯化
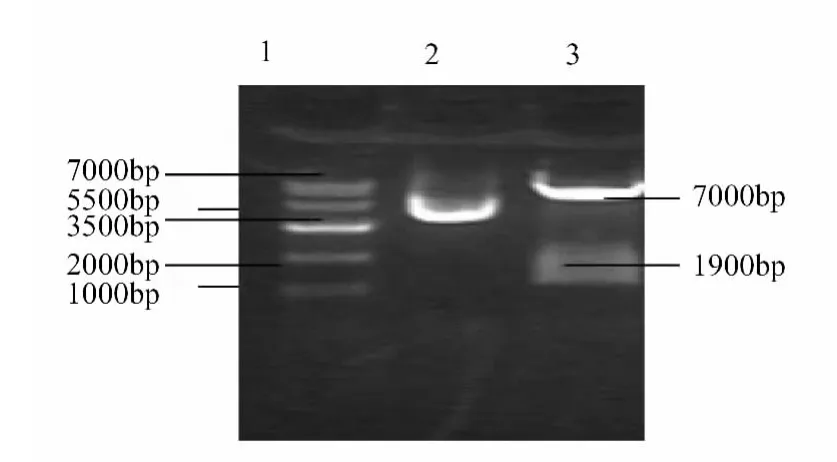
图2 质粒pLK 0.1双酶切图,条带2为正确酶切图
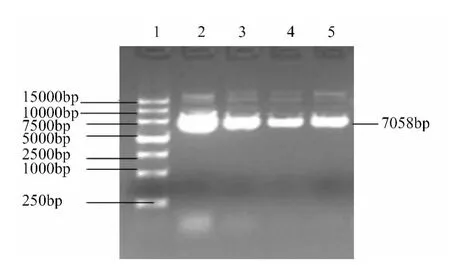
图3 PCR产物图
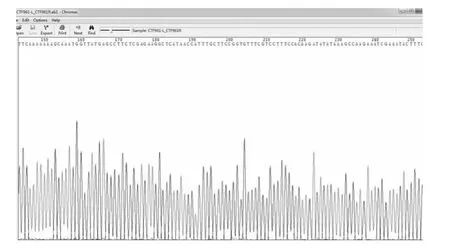
图4 测序截图
3 讨论
宫颈癌是妇科第2大恶性肿瘤,发展中国家发病率呈上升趋势,并且近些年有较明显年轻化趋势。由于女性生育的平均年龄延迟,使宫颈癌患者对治疗后生活质量有了更高要求,特别是要求保留生育功能和内分泌功能;另一方面,中国宫颈癌中晚期患者多,除传统放疗和手术外,还有化疗的治疗。最近越来越多的研究指向在人类癌症中起着关键作用的JAK-STAT通路,不论从分子结构、调控机制还是功能研究均取得了丰硕的成果,该通路对细胞内细胞因子的活动是必需的,其发挥信号转导同时也启动了该途径的负反馈性抑制环路,从而使jak-stat通路的活动得到平衡与控制[9]。JAK-STAT由多种不同途径和机制共同调节,Stat活化抑制蛋白PIASs作为JAK-STAT信号通路的激活抑制因子最近也成为研究的热门。PIASs家族包括PIAS1,PIAS3,PIASx,PIASy[10],在基因转录、细胞信号通路、细胞增殖、细胞分化、细胞凋亡、机体的免疫应答以及肿瘤的发生发展等过程中均发挥重要作用,尽管在序列上具有高度同源性,但不同的家族成员在生物体中的作用不尽相同,PIASs可能含有锌结合基序和高度酸性区,可直接结合并抑制stats蛋白。研究证实,PIASs能专一性结合活化的stat1,并通过直接抑制stat与DNA的结合和转录活性而起作用。PIAS1一方面可通过对STAT1的抑制对机体的炎症及免疫反应起负调节,同时PIAS1还 能提高某些病毒如人乳头瘤病毒、巨细胞病毒的致病性,这一作用是PIAS1通过炎性介质IFNγ等而发挥作用的[13]。大量研究[11-14]表明,STAT1 对肿瘤有抑制作用,已在多种肿瘤组织如乳腺癌、头颈部肿瘤、黑色素瘤、白血病等发现STAT1的活性异常甚至表达缺失,其活化抑制因子PIASs也在相应的肿瘤组织中高表达,如前列腺、子宫颈及子宫内膜等,且与妇科肿瘤的关系也备受关注。因此,该基因有可能成为新治疗靶点来协助肿瘤治疗。PIAS-1是否在宫颈癌细胞株中表达上调,引起化疗药物对宫颈癌细胞的敏感性下降,临床治疗中对PIAS-1上调的患者是否应该加大化疗药物的剂量及化疗药物种类,尚需进一步研究。阻断恶性肿瘤JAK-STAT通路中的负性调节因子,有望在治疗恶性肿瘤中占有一席之地。目前对PIAS-1研究的意义不仅是阐述一种生理现象,更重要的是希望找到肿瘤发生发展的相关机制,找到肿瘤预防和治疗的有效途径。因此,本试验成功构建了PIAS-1的真核表达载Plko.1-PIAS-1,以期为肿瘤的生物治疗及肿瘤细胞JAK-STAT相关机制的研究提供物质基础。本试验根据PIAS-1全基因组序列设计PIAS-1 siRNA的特异性引物序列,通过酶切连接、PCR及测序分析成功构建了pLK0.1-PIAS-1真核表达载体,为研究PIAS-1在肿瘤中的作用和与宫颈癌细胞化疗间的相关性做好准备,PIAS-1可能成为宫颈癌分子靶向治疗的一个靶点。pLK 0.1是U6启动子,为RNA聚合酶Ⅲ启动子的一种,而RNA聚合酶Ⅲ是siRNA载体在哺乳动物细胞中表达活性的必需中间介质;pLK 0.1还带有氨苄霉素和嘌呤霉素抗性基因、多克隆位点,可确保外源基因有效的转录和表达[15];pLK 0.1 与 psPAX2、pMD2.G 借助 293t细胞可形成慢病毒,是后期稳转株筛选的必备条件。但本试验的局限性在于:只成功构建了含有目的基因PIAS-1的慢病毒载体Plko.1-PIAS-1,未转染宫颈癌细胞系进行进一步的研究,因此只停留在基因水平,尚未进行功能上的试验及研究。
[1]Zeng M,Kuzirian MS,Harper L,et al.Organic small hairpin RNAs(OshR):A do-it-yourself platform for transgene-based gene silencing[J].Methods,2013.63(2):101.
[2]Shah JK,R Garner H,White MA,et al.sIR:siRNA Information Resource,a web-based tool for siRNA sequence design and analysis and an open access siRNA database[J].BMC bioinformatics,2007,8:178.
[3]Cheng P,Ni Z,Dai X,et al.The novel BH-3 mimetic apogossypolone induces Beclin-1-and ROS-mediated autophagy in human hepatocellular carcinoma correctedcells[J].Cell death& disease,2013,4:e489.
[4]Lopez TV,Lappin TR,Maxwell P,et al.Autocrine/paracrine erythropoietin signalling promotes JAK/STAT-dependent proliferation of human cervical cancer cells.International journal of cancer[J].Journal international du cancer,2011,129(11):2566.
[5]叶明珠.信号传导和转录激活因子1及其抑制子PIAS1在Ⅰ期及Ⅱ期宫颈鳞癌中的表达及意义[J].中国实用妇科与产科杂志,2010,26(11):837.
[6]Caraglia,M,M Marra,G Pelaia,et al.Alpha-interferon and its effects on signal transduction pathways[J].Journal of cellular physiology,2005,202(2):323.
[7]Sobti R C,Singh N,Hussain S,et al.Overexpression of STAT3 in HPV-mediated cervical cancer in a north Indian population[J].Molecular and cellular biochemistry,2009,330(1/2):193.
[8]Ferrandi C,Richard F,Tavano P,et al.Characterization of immune cell subsets during the active phase of multiple sclerosis reveals disease and c-Jun N-terminal kinase pathway biomarkers[J].Multiple sclerosis,2011,17(1):43.
[9]Sobti R C,Singh N,Hussain S,et al.Aberrant promoter methylation and loss of suppressor of cytokine signalling-1 gene expression in the development of uterine cervical carcinogenesis[J].Cellular oncology,2011,34(6):533.
[10]Saydmohammed M,Joseph D,Syed V.Curcumin suppresses constitutive activation of STAT-3 by up-regulating protein inhibitor of activated STAT-3(PIAS-3)in ovarian and endometrial cancer cells[J].Journal of cellular biochemistry,2010,110(2):447.
[11]Liang Y,Jin Y,Li Y.Expression of JAKs/STATs pathway molecules in rat model of rapid focal segmental glomeruloscle-rosis[J].Pediatric nephrology,2009,24(9):1661.
[12]Sentis S,Romancer M L,Bianchin C,et al.Sumoylation of the estrogen receptor alpha hinge region regulates its transcriptional activity[J].Molecular endocrinology,2005,19(11):2671.
[13]Ferrandi C,Richard F,Tavano P,et al.Characterization of immune cell subsets during the active phase of multiple sclerosis reveals disease and c-Jun N-terminal kinase pathway biomarkers[J].Multiple Sclerosis Journal,2010,17(1):43.
[14]Hoefer J,Schafer G,Klocker H,et al.PIAS1 is increased in human prostate cancer and enhances proliferation through inhibition of p21[J].The American journal of pathology,2012,180(5):2097.
[15]Buitrago C,Pardo V G,Boland R.Role of VDR in 1alpha,25-dihydroxyvitamin D3-dependent non-genomic activation of MAPKs,Src and Akt in skeletal muscle cells[J].The Journal of steroid biochemistry and molecular biology,2013,136:125.

