β-咔啉类生物碱对人胃癌细胞SGC-7901增殖的影响
樊玉祥,曾凡业,何文婷,张洪亮
(新疆医科大学附属中医医院肿瘤二科,新疆乌鲁木齐,830000)
β-咔啉类生物碱是一大类天然来源的生物碱,自然界分布广泛。其中从蒺藜科多年生草本植物骆驼蓬种子中所提取出的最为常见的β-咔啉类生物碱,主要包括去氢骆驼蓬碱及骆驼蓬碱。国内外相关研究[1-5]发现,β-咔啉类生物碱表现出广谱的抗肿瘤活性,且毒副作用相对较小。目前,临床上陆续开展运用骆驼蓬粗提取物治疗肿瘤的研究,但其具体的抗肿瘤机制仍不清楚。本实验通过观察不同浓度下β-咔啉类生物碱诱导人胃癌细胞SGC-7901凋亡的过程,旨在探讨β-咔啉类生物碱对SGC-7901细胞增殖作用的影响及相关的抗肿瘤机制。
1 资料与方法
1.1 实验材料
人胃癌SGC-7901细胞株购自中国科学院上海生命科学研究院细胞资源中心;β-咔啉类生物碱由北京中医药大学刘永刚教授惠赠;甲基噻唑蓝(MTT)、二甲基亚砜(DMSO)、Hoechst 33258 染色液购自美国sigma公司;Annexin V-FITC/PI细胞凋亡检测试剂盒、DNA Ladder提取试剂盒(上海贝博生物有限公司),酶标仪(1500,美国Thermo公司),流式细胞计数仪(Guava Easycyte 8HT,美国Millipore公司),荧光扫描仪(Gel Doctm XR+,美国Bio-Rad公司),荧光显微镜(DMI6000B,德国Leica公司),二氧化碳培养箱(美国Thermo公司)。
1.2 实验方法
1.2.1 细胞培养:将SGC-7901细胞置于培养瓶内,用含有10%胚胎牛血清+0.5%双抗(青霉素、链霉素)RPMI-1640培养基培养,将细胞置于环境为37℃、5%CO2的细胞培养箱中培养,每2 d更换培养液1次,实验时取对数生长期细胞。
1.2.2 细胞生长抑制实验:应用MTT比色法,将处于对数生长期的细胞以每孔1×105浓度加入96孔板,每孔细胞悬液150μL,培养箱中培养24h,观察细胞贴壁后,更换培养基,同时设立不同浓度(5、10、20、40μg/mL)的 β-咔啉类生物碱及阴性对照,每组设6个复孔。分别连续培养24、48h后,加入5%MTT10μL,继续置于培养箱中培养4h。4h后吸出培养液,每孔加入150μL MDSO,室温下均匀震荡10 min,立即使用酶标仪检测吸光度(A值),设定490 nm为测定波长,完成检测后计算抑制率和细胞半数抑制浓度(IC50)[6]。其中,细胞生长抑制率 =(对照组A值―药物组A值)/对照组A值×100%。
1.2.3 Hoechst 33258细胞核染色:取对数生长期的细胞,调整细胞浓度至1×105个/mL,接种于小号培养皿中,细胞悬液1 mL/皿。置于37℃、5%CO2浓度细胞培养箱中孵育24h,观察细胞贴壁后更换培养液,同时分别加入5、10、20、40μg/mL的 β-咔啉类生物碱药物作用 24、48h后,加入1 mg/mL的Hoech33258染色液10μL,继续孵育20 min,使用 PBS仔细清洗2遍后封片,在避光条件下使用荧光显微镜观察细胞核形态改变。
1.2.4 流式细胞术Annexin V-FITC/PI双染法:取对数生长期细胞,接种于培养瓶中,待其自然生长至细胞浓度约3×106个/mL时,按不同浓度(5、10、20、40μg/mL)加入 β-咔啉类生物碱,继续培养细胞24、48h后收集细胞,根据Annexin VFITC/PI细胞凋亡检测要求处理细胞。正常活细胞膜联蛋白(Annexin V)及碘化丙啶(PI)均低染,分布在流式细胞分析图的左下区;凋亡早期的细胞在Annexin V上高染,而在PI上低染,分布在图的左上区;凋亡晚期或死亡细胞Annexin V及PI均高染,分布在图的右上区[7]。
1.2.5 基因组DNA琼脂糖凝胶电泳:使用培养瓶培养细胞,观察其生长状态。在其对数生长期加入浓度为 5、10、20、40μg/mL 的 β-咔啉类生物碱,继续培养细胞24、48h后收集细胞,按 DNA Ladder提取要求提取细胞DNA,最后用1.2%的琼脂糖凝胶、100 V、25 min条件电泳,观察凋亡梯状条带。
2 结果
2.1 不同浓度β-咔啉类生物碱对SGC-7901细胞增殖的影响
不同浓度β-咔啉类生物碱作用于SGC-7901细胞24和48h后,细胞生长均表现出不同程度的抑制,组内差异具有统计学意义(P<0.05);药物浓度5、10、20、40μg/mL组分别与0μg/mL组比较,差异具有统计学意义(P<0.01),数据显示伴随药物浓度增加,抑制率逐渐增加;不同药物浓度分处理24与48h比较无显著差异(P>0.05)。另外,作用24、48h后细胞半数抑制浓度(IC50)分别为17.79μg/mL和12.17μg/mL。见表 1。
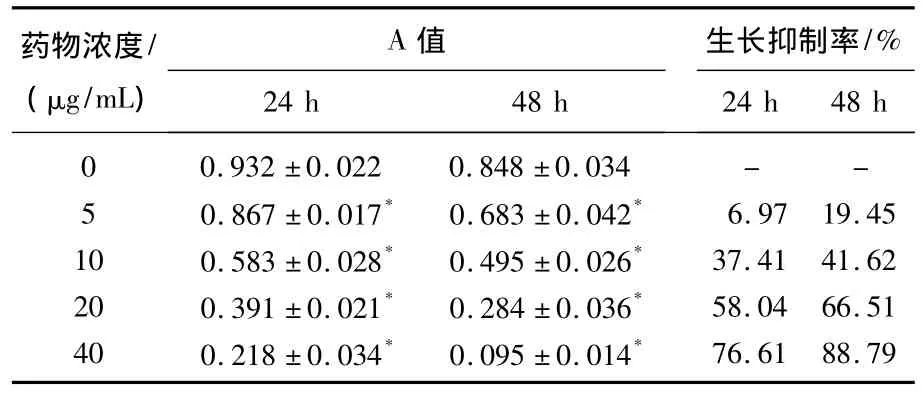
表1 不同浓度β-咔啉类生物碱对细胞增殖的影响(n=6)
2.2 SGC-7901细胞核形态改变
SGC-7901细胞经不同浓度的β-咔啉类生物碱处理24和48h后在荧光显微镜下观察:细胞核固缩,核内染色质在局部区域内凝集,致密浓染,部分可见核碎裂,出现凋亡小体。
2.3 不同浓度β-咔啉类生物碱对SGC-7901细胞凋亡的影响
采用流式细胞仪检测处于亚G1期细胞所占比率来表示SGC-7901细胞凋亡率。5、10、20、40μg/mL浓度组细胞凋亡率分别与0μg/mL组比较,差异具有统计学意义(P<0.05),见表2。流式细胞术Annexin V-FITC/PI双染法结果显示,不同浓度的药物对细胞均有诱导凋亡的作用,且随浓度的增加,诱导凋亡作用越明显,见图1。

表2 不同浓度β-咔啉类生物碱作用后细胞凋亡率变化比较(n=6)
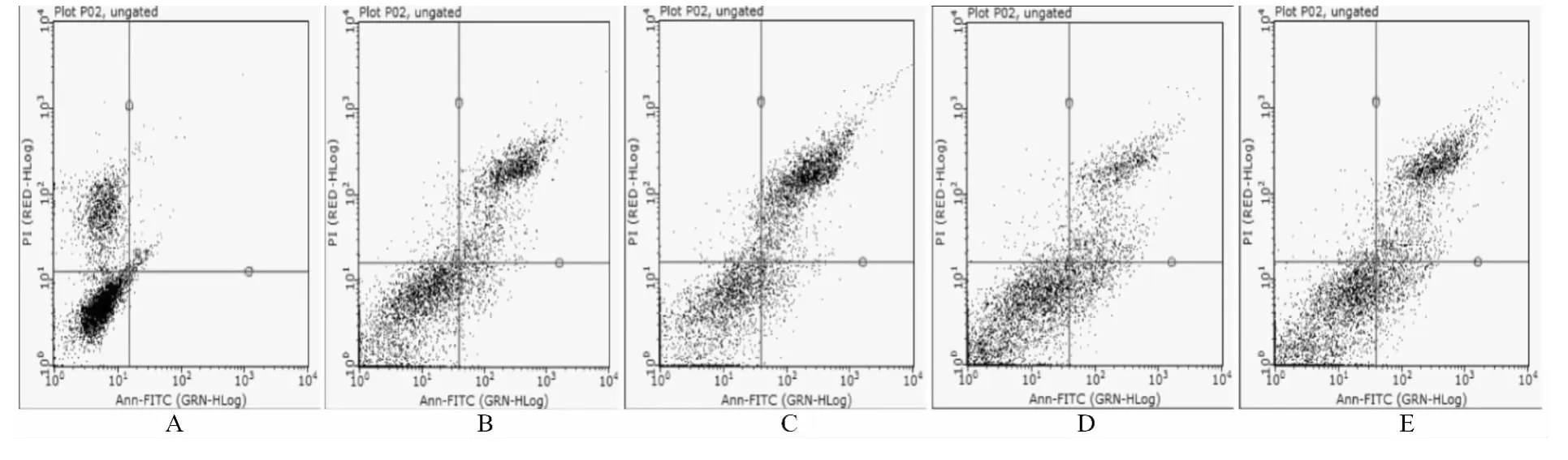
图1 不同浓度β-咔啉类生物碱作用SGC-7901细胞24h后细胞凋亡情况
2.4 SGC-7901细胞电泳情况
不同质量浓度的 β-咔啉类生物碱作用于SGC-7901细胞48h后,经DNA电泳可见不同程度的凋亡梯状条带,同时随着药物质量浓度的增大,细胞坏死数量增多,显示为不清晰的条带,见图2。

图2 SGC-7901细胞琼脂糖凝胶电泳情况
3 讨论
胃癌是亚洲地区第二大致死性疾病,在中国其发病率位居消化道肿瘤第一位[6],早期胃癌的治疗手段主要以外科手术切除为主[7]。然而,对于手术治疗和(或)联合放化疗方式治疗进展期胃癌,由于手术风险较高,放化疗药物毒副反应明显,患者往往耐受低,预后差[8-9]。
细胞凋亡,又称为细胞程序性死亡,是由基因严密调控下发生的主动性自我消亡的过程,其形态学存在特征性改变:如胞浆浓缩,核染色质固缩,细胞核碎裂,甚至形成凋亡小体。由于癌细胞存在异常的增殖分化,因此,如何能够引导癌细胞参与正常的细胞凋亡过程是抗肿瘤药物研究的重点。近些年,除了常规手术治疗,大量针对细胞靶向的药物如顺铂、奈达铂、紫杉醇等化疗药物运用于临床治疗中,同时,对于中药在抗肿瘤作用机制的研究的越来越受到重视。国内学者杨小平等[10]发现去氢骆驼蓬碱和骆驼蓬碱混合生物碱对胃癌 MGC-803细胞生长有抑制作用。Cao等[11]发现骆驼蓬碱具有诱导人肝癌细胞HpeG2凋亡的作用。另一方面,β-咔啉类生物碱通过电喷雾质谱仪这一重要手段提取,对骆驼蓬生物总碱经行纯化,在药物层面最大限度的排除了干扰因素,也是对“单体复方”这一概念进行有益的探索[12-13]。
本实验中采用MTT比色法,可直观计算出不同浓度β-咔啉类生物碱浓度在对SGC-7901细胞的抑制率,并进一步计算出半数抑制浓度(IC50),为后续的体内实验提供数据基础。通过对吸光度的统计分析发现,不同 β-咔啉类生物碱浓度(5、10、20、40μg/mL)下各组与阴性对照(0μg/mL)比较,均有显著差异(P <0.01);同时,不同浓度组在处理时24、48h后差异比较无显著差异(P>0.05),可能说明β-咔啉类生物碱对SGC-7901细胞的抑制作用呈剂量依赖型。
细胞核形态学改变能够直观的反应细胞凋亡的过程。本次实验中通过Hoechst 33258细胞核染色法在荧光显微镜下观察SGC-7901细胞核改变,结果显示不同β-咔啉类生物碱药物浓度下,SGC-7901细胞核存在不同程度的形态学改变。流式细胞术是在功能水平上对单个细胞进行定量分析的手段,其具有速度快、精度高、准确性好等优点,是目前较为先进的细胞定量分析方法[14],实验中,采用流式细胞仪检测处于亚G1期细胞百分率和运用流式细胞术散点图计算和显示凋亡细胞,24h检测发现随药物浓度增加右下象限(凋亡细胞)散点分布增多,右上象限(死亡细胞)散点分布同时增多,说明β-咔啉类生物碱对SGC-7901细胞的诱导凋亡作用呈剂量依赖性,而死亡细胞分布并未呈现药物剂量依赖,这可能是和细胞坏死主要跟实验药物的细胞毒性作用有关[15]。
在分子层面上,细胞凋亡改变之一就是细胞染色质DNA断裂和降解。DNA的有控降解是一种内源性核酸内切酶作用的结果,该酶在核小体连接部位切断染色体DNA,由于片段长短成倍数关系,这种降解表现在琼脂糖凝胶电泳中呈现特异性梯状ladder图谱,成为细胞凋亡的特异性指标[16]。王怡苹等[17]利用蜂毒素作用 SGC-7901 细胞48h后可见明显的DNA梯带。本实验中,不同药物浓度处理SGC-7901细胞48h后经DNA电泳,可见不同程度的凋亡梯状条带。
[1]徐小平,素蝉蝉,杨云云,等.骆驼蓬总碱体外抗肿瘤实验研究[J].西北药学杂志,2011,26(2):117.
[2]武姗姗,张洪亮.骆驼蓬研究现状[J].新疆中医药,2011,29(6):61.
[3]刘俊玲,乌庆超,王朝辉,等.去氢骆驼蓬碱诱导急性白血病Jurkat细胞凋亡及其机制[J].光明中医,2012,227(2):242.
[4]Tseng M C,Chu Y W,Tsai H P,et al.One-pot synthesis of luotonin A and its analogues[J].Organic letters,2011,13(5):920.
[5]Liang J L,Cha H C,Jahng Y.Recent advances in the studies on luotonins[J].Molecules,2011,16(6):4861.
[6]高志军,赵春临,乔军波,等.HSP90抑制剂17-DMAG对胃癌细胞株SGC-7901增殖及凋亡的影响[J].世界消化人杂志,2008,16(29):3269.
[7]Areia M,Carvalho R,Cadime A T,et al.Screening for Gastric Cancer and Surveillance of Premalignant Lesions:a Systematic Review of Cost-Effectiveness Studies[J].Helicobacter,2013,18(5):325.
[8]Arkenau H T.Gastric cancer in the era of molecularly targeted agents:current drug development strategies[J].J Cancer Res Clin Oncol 2009,135(7):855.
[9]Wu K,Nie Y,Guo C,et al.Molecular basis of therapeutic approaches to gastric cancer[J].J Gastroenterol Hepatol 2009,24(5):37.
[10]杨小平,潘启超,李春杰.骆驼蓬总碱体内外对人肝癌和胃癌瘤株的抑制作用[J].癌症,1991,10(6):463.
[11]Cao M R,Li Q,Liu Z L,et al.Harmine induces apoptosis in HepG2 cells via mitochondrial signaling pathway[J].Hepatobiliary& Pancreatic Diseases International,2011,10(6):599.
[12]Bensimon A,Heck AJR,Aebersold R.Mass spectrometrybased proteomics and network biology[J].Annual review of biochemistry,2012,81:379.
[13]程坚,张新民,沈自尹,等.一种中药单体小复方对变应性鼻炎模型小鼠的免疫调节作用[J].中西医结合学报,2011,9(12):1360.
[14]Rasul A,Yu B,Zhong L,et al.Cytotoxic effect of evodiamine in SGC-7901 human gastric adenocarcinoma cells via simultaneous induction of apoptosis and autophagy[J].Oncology reports,2012,27(5):1481.
[15]Chauhan S S,Singh A K,Meena S,et al.Synthesis of novel β-carboline based chalcones with high cytotoxic activity against breast cancer cells[J].Bioorganic & medicinal chemistry letters,2014,24(13):2820.
[16]Roos W P,Kaina B.DNA damage-induced cell death:from specific DNA lesions to the DNA damage response and apoptosis[J].Cancer letters,2013,332(2):237.
[17]王怡苹,吕熊文,赵斌,等.蜂毒素对胃癌细胞系SGC-7901细胞增殖抑制作用及机制[J].安徽医科大学学报,2010,45(4),503.

