基质金属蛋白酶-9在子宫内膜癌组织中的表达水平及临床意义
卢建军,伊莉萍,托 娅,乔慧珍
(内蒙古医科大学附属医院,1.妇产科;2.检验科,内蒙古 呼和浩特,010050)
子宫内膜癌又称为子宫体癌,是妇科常见的恶性肿瘤,其发病率仅次于子宫颈癌,并有逐年上升的趋势。研究[1-2]表明,肥胖、糖尿病、高血压等是子宫内膜癌发病的高危因素,激素调节、基因突变、黏附分子、细胞凋亡等多种因素的相互作用参与了其发生、发展过程。淋巴转移和直接浸润为子宫内膜癌的主要转移途径,恶性肿瘤的淋巴转移首先发生肿瘤组织周边和局部,肿瘤组织分泌的组织因子能促进局部淋巴管增生,降解细胞外基质,促进肿瘤细胞浸润、扩散和转移。基质金属蛋白酶家族(MMPs)具有降解细胞外基质及基底膜的功能,多项研究[3-4]证实,子宫内膜癌组织中存在MMPs的异常改变。其中,基质金属蛋白酶-9(MMP-9)在血管、基底膜部位降解胶原蛋白、纤维连接蛋白的功能已被公认。本研究观察了MMP-9在30例子宫内膜癌患者癌组织中的表达水平及其与子宫内膜癌病理特征的关系,现报告如下。
1 资料与方法
1.1 一般资料
收集本院2009年2月—2012年3月住院患者的子宫内膜癌组织石蜡标本30例为研究对象,设为实验组1。组织学分型:子宫内膜样腺癌18例,浆液性腺癌7例,腺鳞癌4例,透明细胞癌1例。病理学分级:G1级14例,G2级12例,G3级4例。淋巴结转移情况:有淋巴结转移5例,无淋巴结转移25例。病理分期:Ⅰ期22例,Ⅱ期4例,Ⅲ期4例。同时收集40例同期住院患者的不典型增生内膜组织石蜡标本设为实验组2,及40例正常子宫内膜组织石蜡标本设为对照组。所有标本均经病理检查确诊,且所有患者均获得。3组年龄无显著差异,具有可比性(P>0.05)。
1.2 方法
1.2.1 免疫组化染色方法:采用免疫组织化学染色方法对3组标本进行染色。所有石蜡标本均行3μm连续石蜡切片,每切5张取1张。将切片以二甲苯脱蜡、酒精梯度(100%、90%、80%、70%)脱水后进行抗原修复,即浸入pH6.0、浓度0.01 mol/L的枸橼酸盐缓冲液(PBS)中,微波煮沸2 min;之后浸入3%的过氧化氢中灭活标本的内源性过氧化物酶,经山羊血清封闭,加入浓度为1∶100的MMP-9抗原标记物一抗Sc6840,4℃保温箱孵育12 h,PBS漂洗10 min×3次;漂洗后加入生物素标记的兔抗羊二抗,室温下孵育15 min;随后实用链霉菌抗生物素-过氧化物酶孵育10 min,二氨基联苯胺(DAB)显色,苏木素复染;随后经1%的盐酸二乙醇分化20 s;脱水、二甲苯透明,中性树胶封片,待封片自然风干后光学显微镜下观察细胞染色情况。
1.2.2 阳性染色统计:由病理学医师进行免疫组化染色阳性细胞统计。首先,对阳性染色细胞数量进行评分:阳性染色细胞数量<10%为0分;阳性染色细胞数量占10% ~25%为1分;阳性染色细胞数量占26% ~50%为2分;阳性染色细胞数量占50% ~75%为3分;阳性染色细胞数量>75%为4分。其次,对阳性染色细胞的着色程度进行评分:浅黄色为1分;橘黄色为2分;棕褐色为3分。统计每张切片的数量评分和着色程度评分之和,取每组切片统计评分的平均数,0~5分为低表达,≥6分为高表达。
1.3 观察指标
比较各组MMP-9表达情况;分析子宫内膜癌组织MMP-9表达与临床病理参数关系;采用Cox比例风险模型分析子宫内膜癌预后生存因素。
2 结果
2.1 各组MMP-9表达情况
显微镜下观察MMP-9阳性染色细胞在3组切片中均有不同程度表达。MMP-9阳性染色部位位于细胞质中,呈棕黄色颗粒,散在的片状分布为主,多位于血管腔旁。实验组1、组2和对照组的低表达分别为17例(56.7%)、32例(80.0%)和35例(87.5%),实验组1显著低于实验组2和对照组(P<0.05);实验组1、组2和对照组的高表达分别为13例(43.3%)、8例(20.0%)和5例(12.5%),实验组1的高表达率显著高于实验组2和对照组(P<0.05)。
2.2 MMP-9表达水平与子宫内膜癌病理特征的关系
经统计检验,子宫内膜癌组织中MMP-9蛋白的表达水平与患者年龄、病理分期无相关性,与病理分级及淋巴结转移情况有关。病理分级G3的组织标本MMP-9蛋白的高表达率明显高于G1、G2,低表达率明显低于G1、G2,差异有统计学意义(P<0.05)。有淋巴结转移的子宫内膜癌患者,其癌组织标本中,MMP-9蛋白高表达率明显高于无淋巴结转移的患者,低表达率明显低于无淋巴结转移的患者,差异有统计学意义(P<0.05)。见表1。
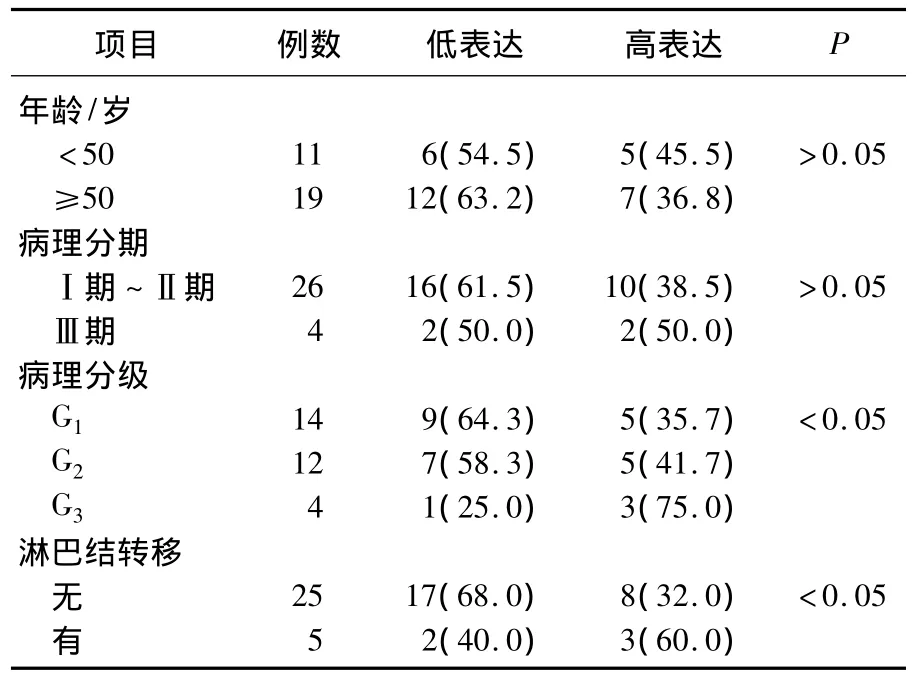
表1 子宫内膜癌组织MMP-9表达与临床病理参数关系[n(%)]
2.3 子宫内膜癌预后影响因素分析
采用Cox比例风险模型分析子宫内膜癌预后生存因素,发现MMP-9的表达水平并非子宫内膜癌独立的预后影响因素,有淋巴结转移的患者死亡风险比(HR)是无淋巴结转移患者的10.547倍,病理分级 G3患者的 HR是 G1、G2患者的2.287倍,病理分级及淋巴结转移情况与子宫内膜癌生存情况密切相关(P<0.05)。
3 讨论
子宫体癌的97% 来源于子宫内膜腺体,其发生、发展是多因素参与的复杂过程,是目前临床研究的热点。据统计[5]子宫体癌在妇科肿瘤中的治愈率最高,但仍存在转移和复发的高风险,成为妇女治疗失败和死亡的主要原因之一。因此,有关子宫内膜癌的相关生物学标志物的研究,具有重要临床治疗意义。MMPs是膜相关锌离子依赖型蛋白内切酶超家族,具有裂解细胞外基质蛋白的作用[6-8]。MMPs与其抑制因子的相互作用,是肿瘤细胞转移、侵袭的关键因素。而基底膜的完整与否,是评估肿瘤细胞是否发生转移的重要参考指标。MMP-9是MMPs中分子量最大的酶,人体巨噬细胞、毛细血管内皮细胞、中性粒细胞、肿瘤细胞等均可以分泌MMP-9。MMP-9可以降解胶原,并在细胞与细胞外基质的黏附中发挥重要作用。有研究[9]表明,肿瘤侵袭转移的潜能会随着肿瘤细胞产生MMP-9的能力的增大而增大,可见二者间具有密切的正相关关系,即MMP-9不仅参与了细胞外基质的降解过程,还参与了肿瘤细胞的黏附过程。
本研究中应用免疫组织化学染色的方法,可见MMP-9主要表达的位置在肿瘤细胞质中,阳性染色细胞分布的主要部位在子宫内膜癌巢及肿瘤细胞间质中。子宫内膜癌组织中MMP-9的阳性表达率明显高于不典型增生内膜组织和正常子宫内膜组织中的MMP-9表达。这与其他学者的研究相一致[10-12]。作者推测,子宫内膜癌组织中的MMP-9高表达,能够增加癌细胞对内膜的侵袭力,降解细胞外基质成分,间接促进了肿瘤细胞的迁移。
有学者[13]的研究中发现,子宫内膜癌组织中的主要金属蛋白酶包括MMP-2和MMP-9,MMP-2、MMP-9在子宫内膜癌组织中的表达水平与肌层浸润程度和临床病理分级有密切关系,病理分级越高,肌层浸润程度越深,MMP-9、MMP-2的表达水平越高。也有学者[14]的研究显示,MMP-9蛋白在子宫内膜癌组织中的表达水平与肿瘤病理级别、临床分期密切相关。以上研究结果均表明,子宫内膜癌的侵袭和转移,与MMP-9蛋白表达增强密切相关,主要表现在:MMP-9高表达能增强肿瘤细胞在浸润转移过程中的能力,并提高其突破各种屏障的能力;癌细胞自身或诱导其他细胞,大量分泌MMP-9,破坏基底膜的完整性,最终导致癌细胞对周围正常组织的侵袭,引起肿瘤转移。本研究分析了MMP-9与临床病理各因素之间的关系,研究结果表明,随着子宫内膜病理分级的提高,子宫内膜癌组织中MMP-9的表达水平呈增加趋势。MMP-9的表达水平在有淋巴结转移的患者的子宫内膜癌组织中明显高于无淋巴结转移的患者,这与上述报道相一致。
本研究还采用Cox比例风险模型分析子宫内膜癌预后生存因素,结果显示病理分级、淋巴结转移状态与子宫内膜癌生存情况密切相关。有淋巴结转移患者死亡风险是无淋巴结转移患者的10.547倍;病例分级G3的患者的死亡风险是病例分级G1或G2患者的2.287倍。这表明在预后评价中上述传统的指标不应被忽视,而且临床上应支持对病理分级高、有淋巴转移的患者给予综合治疗,以提高其生存率。然而,MMP-9的不同表达对子宫内膜癌患者的总生存率无影响。分析原因可能是,肿瘤转移和浸润机制本身就是一个相对复杂的过程,不仅取决于肿瘤细胞的失控性增长,还取决于肿瘤细胞与宿主细胞及组织的微环境之间的相互作用,MMP-9对于子宫内膜癌的发生、发展以及预后有一定的影响,但其本身并不能作为一种独立预后因素来影响子宫内膜癌预后。
[1]魏丽惠.重视子宫内膜癌的筛查[J].中华妇产科杂志,2013,48(12):881.
[2]Trovik J,Wik E,Stefansson I M,et al.Stathmin overexpression identifies high-risk patients and lymph node metastasis in endometrial cancer[J].Clinical cancer research,2011,17(10):3368.
[3]Weigel M T,Krmer J,Schem C,et al.Differential expression of MMP-2,MMP-9 and PCNA in endometriosis and endometrial carcinoma[J].European Journal of Obstetrics &Gynecology and Reproductive Biology,2012,160(1):74.
[4]Jedryka M,Chrobak A,Chelmonska-Soyta A,et al.Matrix metalloproteinase(MMP)-2 and MMP-9 expression in tumor infiltrating CD3 lymphocytes from women with endometrial Cancer[J].International Journal of Gynecological Cancer,2012,22(8):1303.
[5]Cote M L,Ruterbusch J J,Ahmed Q,et al.Endometrial cancer in morbidly obese women:Do racial disparities affect surgical or survival outcomes?[J].Gynecologic oncology,2014,133(1):38.
[6]Koyama N,Nishida Y,Ishii T,et al.Telmisartan InducesGrowth Inhibition,DNA Double-Strand Breaks and Apoptosis in Human Endometrial Cancer Cells[J].PloS one,2014,9(3):e93050.
[7]Kessenbrock K,Plaks V,Werb Z.Matrix metalloproteinases:regulators of the tumor microenvironment[J].Cell,2010,141(1):52.
[8]Gialeli C,Theocharis A D,Karamanos N K.Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting[J].FEBS Journal,2011,278(1):16.
[9]Puljiz M,Puljiz Z,Vucemilo T,et al.Prognostic significance of matrix metalloproteinases 2 and 9 in endometrial cancer[J].Collegium antropologicum,2012,36(4):1367.
[10]高萍,李晓云,陈晓丽,等.子宫内膜癌中 MMP-9、CD44v6的表达及意义[J].中国药物经济学,2013,(6):300.
[11]Guo T,Gu C,Li B.PEDF inhibits growth and invasiveness of endometrial cancer cells in vitro[J].Panminerva medica,2012,54(4):299.
[12]李云云,贺文凤,黄婷婷,等.PTEN对子宫内膜癌细胞株迁移和侵袭能力的影响[J].中国癌症杂志,2013,23(10):813.
[13]Jedryka M,Chrobak A,Chelmonska-Soyta A,et al.Matrix metalloproteinase(MMP)-2 and MMP-9 expression in tumor infiltrating CD3 lymphocytes from women with endometrial Cancer[J].International Journal of Gynecological Cancer,2012,22(8):1303.
[14]Yu F,Jiang Q,Zhou Y,et al.Abnormal expression of matrix metalloproteinase-9(MMP9)correlates with clinical course in Chinese patients with endometrial cancer[J].Disease markers,2012,32(5):321.

