顺铂激活的低分化鼻咽癌细胞氯电流为非钙激活氯电流*
阳小雅, 刘 梅, 伍嘉宝, 赖周易, 汪 源,
范爱辉4, 朱林燕2, 毛建文5, 王立伟3△, 陈丽新2△
凋亡性细胞皱缩(apoptotic volume decrease,AVD)是细胞凋亡的普遍特征,在细胞凋亡早期触发机制中起关键作用[1]。我们的前期研究发现,抗癌药顺铂(cisplatin;即顺式二氨基二氯铂,cis-diamminedichloroplatinum,cDDP)可诱导低分化鼻咽癌CNE-2Z细胞AVD和细胞凋亡的发生,氯通道阻断剂对其具有阻抑作用。在此基础上我们进一步用膜片钳方法观察到顺铂在等渗环境下激活氯电流,该电流具有外向整流、对胞内ATP具有依赖性、能被氯通道阻断剂阻断、阴离子通透性顺序为I-≥Br->Cl->gluconate等特性[2],提示了顺铂可激活氯通道,该通道参与了AVD和细胞凋亡的发生。然而,氯离子通道有电压依赖性氯通道、配体门控性氯通道、蛋白激酶或核苷酸介导的氯通道、容积敏感性氯通道、钙激活氯通道(calcium-activated chloride channels,CaCC)等几种类型[3],顺铂激活的氯通道属于何种氯通道尚未明确。研究表明,容积敏感性氯通道和CaCC激活后拥有部分与顺铂激活的氯电流相似的电流特征,如外向整流特性、能被氯通道阻断剂阻断、相似的阴离子通透性等,且两者皆参与了细胞凋亡的调控[4-6]。为进一步明确顺铂激活的氯通道的类型,本研究拟在前期研究基础上,通过去除细胞内外的Ca2+、胞外灌流钙通道阻断剂及改变胞外灌流液渗透压等方法辨明顺铂激活的氯通道是否为CaCC。
材料和方法
1 细胞培养
低分化鼻咽癌CNE-2Z细胞用含10%小牛血清、100 mg/L链霉素和1×105U/L青霉素的RPMI-1640生长液在37℃、饱和湿度、5%CO2培养箱内培养,按常规方法传代。
2 膜片钳全细胞记录
采用我们前文报道的方法记录全细胞电流[7]。用EPC-7膜片钳放大器(List Electronic)记录单个CNE-2Z细胞的全细胞电流。充灌电极内液后微电极尖端电阻为5~10 MΩ。电流与电压信号用CED 1401(Cambridge,UK)数字化(采样频率3 kHz),实验数据用EPC软件分析。在电压钳制模式下,细胞被钳制在0 mV,以0 mV、±40 mV和±80 mV顺序不断反复循环,每一电位持续200 ms,两电位之间间隔4 s。所有实验在室温(20~24℃)中进行。
在钙通道阻断剂实验中,当顺铂激活氯电流达到峰值并平稳2 min后,加入钙通道阻断剂,观察钙通道阻断剂对顺铂激活氯电流的影响。
在观察顺铂激活氯通道的容积敏感性实验中,当顺铂激活氯电流达到峰值并稳定后,换为含相同浓度顺铂的高渗灌流液,待氯电流达到最小值并平稳,计算渗透性细胞容积缩小对顺铂激活氯电流的抑制率。计算公式为:抑制率 (%)=[(CCtrl-CIso)-(CHyper-CIso)]/(CCtrl-CIso)×100%,其中 CCtrl是加入顺铂等渗灌流液时的对照电流密度,CIso是等渗时的电流密度,CHyper是加入含顺铂高渗液后的电流密度。
3 溶液及试剂
3.1 灌流液 等渗灌流液含(mmol/L):70 NaCl,2 CaCl2,0.5 MgCl2,10 HEPES 和 140 D-mannitol。用D-mannitol调节渗透压至300 mOsmol/L。高渗灌流液除D-mannitol为280 mmol/L外,其余成分均同等渗灌流液,其渗透压为440 mOsmol/L。无钙等渗灌流液在等渗灌流液基础上去除CaCl2并加入2 mmol/L EGTA。灌流液用Tris液调pH至7.4。用冰点渗透压计(Osmomat 030)检测溶液渗透压。
3.2 电极内液 电极内液含(mmol/L):70 N-methyl-D-glucamine chloride(NMDG-Cl)、1.2 MgCl2、1 EGTA、10 HEPES、140 D-mannitol和 2 ATP。Tris液调pH至7.25,渗透压调至300 mOsmol/L。无钙电极内液在电极内液的基础上加入5 mmol/L EGTA,其它成分与电极内液相同。
3.3 主要试剂 顺铂购自江苏豪森药业股份有限公司,使用前按需用各种灌流液稀释。硝苯地平(nifedipine)购自 Sigma,在实验当天新鲜配制,用DMSO溶解配制成5 mmol/L储存液,室温避光保存;灌流前再用灌流液稀释至1、5和10 μmol/L。
4 统计学处理
数据用均数±标准误(mean±SEM)表示,用方差分析(ANOVA)检验均数差异显著性,以P<0.05为差异有统计学意义。
结 果
1 细胞外无Ca2+对顺铂激活氯电流的影响
如图1A所示,当细胞处于无Ca2+等渗灌流液中时,可记录到较小且稳定的细胞背景电流。当灌流5 μmol/L顺铂无 Ca2+等渗灌流液时,在(435.7±100.1)s时能激活一电流,该电流逐渐增大,约(1 175.6±221.5)s达到峰值,内向和外向电流在 ±80 mV钳制下平均密度约为(-72.0±14.1)pA/pF和(93.1 ±14.5)pA/pF(P <0.01),见图1B、D、E。当电流达到峰值并稳定后,灌流液换成5 μmol/L顺铂含Ca2+等渗灌流液,电流出现小幅度上升,达到平台期时电流大小为(-86.5±15.2)pA/pF(-80 mV)和(117.6 ±14.1)pA/pF(+80 mV),但与无 Ca2+时激活的电流相比较,差异无统计学意义(P>0.05),见图1C、E。
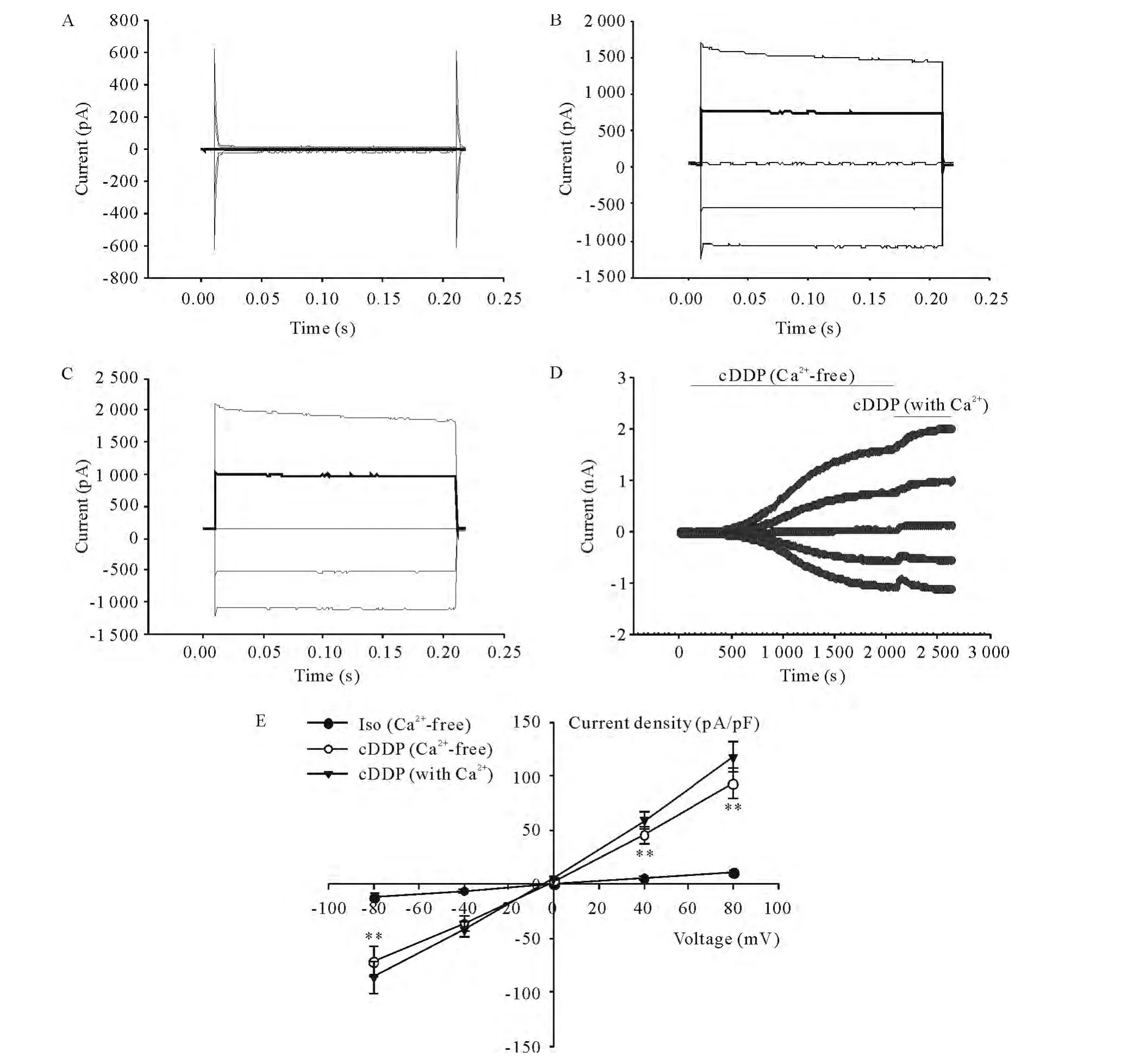
Figure 1.Effects of extracellular calcium depletion on the activation of cDDP-activated Cl- currents in CNE-2Z cells.A:traces of background currents recorded in the Ca2+free isotonic solution;B:currents recorded in the Ca2+-free cDDP solution;C:a typical time course of the currents induced by cDDP in the absence or presence of extracellular Ca2+;D:currents recorded in the cDDP solution;E:the current-voltage relationships of the cDDP-activated currents in the absence or presence of extracellular Ca2+.Iso(Ca2+-free):Ca2+-free isotonic condition;cDDP(Ca2+-free):Ca2+-free cDDP solution challenge;cDDP:cDDP solution challenge.Mean ± SEM.n=9.**P <0.01 vs Iso(Ca2+-free)group.图1 细胞外无Ca2+对顺铂激活的CNE-2Z细胞电流的影响
上述结果显示,顺铂在细胞外有Ca2+与无Ca2+条件下均可激活氯电流,且电流大小无明显差别,证实顺铂激活氯电流不依赖于细胞外Ca2+。然而,顺铂在细胞外无Ca2+时激活氯电流的潜伏期比细胞外有Ca2+时延长(P<0.01),达峰时间也增加(P<0.05),见表1,提示Ca2+在顺铂激活氯电流过程中可能通过某种途径起调节作用。
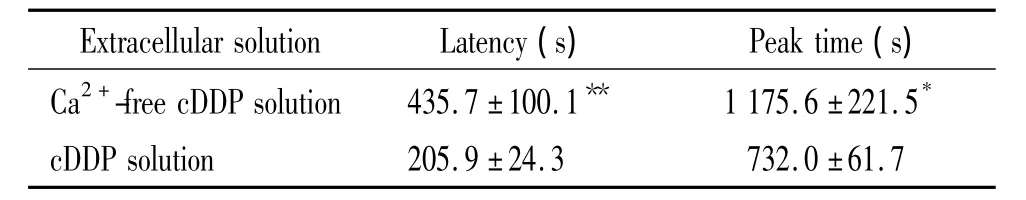
表1 顺铂在细胞外无Ca2+与正常状态下激活氯电流的潜伏期及达峰时间Table 1.Latency and peak time of cDDP-activated chloride currents in the absence or presence of extracellular Ca2+(Mean±SD.n=9)
2 细胞内无Ca2+和细胞内外均无Ca2+对顺铂激活氯电流的影响
如图2A所示,在-80 mV电压钳制下,内向电流峰值的电流密度为(-85.7±30.1)pA/pF,+80 mV电压钳制下,外向电流的电流密度为 (93.2±28.5)pA/pF,与正常细胞内外含Ca2+情况下激活的电流密度相比,差异无统计学意义(P>0.05)。当细胞内外均无Ca2+时,顺铂激活氯电流的潜伏期为(296.3 ±66.1)s,与含 Ca2+对照组相比,差异无统计学意义(P >0.05),达峰时间为(1 087.5 ±135.2)s,较含Ca2+对照组延长(P<0.05)。当电流达峰并稳定后,灌流液换成顺铂含Ca2+等渗灌流液,形成了细胞内无Ca2+状态,此时电流变化不明显,如图2B和2C所示,达到平台期时电流大小为(-86.0±37.7)pA/pF(-80 mV)和(97.8 ±40.9)pA/pF(+80 mV),与细胞内外均含Ca2+的对照组相比,差异无统计学意义(P>0.05)。以上结果表明,顺铂激活氯电流不依赖于细胞内的Ca2+。

Figure 2.Effects of intra/extracellular calcium depletion on the activation of cDDP-activated Cl- currents in CNE-2Z cells.A:currents recorded in the Ca2+-free cDDP solution with 5 mmol/L EGTA in the pipette solution;B:currents recorded in the cDDP solution with 5 mmol/L EGTA in the pipette solution;C:the current-voltage relationships of the cDDP-activated currents under the intra/extracellular calcium depletion conditions.Iso(Ca2+-free):Ca2+-free isotonic condition;cDDP(intraand extracellular Ca2+-free):Ca2+-free cDDP solution with 5 mmol/L EGTA in the pipette solution;cDDP(intracellular Ca2+-free):cDDP solution with 5 mmol/L EGTA in the pipette solution.Mean ± SEM.n=9.图2 细胞内无Ca2+、细胞内外均无Ca2+对顺铂激活的CNE-2Z细胞电流的影响
3 钙通道阻断剂对顺铂激活氯电流的影响
结果显示 1 μmol/L 和5 μmol/L nifedipine不能抑制顺铂激活的氯电流。图3A和B分别显示了顺铂激活的氯电流和5 μmol/L nifedipine的抑制作用瞬时图。-80 mV电压钳制下,内向电流从 (-75.0±12.4)pA/pF 略减小到(-73.0 ±13.1)pA/pF,抑制率为(4.2 ±3.9)%(P >0.05);+80 mV 电压钳制下,外向电流从 (86.9±13.3)pA/pF减小到(79.6 ± 13.9)pA/pF,抑制率为(10.8 ± 3.1)%(P>0.05),见图 3C。增大 nifedipine 浓度至 10 μmol/L,抑制率无进一步增大。

Figure 3.Effects of calcium channel antagonist nifedipine on the cDDP-activated Cl- currents in CNE-2Z cells.A:traces of the currents induced by cDDP;B:current traces showing effect of nifedipine on the cDDP-activated Cl-currents;C:the currentvoltage relationships under cDDP-activated condition and extracellular nifedipine(5 μmol/L)treatment.Iso:isotonic condition;cDDP:cDDP challenge;nifedipine:nifedipine treatment after cDDP challenge.Mean ± SEM.n=7.图3 钙通道阻断剂nifedipine对顺铂激活氯电流的影响
4 顺铂激活氯电流的容积敏感性
如图4A所示,47%高渗灌流液可迅速完全抑制顺铂激活的氯电流。此抑制作用是可逆的,换回等渗灌流液可见氯电流恢复。图2B和C分别显示了顺铂激活的氯电流和高渗灌流液抑制作用的瞬时图。在钳制电压为-80 mV时,47%高渗灌流液使顺铂激活的内向电流从 (-50.0±7.7)pA/pF减小到(-8.5 ±2.5)pA/pF,抑制率为 (91.8 ±3.6)%(P<0.01),在钳制电压为+80 mV时,外向电流从(60.5 ±10.5)pA/pF 减小到(8.9 ±2.4)pA/pF,抑制率为(91.3 ±4.2)%(P <0.01)。47%高渗灌流液对外向电流和内向电流的抑制率差别无统计学意义(P>0.05),见图4D,表明顺铂激活的氯电流对容积变化敏感。
讨 论
CaCC在组织中分布广泛,在体内多种生命活动中扮演着重要角色,如嗅觉、味觉的转导、神经元的兴奋性、腺体和上皮细胞分泌、平滑肌收缩、细胞增殖及凋亡等[4,8-9]。CaCC 激活后的电流ICl(Ca)呈现出外向整流特性、离子选择性顺序为 SCN->I->NO3->Br->Cl->F->gluconate、能被传统的氯通道阻断剂如tamoxifen等所阻断等特性[10]。我们的前期研究发现,抗癌药顺铂能在数分钟内诱导低分化鼻咽癌CNE-2Z细胞产生氯电流,该电流同样具有外向整流、能被氯通道阻断剂tamoxifen阻断、阴离子通透性顺序为 I-≥Br->Cl->gluconate等特征[2],与ICl(Ca)呈现的部分特征相似。[Ca2+]i的升高是激活CaCC的必要条件,胞内钙库 Ca2+的释放、胞外Ca2+内流与 Na+/Ca2+交换均可使[Ca2+]i升高[8]。然而,本实验结果表明,在细胞外无Ca2+或细胞内外均无Ca2+的情况下,顺铂均能激活氯电流,该电流大小与有Ca2+存在时激活的电流大小相同,表明顺铂诱导的氯电流不依赖于细胞内/外的Ca2+,提示该通道不是CaCC。另有报道显示,钙通道阻断剂米拉地尔(mibefradil)[3]能有效抑制 ICl(Ca),而本实验结果显示,在CNE-2Z细胞,钙通道阻断剂nifedipine不能抑制顺铂激活的氯电流,进一步说明顺铂激活的氯通道非CaCC。
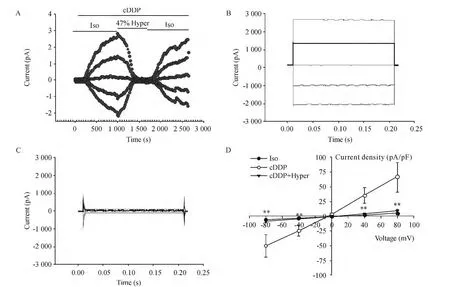
Figure 4.Effects of extracellular hypertonic condition on cDDP-activated chloride currents in CNE-2Z cells.A:the time course of the cDDP-activated currents inhibited by the hypertonic solution;B:currents recorded in the cDDP isotonic solution;C:currents recorded in the cDDP hypertonic solution;D:the current-voltage relationships of the cDDP-activated currents in the isotonic or hypertonic conditions.Iso:isotonic condition;cDDP:cDDP solution challenge;cDDP+Hyper:cDDP hypertonic solution challenge.Mean ± SEM.n=6.**P <0.01 vs cDDP group.图4 细胞外高渗对顺铂激活氯电流的影响
容积敏感性氯通道为最常见的阴离子通道,在细胞容积调节[11]、细胞迁移[12]、细胞周期[13]、细胞增殖[13-14]等生命活动中发挥重要作用。近年研究表明,容积敏感性氯通道通过参与AVD的发生而参与细胞凋亡[5-6,14]。容积敏感性氯电流部分的电流特征与ICl(Ca)相似,如外向整流特性、相似的阴离子通透性、均能被传统的氯通道阻断剂所阻断等,此外,容积敏感性氯电流亦拥有自己独特的特征,如对胞内ATP的依赖性及对容积变化敏感[7]。我们的前期研究表明,顺铂诱导的氯电流拥有与容积敏感性氯电流相似的特征,为进一步探讨该电流对细胞容积改变是否敏感,我们在顺铂等渗灌流液激活氯电流的情况下给予高渗刺激,实验结果显示,该电流可被明显抑制,说明该电流具有容积敏感性,提示在CNE-2Z细胞中,顺铂激活的氯通道可能是容积激活氯通道,而非CaCC。在表皮样腺癌KB细胞[5]及野生型人肺腺癌细胞(WT A549细胞)[6]中,顺铂也能引出与容积敏感性氯电流特征相似的电流,进一步提示了顺铂激活的氯通道很可能是容积激活氯通道,但还需利用特异性阻断剂以及其它手段研究证实。
Ca2+在细胞信号转导过程中起重要作用。本实验中,尽管在细胞外无Ca2+的情况下,顺铂激活的氯电流大小与胞外有Ca2+时激活的电流大小相同,然而,其激活时间与达峰时间均延长,提示了虽然氯通道的激活不依赖于Ca2+,但细胞外Ca2+在其激活过程中可能起调节作用。我们实验室的前期研究显示,胞外无Ca2+或加入钙离子阻断剂nifedipine均可延缓顺铂诱导CNE-2Z细胞AVD的发生[15],提示细胞外Ca2+内流可能在触发细胞凋亡早期AVD中对氯通道的激活起重要调节作用,但并非氯通道激活所必须的条件。细胞外Ca2+进入细胞的途径主要有Na+/Ca2+交换、通过钙通道内流入胞内等[8],本实验结果显示,钙通道阻断剂nifedipine不能抑制顺铂激活的氯电流,提示Ca2+不是通过钙通道途径进入细胞而起作用。细胞外Ca2+是否通过Na+/Ca2+交换或通过其它途径进入细胞而调节氯通道的激活则有待进一步探讨。
[1] Okada Y,Shimizu T,Maeno E,et al.Volume-sensitive chloride channels involved in apoptotic volume decrease and cell death [J].J Membr Biol,2006,209(1):21-29.
[2] 阳小雅,王立伟,朱林燕,等.顺铂激活的低分化鼻咽癌细胞氯电流[J].中国病理生理杂志,2009,25(4):666-669.
[3] Nilius B,Droogmans G.Amazing chloride channels:an overview[J].Acta Physiol Scand,2003,177(2):119-147.
[4] Kim JA,Kang YS,Lee YS.Role of Ca2+-activated Clchannels in the mechanism of apoptosis induced by cyclosporin A in a human hepatoma cell line[J].Biochem Biophys Res Commun,2003,309(2):291-297.
[5] Ise T,Shimizu T,Lee EL,et al.Roles of volume-sensitive Cl-channel in cisplatin-induced apoptosis in human epidermoid cancer cells[J].J Membr Biol,2005,205(3):139-145.
[6] Min XJ,Li H,Hou SC,et al.Dysfunction of volume-sensitive chloride channels contributes to cisplatin resistance in human lung adenocarcinoma cells[J].Exp Biol Med(Maywood),2011,236(4):483-491.
[7] Chen L,Wang L,Zhu L,et al.Cell cycle-dependent expression of volume-activated chloride currents in nasopharyngeal carcinoma cells[J].Am J Physiol Cell Physiol,2002,283(4):C1313-C1323.
[8] Hartzell C,Putzier I,Arreola J.Calcium-activated chloride channels[J].Annu Rev Physiol,2005,67:719-758.
[9] Liu W,Lu M,Liu B,et al.Inhibition of Ca2+-activated Cl-channelANO1/TMEM16A expressionsuppresses tumor growth and invasiveness in human prostate carcinoma[J].Cancer Lett,2012,326(1):41-51.
[10]高尚邦,李臣鸿.钙激活氯通道电生理特性及调节机制[J].现代生物医学进展,2009,9(1):160-163.
[11]陈丽新,王立伟,朱林燕,等.Cl-在鼻咽癌细胞调节性容积回缩中的作用[J].中国病理生理杂志,2002,18(5):43-46.
[12]毛建文,王立伟,孙雪荣,等.迁移的鼻咽癌细胞容积激活性氯电流(英文)[J].生理学报,2004,56(4):525-530.
[13]王立伟,陈丽新,朱林燕,等.抑制氯通道阻抑鼻咽癌细胞周期和细胞增殖[J].中国病理生理杂志,2004,20(5):14-17.
[14]范爱辉,陈丽新,毛建文,等.阻断氯通道对鼻咽癌细胞凋亡和细胞增殖的影响[J].广东医学,2006,27(12):1804-1806.
[15]向静瑶,胡代军,孙利华,等.Ca2+在鼻咽癌细胞凋亡性容积减小中的作用[J].肿瘤防治研究,2011,38(3):250-253.

