高交感活性诱导的大鼠心肌损伤模型中氧化应激的受体调控机制*
王 羿, 柏 帅, 徐旖旎, 江 滟, 陶 玲, 刘兴德, 沈祥春△
心血管疾病(cardiovascular disease,CVD)是由多种因素导致的、当今世界上威胁人类生命最严重的疾病之一。近年来心血管疾病的发生率呈逐渐增长的趋势,患者群体呈现出年轻化的趋势,严重威胁着人类的生活质量和寿命。高交感活性作为心血管系统疾患的关键因素备受关注[1]。大量研究证实,氧化应激贯穿于高交感活性诱发心血管系统疾病的全过程。但是,对高交感活性诱导氧化应激的产生机制,目前存在很大争议。很多资料认为,儿茶酚胺类物质的自身氧化是高交感活性诱导氧化应激的关键因素。本研究以NE复制心肌损伤模型,采用受体阻断剂系统分析氧化应激产生的根源[2],为临床高交感活性诱发心肌损伤受体依赖性提供新的理论与实验基础。
材料和方法
1 材料
1.1 动物 健康SD大鼠70只,雌雄各半,体重(220±10)g,购自贵阳医学院动物实验中心,动物合格证号为SCXK(黔)2012-001。
1.2 主要仪器 TDL-4ZB台式自动平衡离心机(湖南星科科学仪器有限公司);BS223S型电子分析天平(北京赛多利斯仪器有限公司);TGLL-18G台式高速冷冻离心机(太仓市医疗器械厂);722光栅分光光度计(上海第三分析仪器厂);XW80-A旋涡混合器(上海医科大学仪器厂)。
1.3 主要试剂 重酒石酸去甲肾上腺素(norepinephrine,NE)购自河南新宜医药集团精细化工有限公司;盐酸普萘洛尔(propranolol,Pro)购自上海辛帕斯制药有限公司;盐酸哌唑嗪(prazosin,Praz)购自北京双鹤现代医药技术有限责任公司;维生素E(vitamin E,VE)购自上海信谊延安药业有限公司;过氧化物酶(catalase,CAT)、微量丙二醛(malondialdehyde,MDA)、总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒和羟脯氨酸试剂盒(碱水解法)购自南京建成生物工程研究所。
2 方法
2.1 动物的分组与模型复制 为了探测高交感活性诱导心肌损伤的氧化应激与受体调控的关系,将实验分为以下 7 组,即 control、model、Pro、Praz、Pro+Praz、Pro+Praz+VE和VE组,每组10只健康SD大鼠。Control组腹腔注射生理盐水(normal saline,NS),其余均腹腔注射 NE 1.5 mg·kg-1,每天2次,连续腹腔注射16 d[3]复制心肌损伤模型。自造模之日起腹腔注射干预药物,每天2次,给药方法见表1。
大鼠均自由饮水进食,环境温度为(22±5)℃。末次给药60 min后,用10%水合氯醛进行麻醉。
2.2 体重变化的测定 注射NE后第3、6、9、12和15天各测1次体重,观察NE和药物对大鼠体重的影响。
2.3 心肌重量参数的测定 大鼠脱颈处死后,迅速开胸取出心脏,表面吸干后,称心脏重量,在冰冷环境下剪去心房及右心室后测左心室重量,计算全心指数及左心指数。全心指数=全心重(HW)/体重(BW),左心指数=左心室重(LVW)/体重(BW)。
2.4 病理组织学观察 待左心室称重完后,取左心室心尖部位一小块组织于10%中性甲醛溶液中固定,常规脱水、透明、浸蜡、包埋、4 μm厚切片用HE染色、封片,光镜下观察心肌病理变化。在BI2000型医学图像分析系统观察病理切片的心肌纤维及间隙的变化,并进行拍照。
2.5 左心室MDA、SOD和羟脯氨酸含量检测 取出大鼠左心室,以10倍量生理盐水在冰浴下制成10%的心脏匀浆,于4℃、1 000 r/min离心10 min弃去沉淀后,取上清按试剂盒说明测MDA、SOD和羟脯氨酸含量。
2.6 左心室 T-AOC和 CAT、GSH-Px、Na+-K+ATPase、Ca2+-Mg2+ATPase活性的检测 心脏匀浆方法同上,取上清按试剂盒说明书的操作步骤测定TAOC 和 CAT、GSH-Px、Na+-K+ATPase、Ca2+-Mg2+ATPase的活性。
3 统计学处理
数据用均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件分析,组间比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠体重的变化
连续腹腔注射 NE,第9、12天与对照组比较差异有统计学意义(P<0.05),第15天差异有统计学意义(P<0.01);第9、12、15天动物体重除 Pro+Praz+VE组和VE组外,其余各组动物体重均明显增加,与模型组比较差异显著(P<0.05或 P<0.01),见图 1。

Figure 1.Changes of the body weight of the rats in different groups.Mean±SD.n=10.*P<0.05,**P<0.01 vs model group;#P<0.05,##P<0.01 vs control group.图1 各组大鼠体重的变化
2 各种药物干预对NE诱导的心肌损伤大鼠全心指数、左心指数和羟脯氨酸含量的影响
NE(1.5 mg·kg-1)连续腹腔注射16 d后,模型组的HW/BW与LVW/BW较对照组显著增加(P<0.01);各给药组与模型组比较均明显降低全心及左心指数,差异有统计学意义(P<0.01),Pro+Praz降低效果最明显,且与Pro比较差异有统计学意义(P<0.01);模型组羟脯氨酸含量较对照组明显升高(P<0.01),各给药组羟脯氨酸含量较模型组有所下降(P<0.01),但组间差异无统计学意义(P>0.05),见表2。
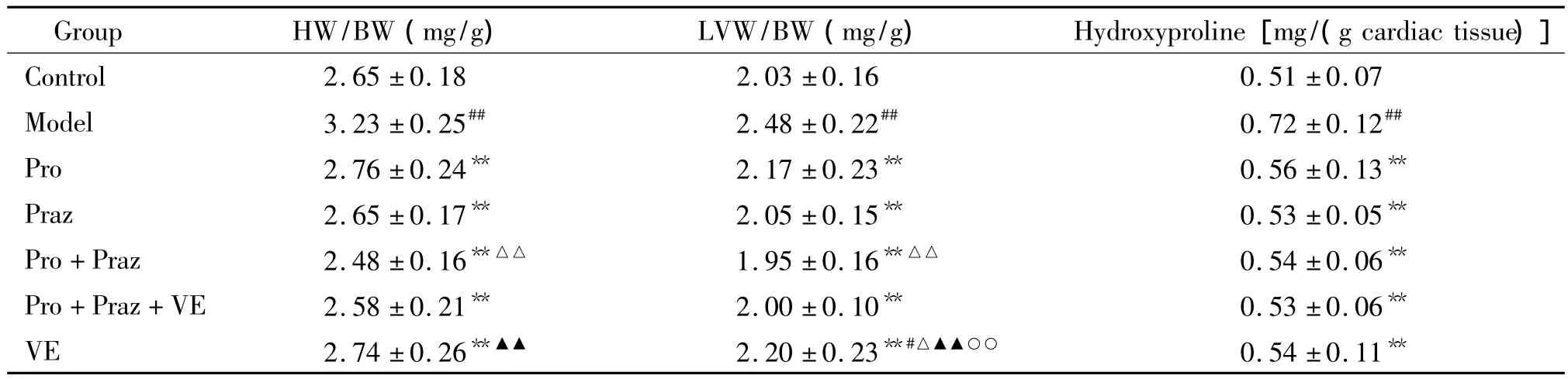
表2 各组大鼠心指数和羟脯氨酸含量的变化Table 2.Changes of rat heart indexes and the content of hydroxyproline (Mean±SD.n=10)
3 各组大鼠心肌病理组织学的变化
病理组织学检查结果显示,模型组心肌纤维增粗,细胞核有畸形,心肌横纹尚清,肌原纤维排列较松。采用BI2000型细胞医学图像分析系统可见模型组细胞间隙增加,心肌纤维排列紊乱等病理特征表现,而给药各组均具有不同程度的减轻,见图2。
4 各组大鼠心肌SOD活性和MDA含量的变化
连续给予NE 16 d后模型组的SOD活性较对照组明显降低(P<0.01),而MDA含量较对照组明显升高(P<0.01),除Pro+Praz+VE组外,各给药组的SOD活性均明显升高,与模型组比差异具有统计学意义,组间两两比较Pro+Praz组明显优于Pro+Praz+VE组(P<0.01);Pro+Praz组的MDA明显低于VE组 (P<0.05),见表3。

Figure 2.HE staining of rat myocardial tissues(×400).图2 大鼠心肌组织HE染色

表3 各组大鼠心肌SOD活力和MDA含量的变化Table 3.Changes of the activity of SOD and content of MDA in the rat myocardium(Mean±SD.n=10)
5 各组大鼠心肌CAT、GSH-Px活性和T-AOC的变化
连续给予NE 16 d后模型组的CAT、GSH-Px活性和T-AOC较对照组明显降低(P<0.01);Praz组、Pro+Praz组、VE组与模型组比较,CAT及GSH-Px活性有显著差异(P<0.05或P<0.01),Pro+Praz组的GSH-Px活性明显高于Pro组和Pro+Praz+VE组且差异有统计学意义(P<0.05);各给药组的TAOC较模型组均升高且差异显著(P<0.05或P<0.01),其中 Pro+Praz组升高最明显,与 Pro组和Praz组比较差异有统计学意义(P<0.05),见表4。

表4 各组大鼠心肌CAT、GSH-Px活性和T-AOC的变化Table 4.Changes of the activity of CAT and GSH-Px,and T-AOC in the rat myocardium[103U/(g protein).Mean ±SD.n=10]
*P <0.05,**P <0.01 vs model group;#P <0.05,##P <0.01 vs control group;△P <0.05 vs Pro group;▲P <0.05 vs Praz group;○P<0.05 vs Pro+Praz group.
6 各组大鼠心肌Na+-K+ATPase和Ca2+-Mg2+ATPase活性的变化
连续给予NE 16 d后,测定Na+-K+ATPase及Ca2+-Mg2+ATPase的活性显示,模型组较对照组明显降低,差异显著(P<0.01);Praz组和Pro+Praz组的Na+-K+ATPase及 Pro组、Praz组、Pro+Praz组 的Ca2+-Mg2+ATPase活性明显增加,与模型组比较差异显著(P<0.05或P<0.01),Praz组和Pro+Praz组的Na+-K+ATPase活性明显高于Pro+Praz+VE组(P<0.05或P<0.01),见表5。

表5 各组大鼠心肌Na+-K+ATPase和Ca2+-Mg2+ATPase活性的变化Table 5.Changes of the activity of Na+-K+ATPase and Ca2+-Mg2+ATPase[103U/(g protein).Mean±SD.n=10]
讨 论
心肌损伤发生的机制较为复杂,目前大量研究表明高血压、冠心病及心肌梗死等疾病过程中,血中儿茶酚胺水平增高,激动α和β受体,使交感活性增强,而长时间的高交感活性可进一步加重心血管疾病[4]。有文献报道,高交感活性诱发心血管系统疾病中存在氧化应激。本实验拟以肾上腺素受体阻断剂及抗氧化剂之间的系统分析,阐明受体阻断与氧化应激之间的关系。
本实验选采用的Pro是一个非选择性β受体阻断剂,Praz是α受体阻断剂,VE是与氧化应激密切相关的抗氧化剂。
对各组大鼠体重记录结果可以看出,高交感活性可以在一定程度上影响大鼠的生长,而给予受体阻断剂后,可改善其生长状况。
双重阻断剂组Pro+Praz降低心指数的效果最明显,且与Pro+Praz+VE组差异无统计学意义;各给药组的羟脯氨酸含量与模型组比较差异有统计学意义,提示阻断α和β受体能一定程度上降低氧化应激诱导的心肌重构。
ROS过量生成和(或)细胞内抗氧化防御系统的受损可引起氧化应激,对细胞产生多种毒性作用[5]。体内ROS主要包括O2-·、·OH、H2O2等。MDA是脂质过氧化产物,其含量反映脂质过氧化损伤的程度。SOD是体内一线清除ROS的酶类,SOD可以快速将O2-·转变成为相对活性较低的H2O2,进一步由CTA和GSH-Px降解。T-AOC是抗氧化能力指标;另一方面,适度的氧化应激状态可以刺激抗氧化酶的表达[6]。本实验结果表明,各给药组MDA含量均有不同程度降低,其中使用双重阻断剂Pro+Praz降低最明显;抗氧化指标SOD、CAT、GSH-Px及T-AOC的结果显示除Pro+Praz+VE组外其余各组均较模型组增高;说明Pro+Praz改善氧化损伤效果最好,提示高交感活性诱导心肌氧化/抗氧化失衡引起的氧化应激损伤与受体是密切相关的。
心肌Na+-K+ATPase通过分解ATP转运Na+-K+和Na+-Ca2+。Na+-K+ATPase酶活性下降会引起胞内Ca2+增加;Ca2+-Mg2+ATPase活性下降主要导致细胞内外Ca2+、Mg2+分布失衡,最终引起细胞内钙超载[7],而Ca2+是一种强解偶联剂,可使线粒体氧化磷酸化解偶联,造成能量障碍[8]。本实验结果证实模型组的ATPase活性较对照组明显降低且差异有统计学意义,Pro、Praz和Pro+Praz可以明显改善ATPase的活性。说明高交感活性可通过受体通路引起心肌能量代谢障碍损伤心肌。并且心肌钙超载、能量代谢障碍可激活心肌重构的下游通路,引发心肌肥厚。实验结果提示受体阻断药还能从能量代谢途径改善心肌重构。
高交感活性引起心肌氧化损伤的病理发展过程较复杂,涉及多种因素、多种通道共同参与。本实验结果提示,在高交感活性时,NE可通过 α-和β-AR通路引起心肌重构、氧化/抗氧化能力失调、能量障碍,而受体阻断药从这3个方面进行干预,证实高交感活性诱导大鼠心肌损伤模型中氧化应激与受体机制密切相关,这为临床合理用药提供了的理论支持与防治策略。
[1] 赵 智,孙 红.老年人中枢交感神经紧张性增加对心血管系统的影响[J].生理学研究进展,2007,38(4):379-382.
[2] Hašková P,Koubková L,Vávrová A,et al.Comparison of various iron chelators used in clinical practice as protecting agents against catecholamine induced oxidative injury and cardiotoxicity[J].Toxicology,2011,289(2-3):122-131.
[3] Shen XC,Qian ZY.Effects of corcetin on antioxidant enzymatic activities in cardiac hypertrophy induced by norepinephrine in rats[J].Phrmazie,2006,61(4):348-352.
[4] Seddon M,Looi YH,Shah AM.Oxidative stress and redox signalling in cardiac hypertrophy and heart failure[J].Heart,2007,93(8):903-907.
[5] 钟 亮,张 睿,纪晓军,等.胡黄连苷Ⅱ对大鼠脑缺血损伤后H2O2含量和CAT活性的影响[J].中国医药科学,2013,3(9):20-22.
[6] 张 凡,宋少莉,冯 阳,等.2-DG对肺腺癌A549细胞增殖的影响及其相关机制[J].肿瘤,2012,32(5):327-331.
[7] Jiang LP,Wang YY,Zhang CY,et al.Activity of adenosine triphosphatase and the expression of ryanodine receptor 1 mRNA in local tissue of pressure ulcer at early stage in gracilis of rats[J].Zhonghua Shao Shang Za Zhi,2011,27(3):178-204.
[8] 赵 斌,王礼春,庄晓东,等.缺氧易化快速起搏引起的心室肌细胞钙瞬变交替[J].中国病理生理杂志,2012,28(8):1405-1409.

