Survivin-2B诱导人乳腺癌细胞凋亡的初步研究*
张文峰, 贾 筠, 吴凤麟, 沈 晗, 邵红伟△,黄树林△
存活蛋白(survivin)作为凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族的成员,在多数人类肿瘤细胞中高表达,因在抑制细胞凋亡与调控细胞分裂中起着重要作用而被广泛研究[1-2]。近些年陆续发现了 survivin-2α、survivin-2B、survivin-ΔEx3 和 survivin-3B等剪接变异体[3-4]。与 survivin类似,sur-vivin-2B剪接变异体也含有4个外显子,只是在其中一个外显子中插入了一段69 bp的序列,它们蛋白序列仅为23个氨基酸的差异。研究表明survivin-2B具有诱导细胞凋亡的功能,仅在人类正常组织细胞中表达[5]。一段23个氨基酸的差异导致具有与survivin截然相反的功能,这已成为目前大家关注的焦点,但是具体分子机制尚不明确。本研究在人乳腺癌细胞株MCF7中过表达survivin-2B,诱导出现细胞凋亡与细胞周期阻滞,然后利用一种基于多重聚合酶链反应(multiplexpolymerasechain reaction,mPCR)的GeXP多基因遗传表达分析系统,分析21个肿瘤相关基因的表达变化情况,初步探讨survivin-2B诱导细胞凋亡的可能途径,为进一步研究survivin-2B的功能奠定基础。
材料和方法
1 材料和试剂
真核表达载体 pcDNA3.1载体、RNA提取的TRIzol试剂、脂质体转染试剂Lipofectamine 2000和细胞粉末培养基DMEM均购自Invitrogen;反转录试剂盒均购自TaKaRa;Taq聚合酶购自Thermo Fisher;293细胞(人胚肾上皮细胞)和MCF7细胞株由本实验室保存;Human Breast CancerPlex Kit购自Beckman。
Nanodrop 2000紫外分光光度计购自 Thermo,PCR仪为Biometra产品,GeXP系统及相关耗材均购自Beckman,台式离心机为 Thermo Fisher Scientific产品,流式细胞仪购自Beckman。
2 方法
2.1 细胞培养 37℃、5%CO2培养箱中用DMEM完全培养液(补加10%新生牛血清和2 mol/L谷氨酸)培养MCF7细胞。
2.2 细胞转染 按照Lipofectamine 2000试剂盒说明书进行脂质体包裹质粒转染MCF7细胞。
2.3 重组载体pcDNA3.1-survivin-2B的构建 Survivin-2B基因仅在人的正常细胞中表达,选取人的肾上皮细胞系293细胞,提取其总RNA进行反转录合成cDNA,以该cDNA为模板,PCR扩增survivin-2B片段,上游引物 5’-CCGGAATTCACCATGGGTGCCCCGACGTTG-3’,下游引物 5’-CCGCTCGAGTCAATCCATGGCAGCCAGC-3’。设计引物时,两端加EcoR I和Xho I酶切位点(见引物的下划线部分)。扩增条件:95 ℃ 45 s,58 ℃ 30 s,72 ℃ 1 min,30个循环。反应结束后,扩增产物于1.2%agarose凝胶电泳。扩增产物经DNA琼脂糖凝胶回收试剂盒提纯后,经EcoR I和 Xho I限制性内切酶酶切,与经EcoR I和Xho I酶切后的真核表达载体pcDNA3.1连接;转化DH5α感受态细胞,氨苄抗性筛选阳性克隆;扩大培养阳性克隆,经菌落PCR初步验证后,将候选重组载体送Invitrogen测序进一步验证直至重组表达载体pcDNA3.1-survivin-2B构建成功。
2.4 细胞凋亡的检测 将空载体pcDNA3.1及重组载体pcDNA3.1-survivin-2B转染48 h后的细胞用细胞刮小心刮下,800×g离心10 min,弃上清;PBS洗1次,800×g离心10 min弃上清;加2 mL结合缓冲液重悬细胞,800×g离心 10 min弃上清;加100 μL结合缓冲液重悬细胞,随后加入5 μL annexin V-PE,室温避光孵育15 min;加入2 mL结合缓冲液重悬细胞,800×g,离心 10 min弃上清;加500 μL结合缓冲液重悬细胞,随后加入5 μL 7-AAD,上流式细胞仪检测。
2.5 细胞周期的测定 胰酶适度消化细胞,用培养液吹打,800×g离心 10 min去上清;PBS洗1次,800×g离心10 min弃上清;加0.5 mL PBS吹匀;用5 mL注射器将细胞吸起,用力打入5 mL 70% 预冷乙醇中,4℃固定过夜;800×g离心15 min收集固定细胞,PBS洗2次;用0.4 mL PBS重悬细胞并转至试管中轻轻吹打;加RNase-A约3 μL至终浓度约为50 mg/L,37 ℃水浴消化30 min;加 PI约50 μL至终浓度约为65 mg/L,在冰浴中避光染色30 min;经尼龙网过滤,上流式细胞仪检测。
2.6 总RNA提取及第1链cDNA的合成 用DEPC处理的PBS将培养细胞洗2遍,总RNA提取按照Invitrogen试剂盒提供的方法进行,总RNA经浓度测定后,分别取 320 ng、160 ng、80 ng、40 ng、20 ng、10 ng、5 ng、2.5 ng和1.25 ng总 RNA,按照 PrimeScript II 1st Strand cDNA Synthesis Kit试剂盒说明书进行第1链cDNA合成,引物为贝克曼公司Human Breast Cancer-Plex Kit提供的有关25个基因特异性引物混合物。条件为:65℃ 5 min,50℃ 60 min,95℃ 5 min。
2.7 标准曲线的绘制 选取贝克曼库尔特公司Human Breast CancerPlex Kit,该试剂盒包含25个基因,其中3个为内参照基因,1个为内质控基因,21个肿瘤相关基因(见表1)。提取细胞总RNA并经紫外分光光度计定量,分别取 320 ng、160 ng、80 ng、40 ng、20 ng、10 ng、5 ng、2.5 ng 和 1.25 ng 总RNA,反转录cDNA后,通用引物(上游加荧光标记FAM)和特异性嵌合引物(5′末端连接通用引物序列)按一定比例分别加入,先由正、反向嵌合引物的特异性序列结合到cDNA模板启动PCR反应,经过数个循环后,分别扩增出上、下游通用引物的互补序列;最后再以此为模板,由通用引物主导,与其互补序列结合来进行扩增反应。本实验在一个体系同时进行25重PCR反应,每个目的基因PCR产物长度大小的差异可经毛细管电泳区分,其荧光的强度反映目的基因mRNA模板量。按照PrimeSTAR HS试剂盒说明书配制9管25 μL反应体系,每管多重体系反应包括:5 ×PrimeSTAR Buffer 5 μL,dNTP Mixture(各 2.5 mmol/L)2 μL,DNA polymerase(2.5 ×106U/L)0.25 μL,上、下游嵌合引物(各引物均为0.5 μmol/L)各取 1 μL,使反应体系 终 浓度为20 nmol/L,上游FAM标记荧光通用引物和下游通用引物(10 μmol/L)各取 2 μL,使反应体系终浓度800 nmol/L,模板 cDNA 1 μL,用不含核酸酶的水补至25 μL。对反应条件进行优化,最终确定反应条件为:98 ℃ 4 min,98 ℃ 10 s,58 ℃ 15 s,72 ℃ 40 s,35个循环,72℃ 10 min。扩增完成后取0.5 μL扩增产物,利用GeXP多基因表达分析系统检测每个基因的标准化荧光比值。
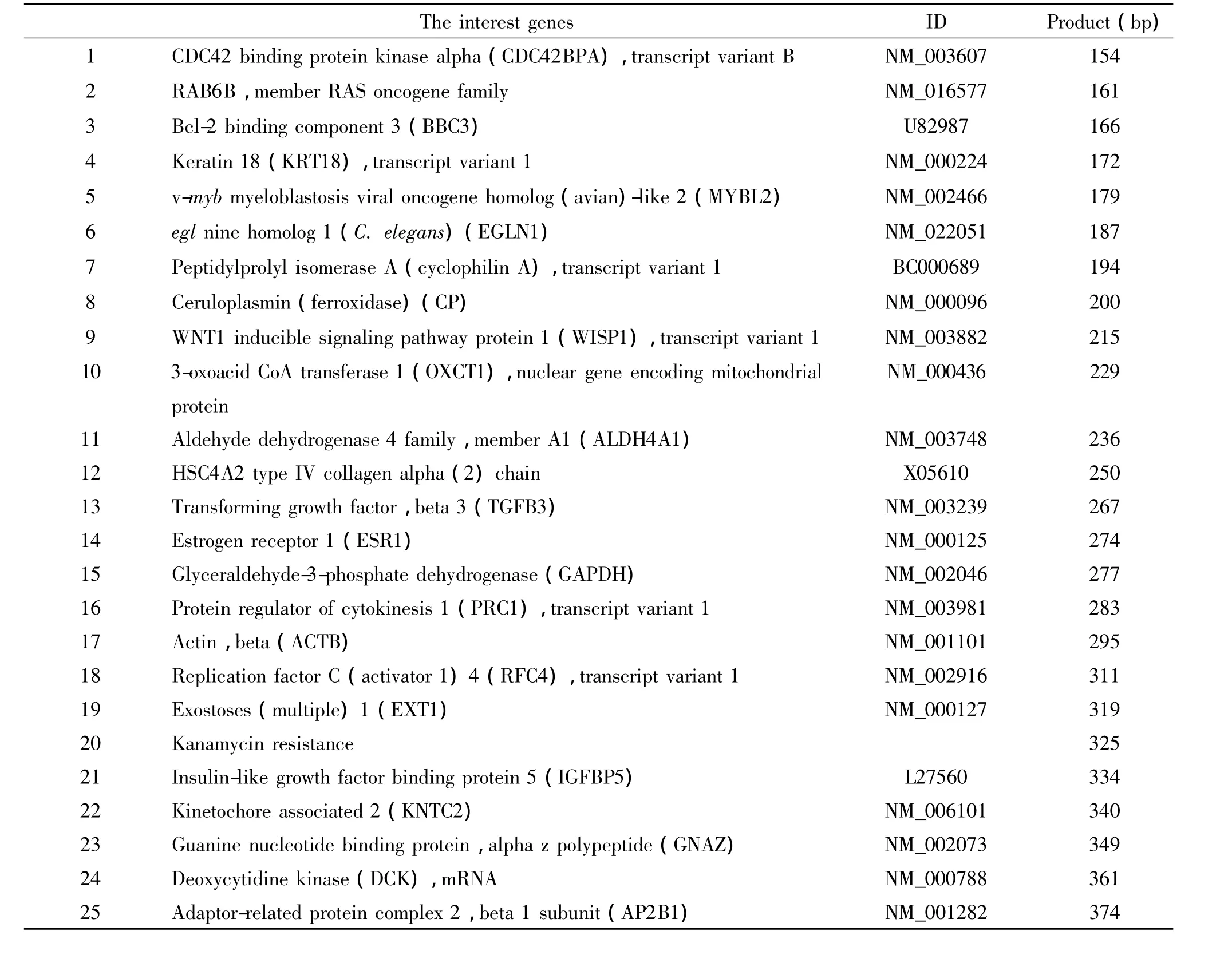
表1 目的基因的介绍Table 1.Introduction of the interest genes
3 统计学处理
采用SPSS 17.0统计软件包分析,数据以均数±标准差(mean±SD)表示,组间均数比较采用独立t检验。以P<0.05为差异有统计学意义。
结 果
1 重组载体pcDNA3.1-survivin-2B的构建及表达
Survivin-2B基因编码区长度为468个碱基,加上2条引物各自携带的12个碱基的酶切位点及保护碱基序列,扩增产物理论长度为492个碱基。PCR扩增survivin-2B基因片段的结果见图1A,在大约500 bp处获得条带,与预期大小相符合。将测序正确的重组表达载体pcDNA3.1-survivin-2B及空载体pcDNA3.1经脂质体转染MCF7细胞48 h后,提取MCF7细胞总RNA,以oligo(dT)为引物反转录合成cDNA;以该cDNA为模板,以survivin-2B基因特异性引物进行扩增验证,扩增产物于1.2%agarose凝胶电泳(图1B),仅在转染pcDNA3.1-survivin-2B重组质粒细胞中获得单一目的条带,而转染pcDNA3.1空载体的MCF7细胞中没有出现目的条带,表明survivin-2B基因在MCF7细胞中未发现本底表达,重组载体pcDNA3.1-survivin-2B转染MCF7细胞后,survivin-2B基因有效表达。
2 Survivin-2B引起肿瘤细胞凋亡与细胞周期阻滞
转染48 h后,相比于空载体pcDNA3.1转染对照组,survivin-2B转染组早期凋亡细胞比例显著增加(2.7%上升至10.3%),晚期凋亡细胞比例也有所提高(1.3%上升至10.4%),凋亡细胞比例显著增加(4.0%上升至20.7%),表明survivin-2B诱导细胞凋亡(图2)。相比于空载体pcDNA3.1转染对照组,survivin-2B转染组细胞周期中G2/M期的细胞比例明显增加(6.4%上升至22.4%),而G1期和S期的细胞比例未见显著变化,表明过表达survivin-2B基因能够引起细胞周期阻滞于G2/M期,见图3。

Figure 1. Construction of recombinant eukaryotic expression plasmid expressing survivin-2B(A)and its expression in MCF7 cells(B).M:DNA marker DL2000;1:survivin-2B gene;2:negative control.图1 重组载体pcDNA3.1-survivin-2B的构建及在MCF7细胞中的表达
3 标准曲线绘制
不同起始模板条件下,25个目的基因扩增后均有对应的标准化荧光比值,根据此数值绘制25个目的基因扩增的标准曲线,见表2。
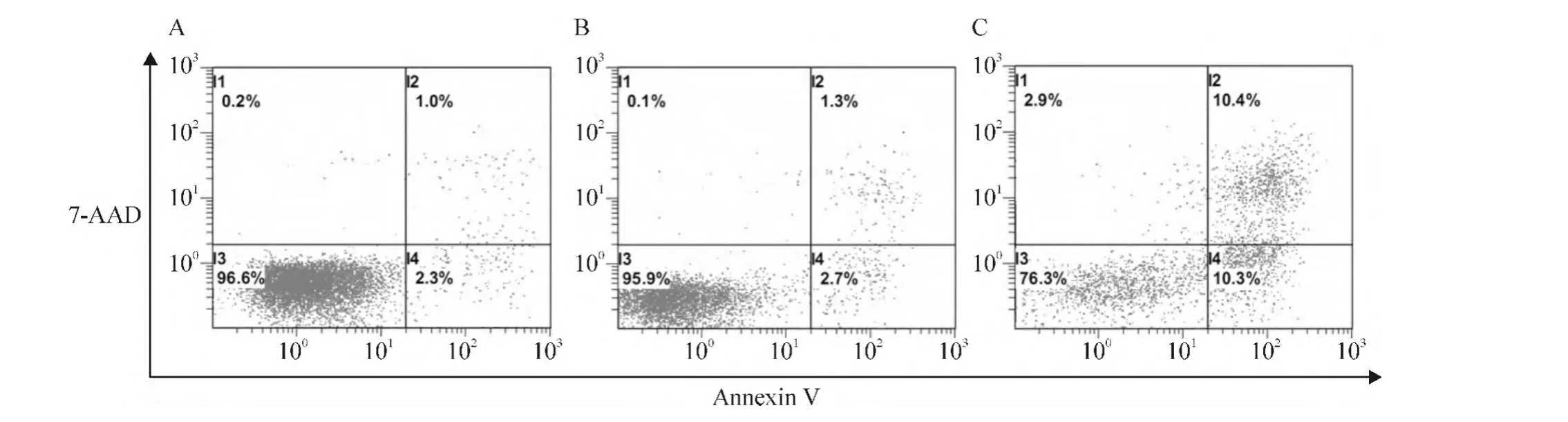
Figure 2.The apoptosis of MCF-7 cells was detected by flow cytometry after the gene transfection.A:MCF-7 cells;B:MCF-7 cells transfected with pcDNA3.1;C:MCF-7 cells transfected with pcDNA3.1-survivin-2B.图2 基因转染后的细胞凋亡的流式细胞术分析结果
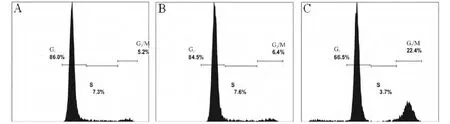
Figure 3.The cell cycle of MCF-7 cells transfected with survivin-2B.A:MCF-7 cells;B:MCF-7 cells transfected with pcDNA3.1;C:MCF-7 cells transfected with pcDNA3.1-survivin-2B.图3 基因转染后细胞周期的流式细胞术分析结果

表2 不同总RNA量条件下目的基因扩增后的标准化荧光比值Table 2.Normalized values of interest genes with different amounts of total RNA
4 肿瘤相关基因表达变化情况
总共有10个基因的表达差异有统计学意义,其中表达下调8个,表达上调2个;这10个基因在对照组与转染survivin-2B实验组中的标准化荧光比值均位于所对应标准曲线的检测范围内;表达变化最大的为醛脱氢酶4家族成员A1(aldehyde dehydrogenase 4 family member A1,ALDH4A1),表达下降48%;变化最小的为胞质分裂调控蛋白1(protein regulator of cytokinesis 1,PRC1),表达上调 1.08倍,见图4。
以往研究发现,EGLN1的缺失会抑制细胞内转化生长因子 β(transforming growth factor β,TGF-β)的表达以及 TGF-β蛋白的胞内加工[6];TGF-β能够诱导肿瘤细胞中醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)的表达上调,同时ALDH1的表达与抑制因子Bcl-2的表达呈正相关[7-8]。综合本研究结果,我们推测survivin-2B诱导细胞凋亡的可能途径为survivin-2B下调EGLN1的表达,EGLN1表达下降后导致TGF-β表达下调,然后导致ALDH1表达受到抑制,从而导致Bcl-2表达下降而诱导细胞凋亡,其有关该信号通路的细节有待进一步实验验证。

Figure 4.The changes of gene expression in the MCF-7 cells between the 2 groups.Mean±SD.n=3.*P<0.05,**P <0.01.图4 转染前后基因表达的变化
讨 论
基因表达分析的常用方法包括荧光定量PCR与Northern杂交。荧光定量PCR因操作简单、高灵敏度、实时检测等优点在基因表达分析中使用更广泛,但每个反应只能检测单个基因的缺点限制其在大样本量、多基因检测中的应用[9-10]。多基因表达分析系统是一种全新的基因表达谱定量分析平台,它采用特异性引物和荧光标记通用引物共用的方法,既保证高特异性扩增又能有效克服传统PCR因产物和引物差异导致的扩增效率不等引起的结果偏差,从而实现多重产物定量检测的目的[11-12]。
目前有关survivin-2B促细胞凋亡的分子机制并不清楚,本文利用survivin-2B在乳腺癌细胞株中过表达,成功诱导细胞凋亡以及细胞周期阻滞于G2/M期;同时利用多重PCR反应和荧光定量分析结合的方法,检测21个肿瘤相关基因的表达变化情况,其中8个基因表达下调,2个基因表达上调。这些基因编码的蛋白大多为参与细胞周期的调控蛋白以及胞内关键信号通路的节点蛋白,这些基因表达的变化与引起细胞凋亡、细胞周期阻滞有着密切关系。
以往研究结果表明,survivin-2B能够抑制细胞有丝分裂,诱导线粒体介导的细胞凋亡,并且上调促凋亡因子Bax的表达,下调凋亡抑制因子Bcl-2的表达[13],有关 survivin-2B下调 Bcl-2表达的具体机制并不清楚。根据GeXP多基因表达分析系统检测基因表达变化的结果,我们提出了关于survivin-2B下调Bcl-2表达的一个可能分子途径(见结果部分)。对于survivin-2B抑制EGLN1表达的具体分子机制有待深入研究,我们在前期研究中发现survivin-2B与survivin-ΔEx3在细胞质中存在较弱的相互作用[14],推测 survivin-2B 与 survivin-ΔEx3 可能通过相互结合形成某种蛋白复合体而抑制转录因子与EGLN1基因启动子的有效结合,从而导致EGLN1的表达下调。在细胞有丝分裂的DNA复制过程中,DNA聚合酶催化DNA链的延伸过程需要复制因子C(replication factor C,RFC)的参与[15],本研究发现survivin-2B诱导RFC的表达下调,导致DNA复制过程受到抑制,我们推测其也许与survivin-2B抑制细胞有丝分裂及诱导细胞周期阻滞有关,其具体机制有待研究。总之,本研究为survivin-2B诱导肿瘤细胞周期阻滞与细胞凋亡的分子机制研究提供了有益参考,为进一步研究survivin-2B的功能奠定了基础。
[1] Li F,Ambrosini G,Chu EY,et al.Control of apoptosis and mitotic spindle checkpoint by surviving[J].Nature,1998,396(6711):580-584.
[2] Altieri DC.Survivin,versatile modulation of cell division and apoptosis in cancer[J].Oncogene,2003,22(53):8581-8589.
[3] Vegran F,Boidot R,Oudin C,et al.Distinct expression of Survivin splice variants in breast carcinomas[J].Int J Oncol,2005,27(4):1151-1157.
[4] Li F,Ling X.Survivin study:an update of“what is the next wave?”[J].J Cell Physiol,2006,208(3):476-486.
[5] Li F.Role of survivin and its splice variants in tumorigenesis[J].Br J Cancer,2005,92(2):212-216.
[6] Wottawa M,Leisering P,von Ahlen M,et al.Knockdown of prolyl-4-hydroxylase domain 2 inhibits tumor growth of human breast cancer MDA-MB-231 cells by affecting TGF-β1 processing[J].Int J Cancer,2013,132(12):2787-2798.
[7] Ginestier C,Hur MH,Charafe-Jauffret E,et al.ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome[J].Cell Stem Cell,2007,1(5):555-567.
[8] 丹 令,孙爱军,王时俊,等.乙醛脱氢酶2在大鼠心肌缺氧损伤中的抗凋亡作用[J].中国病理生理杂志,2006,22(4):683-686.
[9] Wong ML,Medrano JF.Real-time PCR for mRNA quantitation[J].Biotechniques,2005,39(1):75-85.
[10] VanGuilder HD,Vrana KE,Freeman WM.Twenty-five years of quantitative PCR for gene expression analysis[J].Biotechniques,2008,44(5):619-626.
[11] Vansant G,Pezzoli P,Saiz R,et al.Gene expression analysis of troglitazone reveals its impact on multiple pathways in cell culture:a case for in vitro platforms combined with gene expression analysis for early(idiosyncratic)toxicity screening[J].Int J Toxicol,2006,25(2):85-94.
[12]Chen QR,Vasant G,Oades K,et al.Diagnosis of the small round blue cell tumors using multiplex polymerase chain reaction[J].J Mol Diagn,2007,9(1):80-88.
[13]Ling X,Cheng Q,Black JD,et al.Forced expression of survivin-2B abrogates mitotic cells and induces mitochondria-dependent apoptosis by blockade of tubulin polymerization and modulation of Bcl-2,Bax,and survivin[J].J Biol Chem,2007,282(37):27204-27214.
[14]邵红伟,张文峰,胡青莲,等.两种存活蛋白变异剪接体在HeLa细胞中的表达定位及相互作用[J].中国生物化学与分子生物学报,2009,25(12):1131-1136.
[15] Wood RD,Shivji MK.Which DNA polymerases are used for DNA-repair in eukaryotes? [J].Carcinogenesis,1997,18(4):605-610.

