烷基化低分子量聚乙烯亚胺作为基因递送载体的初步研究
柳珊,黄伟,金明姬,权修权,高钟镐
烷基化低分子量聚乙烯亚胺作为基因递送载体的初步研究
柳珊,黄伟,金明姬,权修权,高钟镐
100050 北京,中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室(柳珊、黄伟、金明姬、高钟镐);133000 吉林延吉,延边大学附属医院呼吸内科(权修权)
考察烷基化低分子量聚乙烯亚胺作为基因递送载体的安全性和有效性。
以1-溴十二烷和分子量为 1800 的分枝状 PEI(bPEI1.8K)为原料,合成 bPEI1.8K-C12,并用1H-NMR 对其结构进行确认;采用 MTT 法考察 bPEI1.8K-C12的细胞毒性;红细胞溶血实验考察 bPEI1.8K-C12的生物相容性;测定 bPEI1.8K-C12/DNA 复合颗粒的粒径分布和 zeta 电位;采用激光共聚焦显微镜观察 bPEI1.8K-C12/DNA 复合颗粒的细胞摄取行为;采用琼脂糖凝胶阻滞电泳考察 bPEI1.8K-C12对 DNA 的固缩能力;并用荧光素酶报告基因和绿色荧光蛋白报告基因考察 bPEI1.8K-C12的体外转染效率。
经1H-NMR 确认,成功合成了 bPEI1.8K-C12;MTT 结果表明 bPEI1.8K-C12对人乳腺癌 MCF-7 细胞的毒性与bPEI1.8K相当;红细胞溶血实验结果表明高浓度 bPEI1.8K-C12静脉注射时具有潜在溶血性;质量比相同时,bPEI1.8K-C12/ DNA 复合颗粒的平均粒径和 zeta 电位均比相应的 bPEI1.8K/DNA 大;烷基化修饰后,bPEI1.8K-C12对 DNA 的固缩能力降低,MCF-7 细胞对 bPEI1.8K-C12/DNA 复合颗粒的摄取效率大大增加,bPEI1.8K-C12递送报告基因质粒的体外转染效率显著高于 bPEI1.8K,甚至与 lipofectamine2000 相当。
bPEI1.8K-C12是一种安全高效的基因递送载体,具有较高的进一步开发前景。
聚乙烯亚胺; 抗肿瘤药,烷基化; 基因递送; 基因疗法
基因疗法[1-2]是一种治疗多种先天和后天疾病的有力工具,其在肿瘤治疗中的应用方兴未艾。如何实现基因药物安全有效的体内递送是基因治疗的一大技术瓶颈。目前常用的基因递送载体可以分为重组病毒载体和人工合成载体(非病毒载体)。病毒载体转染效率高,但是制备及纯化困难,携载基因容量小,且具有潜在致病性。非病毒载体被认为是比病毒载体更理想的基因药物输送载体。在众多非病毒载体中,聚乙烯亚胺(polyethyleneimine,PEI)是目前研究最广泛的聚阳离子非病毒载体[3]。然而,未经改性的 PEI 存在转染活性-毒性的相互制约关系,即 PEI 分子量越大,转染活性越高,但同时毒性也越大。
目前,各国学者正致力于 PEI 的化学改性;现有研究多是针对高分子量 PEI,如采用聚乳酸-羟基乙酸共聚物(PLGA)、肝素、透明质酸、PEG 等对 PEI 进行化学改性,提高其转染活性的同时降低毒性;而对小分子量 PEI 的化学改性研究相对较少。普遍认为低分子量的 PEI(Mw ≤ 2000)细胞毒性较小,但其转染效率低下。麻省理工大学的 Klibanov 和 Thomas 研究小组对分子量为 2000 的 PEI 进行烷基化修饰[4],发现其在有血清条件下的转染效率是修饰前的 400 倍,是体外转染金标准(分子量为 25 000 的分枝状 PEI)的6 倍,说明低分子量 PEI 通过一定的化学改性也可以成为安全、高效的基因递送载体,但该研究并未对烷基化低分子量 PEI 作为基因递送载体的理化特征进行深入研究。本研究选择对分子量为 1800 的分枝状 PEI(bPEI1.8K)进行烷基化修饰,并考察了烷基化修饰后的 bPEI1.8K-C12作为基因递送载体的安全性和有效性。
1 材料与方法
1.1 材料
1.1.1 试剂 bPEI1.8K(99%)为Alfa Aesar 天津化学有限公司产品;1-溴十二烷(99%)、MTT、4-羟乙基哌嗪乙磺酸(HEPES)、异硫氰酸荧光素(FITC)均为美国Sigma 公司产品;DMEM 培养基、胎牛血清(FBS)为美国 Hyclone 公司产品;HBS 缓冲液(20 mmol/L HEPES,150 mmol/L NaCl,pH = 7.4)自制;其他试剂均为分析纯。
1.1.2 仪器 分析电子天平购自瑞士 Mettler Toledo 仪器公司;数显加热磁力搅拌器购自德国 IKA 公司;R210/R215 旋转蒸发仪购自瑞士 Buchi 公司;Zetasizer Nano ZS 型激光粒度测定仪购自英国 Malvern 公司;Nicomp-380 型激光粒度仪购自美国 PSS 公司;Bio-Best 135A 型凝胶成像仪购自美国 Simon 公司;TCS-SP2 型激光共聚焦显微镜购自德国 Leica 公司;Glomax 生物发光检测仪购自美国 Promega 公司;Spectra Max 190 型酶标仪购自美国 MD 公司;IX71 倒置荧光显微镜购自日本 Olympus 公司。
1.1.3 细胞 人乳腺癌细胞株 MCF-7 购自中国医学科学院基础医学研究所;37 ℃、5% CO2条件下培养于添加有 10% FBS 的 DMEM 培养基中,取对数生长期细胞进行实验。
1.2 方法
1.2.1 烷基化 bPEI1.8K(bPEI1.8K-C12)的合成与鉴定[5]称取 bPEI1.8K1 g溶于 100 ml 二氯甲烷和甲醇(V/V 为 95:5)的混合溶剂中,在30 ℃下搅拌溶解。称取 1-溴十二烷 0.7245 g 溶于 50 ml 的二氯甲烷和甲醇(V/V 为 95:5)的混合溶剂中,以 10 ml/h 的速度滴加至上述聚乙烯亚胺溶液中,在40 ℃下,避光反应 24 h;旋转蒸干溶剂得到淡黄色半固体膏状物,将其混悬于 6 ml 蒸馏水中,然后用截留分子量为 1000 的透析袋在 40% 的乙醇溶液中透析 6 次,再在去离子水中透析 24 h,将透析后得到的物质冷冻干燥 48 h 后,制得 bPEI1.8K-C12。取冻干后 bPEI1.8K-C12约15 mg 溶解于约 0.6 ml 重水中,采用 400 MHz 的核磁共振氢谱(1H-NMR)进行结构确认。
1.2.2 体外细胞毒性实验 将 MCF-7 细胞以5 × 103个/孔密度接种于 96 孔板中,培养 24 h 后,吸弃旧培养基,分别加入含 5 或 10 μg/ml bPEI1.8K-C12的 DMEM 培养基(含 10% FBS)200 μl,继续培养 24 或 48 h 后,吸弃旧培养基,每孔分别加入含 0.5 mg/ml 的 MTT 的培养基 100 μl 继续培养 4 h 后,吸弃溶液,加入 150 μl DMSO 溶解甲瓒结晶,然后用酶标仪测定各孔在 570 nm 处的值,以未加药物作用的孔的值作为对照,计算MCF-7 细胞在不同作用时间和不同bPEI1.8K-C12浓度条件下的存活率,每组实验设置4 个重复孔。
1.2.3 溶血实验 将经过肝素处理的新鲜收集的大鼠红细胞用 pH 7.4 等渗 PBS 离心洗涤 3 个循环,然后用 pH 7.4 HBS 缓冲液将红细胞稀释成浓度为 1 × 109个/ml 红细胞悬液,分别取 75 μl 上述红细胞悬液与 75 μl 含不同浓度 bPEI1.8K-C12的 pH 7.4 HBS 溶液混合,37 ℃振荡 60 min,离心后取 80 μl 上清液测定血红蛋白的浓度(450 nm),分别以 pH 7.4 HBS 和 1% triton X-100 为阴性对照和阳性对照,计算各浓度 bPEI1.8K-C12的红细胞裂解效率。
1.2.4 bPEI1.8K-C12/DNA 复合颗粒的制备 依照 bPEI1.8K-C12与 DNA 的质量比,将 20 ng/μl 的荧光素酶报告基因质粒 pGL4.5 的 HBS 溶液与等体积含不同浓度 bPEI1.8K-C12的 HBS 溶液混匀后,室温孵育 20 min,得到 bPEI1.8K-C12/DNA 复合颗粒。
1.2.5 琼脂糖凝胶阻滞电泳 依照上述 PEI/DNA 复合颗粒的制备方法,制备和bPEI1.8K-C12与 pGL4.50 质粒的质量比分别为 0.1、0.2、0.4、0.6、0.8、1.0 的 bPEI1.8K/DNA 和 bPEI1.8K-C12/DNA 复合颗粒。将制备好的不同质量比的复合颗粒与适量上样缓冲液混合后加样于 1% 琼脂糖凝胶中,80 V 条件下电泳 60 min,然后在 0.5 μg/ml 溴化乙锭(EtBr)溶液中染色 30 min,采用凝胶成像仪观察结果。
1.2.6 粒径及 zeta 电位测定 依照上述方法制备 bPEI1.8K-C12与 pGL4.50 质粒的质量比分别为 1、5、10、15、20 的 bPEI1.8K-C12/DNA 复合颗粒。将复合颗粒适度稀释后,制备介质和稀释介质均为 pH 7.4 的 HBS 缓冲液,最后采用激光粒度测定仪测定各复合颗粒的粒径分布及 zeta 电位。
1.2.7 细胞摄取试验 将 MCF-7 细胞以 5 ×104个/孔密度接种于铺有无菌圆形盖玻片的 24 孔板中,培养 24 h 后,吸弃旧培养基,分别用无血清 DMEM 培养基洗 2 次后,用不含血清的 DMEM 培养基在37 ℃预培养 1 h 后[6],吸弃旧培养基,然后每孔分别加入含 FITC 标记的 bPEI1.8K/DNA 或 bPEI1.8K-C12/DNA 复合颗粒的无血清 DMEM 培养基 200 μl,继续培养 4 h 后,吸弃旧培养基,用冷 PBS 洗涤细胞 3 次,细胞用 4% 多聚甲醇固定 10 min,冷 PBS 洗涤细胞3 次,细胞核用5 μg/ml 的 Hoechst33258 37 ℃染色 15 min 后,用冷 PBS 洗涤细胞 3 次,激光共聚焦显微镜观察细胞摄取情况。
1.2.8 体外细胞转染 采用荧光素酶报告基因质粒(pGL4.50)考察体外转染效率。将 MCF-7 细胞以 5 × 103个/孔的密度接种于 96 孔中。依照上述方法制备质量比分别为 1:1、3:1、5:1 的 bPEI1.8K/pGL4.50 和 bPEI1.8K-C12/pGL4.50 复合颗粒。96 孔板中细胞培养 24 h 后,吸弃旧培养基,用 PBS 洗涤 2 次,每孔加入 80 μl 含 10% FBS 的 DMEM 培养基,然后每孔加入含有 100 ng pGL4.50 的复合颗粒溶液 20 μl,每组设置 4 个复孔。培养 24 h 后,吸弃旧培养基,用 PBS 洗2 次,每孔加入 1 × 细胞裂解液 20 μl,37 ℃振摇 15 min 后,每孔取 10 μl 裂解液加入 50 μl 荧光素酶底物,用发光检测仪测定每孔荧光素酶活力,计算转染效率,同时用 BCA 蛋白定量试剂盒测定每孔的蛋白含量,最终计算每孔单位蛋白含量的荧光素酶的表达(每毫克蛋白的荧光素酶活力)。以 lipofectamine2000 作为阳性对照。
采用绿色荧光蛋白基因质粒pEGFP 考察体外转染效率。将 MCF-7 细胞以 4 × 104个/孔的密度接种于 24 孔中。依照上述方法制备质量比为 5:1 的 bPEI1.8K/pEGFP 和 bPEI1.8K-C12/pEGFP 复合颗粒。24 孔板中细胞培养 24 h 后,吸弃旧培养基,用 PBS 洗涤 2 次,每孔加入 160 μl 含 10% FBS 的 DMEM 培养基,然后每孔加入含有 400 ng pEGFP 的复合颗粒溶液 40 μl。培养 24 h 后,采用倒置荧光显微镜观察绿色荧光蛋白的表达。以 lipofectamine2000 作为阳性对照,每组设置 3 个复孔。
1.3 统计学处理
2 结果
2.1 bPEI1.8K-C12的合成与鉴定
采用 1-溴十二烷对 bPEI1.8K进行烷基化修饰,bPEI1.8K-C12的1H-NMR 图谱见图 1。从图 1 可知,化学位移 2.5 ~ 2.9 ppm 区段的宽峰归属于 bPEI1.8K母体中的氢;化学位移 0.92 ppm 和 1.31 ppm 处的宽单峰分别归属于(-CH3)和 -(CH2)11-,表明十二烷基已成功接枝于 bPEI1.8K上。理论上,图 1 中,化学位移 0.92 ppm(-CH3)和 1.31 ppm(-(CH2)11-)处的峰应为多重峰,但是由于 bPEI1.8K-C12为高分子聚合物,其核磁氢谱谱图中的特征峰没有小分子化合物那么典型;且本文采用的是 400 MHz 核磁,在这种电磁辐射频率条件下,由于灵敏度限制,没有观察到精细的峰裂分(多重峰)。根据图 1 中归属于 CH3和 bPEI 各峰的峰面积比值[7],计算得出 bPEI1.8K-C12中十二烷基(C12)的取代度为 13.44。
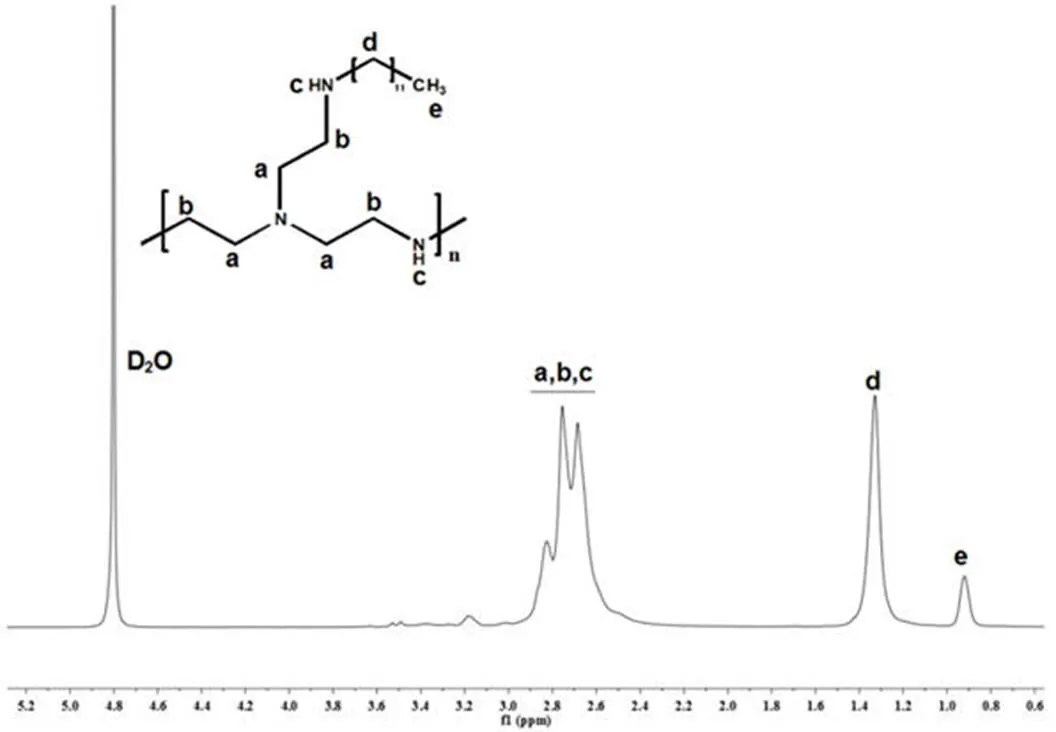
图 1 bPEI1.8K-C12的核磁氢谱图
Figure 11H-NMR of bPEI1.8K-C12
2.2 bPEI1.8K-C12体外细胞毒性实验
为了评价 bPEI1.8K-C12递送质粒 DNA 转染乳腺癌细胞的效率,为以后应用 bPEI1.8K-C12递送功能性质粒 DNA 治疗乳腺癌奠定基础。采用 MTT法考察 bPEI1.8K-C12对人乳腺癌细胞株 MCF-7 细胞的毒性[8],并与未修饰的 bPEI1.8K进行比较,结果见图 2。从图 2 可知,10 μg/ml 的 bPEI1.8K-C12作用 MCF-7 细胞 48 h 后,细胞活力略有降低(84%),但与相应条件下的 bPEI1.8K相比,两者对MCF-7 细胞活力的影响并无显著性差异(> 0.05);5 μg/ml 的 bPEI1.8K-C12作用MCF-7 细胞 24 或 48 h 对其细胞活力的影响与未修饰的bPEI1.8K相当,MCF-7 细胞的增殖能力几乎不受影响。另外,在体外转染中,当 bPEI1.8K-C12与 DNA 的质量比为 5:1 时,bPEI1.8K-C12实际作用细胞的浓度为5 μg/ml,在整个 24 h 转染过程中,MCF-7 细胞均可保持很好的细胞活力。以上结果说明,烷基化修饰并未增加 bPEI1.8K的毒性,bPEI1.8K-C12作为基因递送载体具有很高的安全性。
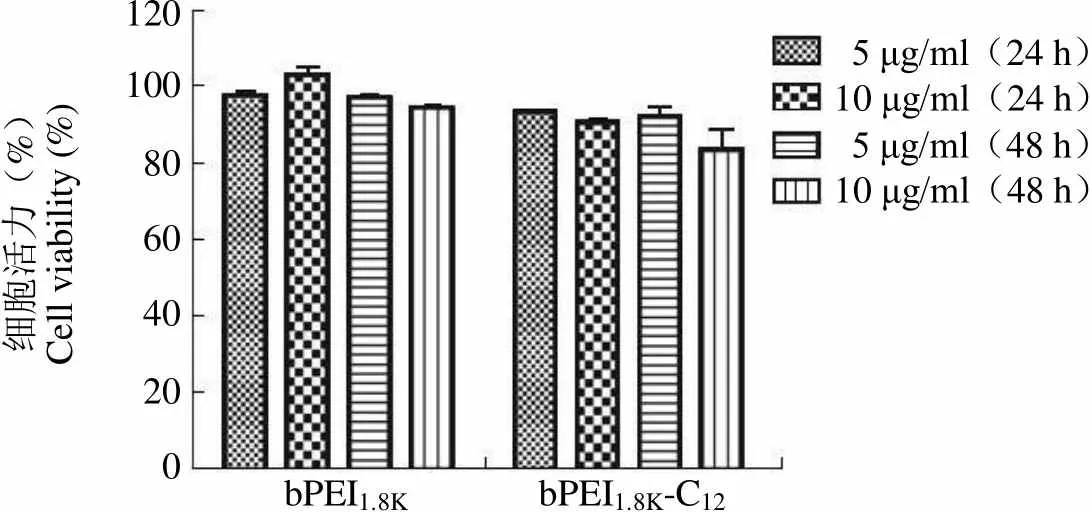
细胞活力(%)Cell viability (%)120 100 80 60 40 20 0 5 μg/ml(24 h)10 μg/ml(24 h)5 μg/ml(48 h)10 μg/ml(48 h) bPEI1.8K bPEI1.8K-C12
Figure 2 Cytotoxicity of bPEI1.8K-C12and bPEI1.8Kon MCF-7 cells
2.3 溶血实验
采用大鼠红细胞的溶血实验检测 bPEI1.8K-C12裂解红细胞膜的能力[9],考察 bPEI1.8K-C12的生物相容性,评价其体内应用安全性。由表 1 可知,bPEI1.8K-C12和 bPEI1.8K的红细胞裂解效率均呈现一定的浓度依赖性,随着浓度的增大,两者的红细胞裂解效率均有不同程度的提高,且 bPEI1.8K-C12红细胞裂解效率随浓度增大的趋势比 bPEI1.8K强;另外,在相同浓度条件下,bPEI1.8K-C12的红细胞裂解效率比 bPEI1.8K高,但两者之间并不存在显著性差异(> 0.05)。以上结果说明,体内经静脉系统注射高浓度 bPEI1.8K-C12具有一定的潜在溶血性,在不影响转染效率的前提下,应尽量使用较低浓度的 bPEI1.8K-C12。
2.4 琼脂糖凝胶阻滞电泳
烷基化修饰后,会使 bPEI1.8K的部分伯胺变为仲胺基,降低其电荷密度和对 DNA 的固缩能力。采用琼脂糖凝胶电泳分别考察 bPEI1.8K和 bPEI1.8K-C12对质粒 DNA 的固缩能力,结果见图 3。从图 3 可知,要完全固缩(包裹)DNA,bPEI1.8K和 bPEI1.8K-C12与 DNA 的最小质量比应分别为 0.4和 0.8。以上结果表明烷基化修饰减弱了 bPEI1.8K固缩 DNA 的能力,这与文献[10]研究结果一致。
2.5 粒径及 zeta 电位测定
bPEI1.8K-C12/DNA 和 bPEI1.8K/DNA 复合颗粒在不同质量比时的粒径分布和 zeta 电位结果见表 2。从表 2 可知,随着质量比的增大,bPEI1.8K- C12/DNA 和bPEI1.8K/DNA 复合颗粒的平均粒径和 zeta 电位都逐渐增大,当质量比≥ 15 时,两者的平均粒径和 zeta 电位都趋于恒定。另外,当质量比相同时,bPEI1.8K-C12/DNA 的平均粒径均高于同条件下的 bPEI1.8K/DNA,更进一步印证了烷基化修饰后,bPEI1.8K-C12对 DNA 的固缩能力比 bPEI1.8K低。另外,bPEI1.8K-C12/DNA 的 zeta 电位均比相应条件下 bPEI1.8K/DNA 高,且当质量比≥ 5 时,bPEI1.8K-C12/DNA 的 zeta 电位的平均值大大高于 bPEI1.8K/DNA,提示 bPEI1.8K-C12/DNA 复合颗粒在溶液中具有较高的稳定性。
2.6 细胞摄取试验
PEI/DNA 复合颗粒能被细胞有效摄取是其实现高效转染的先决条件,因此用 FITC 分别对bPEI1.8K和 bPEI1.8K-C12进行荧光标记[11],依照前述方法分别制备bPEI1.8K/DNA 和 bPEI1.8K-C12/ DNA 复合颗粒,采用激光共聚焦显微镜观察了PEI/DNA 复合颗粒的细胞摄取情况。从图 4 可知,转染 4 h 后,MCF-7 细胞对bPEI1.8K/DNA 复合颗粒的摄取量很低,细胞内仅有少量的绿色荧光;而 MCF-7 细胞对bPEI1.8K-C12/DNA 复合颗粒的摄取量大大增加,细胞内可见大量蓄积的绿色荧光,并且部分绿色荧光位于细胞核中。以上结果表明,烷基化修饰大大增加了细胞对 bPEI1.8K-C12/DNA 复合颗粒的摄取效率。烷基化修饰后,增加了 bPEI1.8K的疏水性,从而提高了 bPEI1.8K-C12与细胞膜的亲和力[12],使 bPEI1.8K-C12/DNA 复合颗粒更易被细胞摄取。
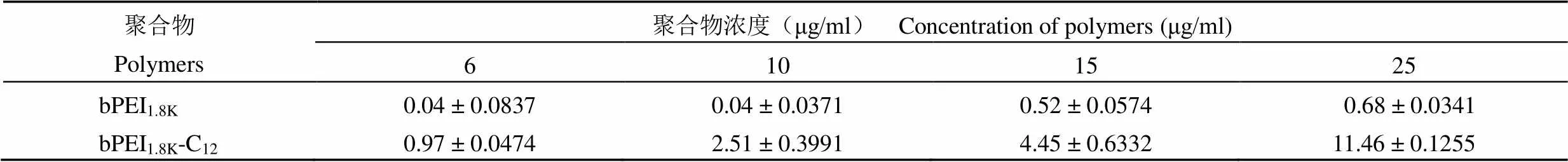
表 1 bPEI1.8K-C12和 bPEI1.8K的红细胞裂解效率(%)
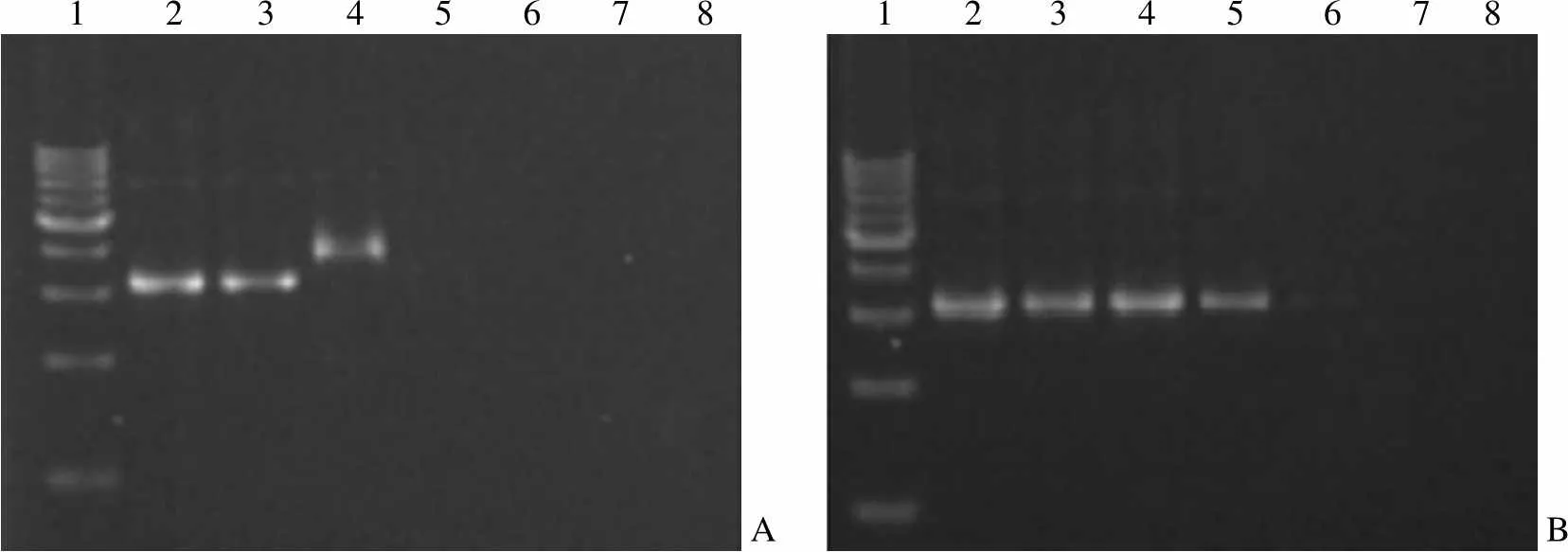
1 2 3 4 5 6 7 8 1 2 3 4 5 6 7 8 AB
Figure 3 Gel retardation assay of bPEI1.8K-C12and bPEI1.8K(A: bPEI1.8K; B: bPEI1.8K-C12; 1: 1000 bp DNA marker; 2: Naked DNA; 3: w/w=0.1; 4: w/w=0.2; 5: w/w=0.4; 6: w/w=0.6; 7: w/w=0.8; 8: w/w=1.0)

表 2 bPEI1.8K-C12/DNA 和 bPEI1.8K/DNA 复合颗粒的粒径和 zeta 电位
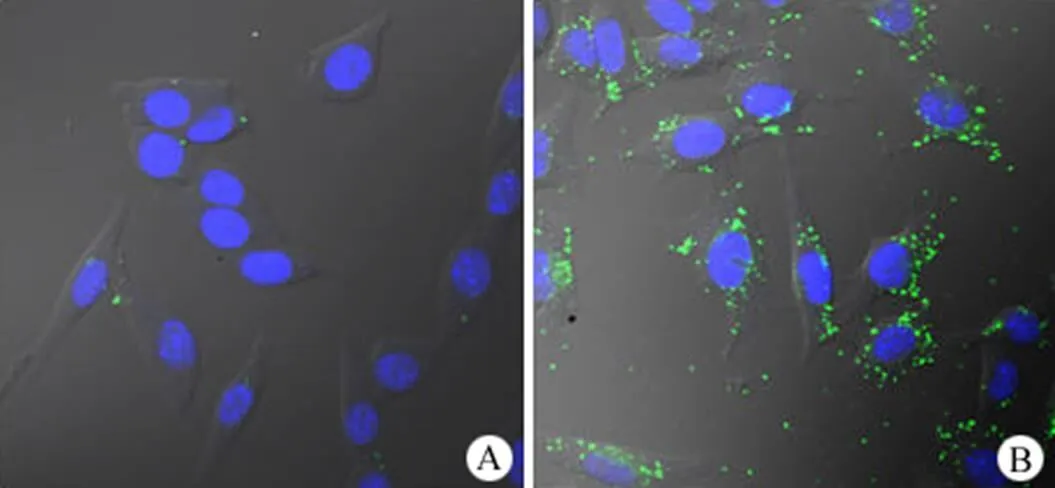
图 4 bPEI1.8K/DNA(A)和 bPEI1.8K-C12/DNA(B)复合颗粒的细胞摄取
Figure 4 Cellular uptakes of bPEI1.8K/DNA (A) and bPEI1.8K- C12/DNA (B) polyplexes
2.7 体外细胞转染
本研究分别采用两种报告基因(荧光素酶基因质粒 pGL 4.50 和绿色荧光蛋白基因质粒pEGFP)考察 bPEI1.8K-C12在有血清条件下递送质粒 DNA 的体外转染效率,结果分别见图 5、6。从图 5 可知,分别用三种质量比的 bPEI1.8K/DNA 复合颗粒转染 MCF-7 细胞 24 h 后,细胞内的荧光素酶表达量均很低;而当用质量比为 3:1 和 5:1 的bPEI1.8K-C12/DNA 复合颗粒转染细胞时,细胞内的荧光素酶表达量显著增加,甚至略高于市售lipofectamine2000 组的胞内荧光素酶表达量。当采用 pEGFP 报告基因考察 bPEI1.8K-C12体外转染效率时,bPEI1.8K-C12可以使 pEGFP 在细胞内高效表达(图 6),其转染效率与市售 lipofectamine2000 相当。以上结果表明,烷基化修饰大大增强了 bPEI1.8K-C12递送质粒DNA 的体外转染效率。

荧光素酶活力(U/μg)Luciferase activity (U/μg)1.5 × 106 1.0 × 106 0.5 × 106 0 1:1 3:1 5:1 1:1 3:1 5:1 lipo bPEI1.8K bPEI1.8K-C12 2000
Figure 5 Luciferase activity of MCF-7 cells 24 h post-transfection with bPEI1.8K/DNA and bPEI1.8K-C12/DNA polyplexes encoding luciferase (*Compared with bPEI1.8Kof the same weight ratio,< 0.01)
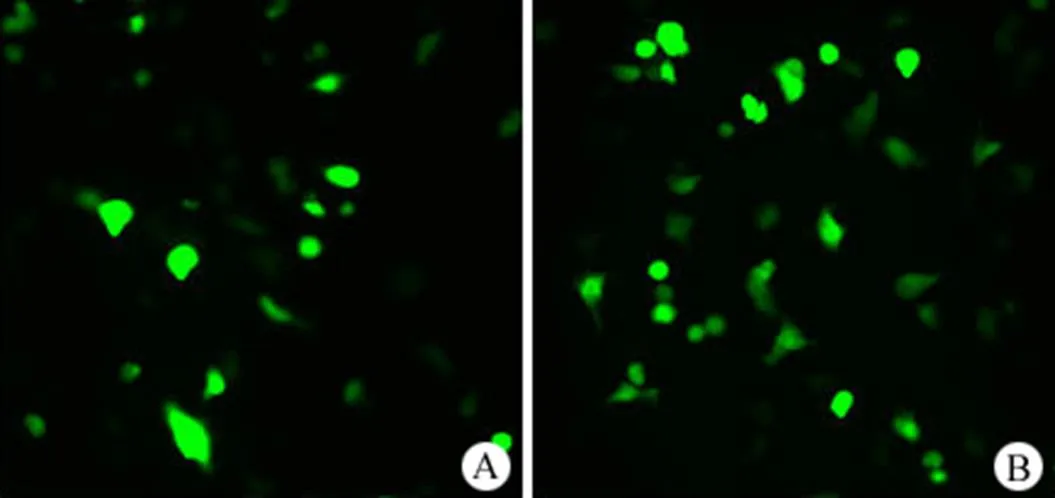
图 6 MCF-7 细胞转染bPEI1.8K-C12/DNA(A)和 lipofectamine2000/DNA(B)复合颗粒 24 h 后的绿色荧光表达
Figure 6 GFP expression in MCF-7 cells 24 h post- transfection with bPEI1.8K-C12/DNA polyplexes (A) and lipofectamine2000/DNA lipoplexes (B)
3 讨论
本研究采用十二烷基接枝低分子量 PEI,得到烷基化修饰的 bPEI1.8K-C12,初步考察了 bPEI1.8K- C12作为基因递送载体的安全性和有效性。体外增殖抑制实验的结果表明,烷基化修饰后,bPEI1.8K- C12很好地保留了 bPEI1.8K的低毒性;但是溶血实验的结果提示高浓度 bPEI1.8K-C12体内系统给药时具有潜在溶血可能性。因此,为了保证安全性,bPEI1.8K-C12可以局部注射给药;或者进一步通过 PEG、PLGA、肝素或壳聚糖等化学修饰或 PLGA 物理包裹等方式提高其生物相容性,以便经静脉系统给药。
琼脂糖凝胶阻滞电泳的结果表明,烷基化修饰后,bPEI1.8K-C12对 DNA 的固缩能力降低了。另外,bPEI1.8K-C12/DNA 复合颗粒的平均粒径比相应 bPEI1.8K/DNA 的平均粒径大,也间接佐证了烷基化修饰降低了 bPEI1.8K与 DNA 的固缩能力。现有研究表明,PEI 的转染效率与其对 DNA 的固缩能力之间并不存在直接的必然联系,只有当 PEI 与 DNA 维持一个理想的离解/固缩平衡,即 PEI 能在细胞外稳定固缩 DNA,且能在细胞内有效离解 DNA才可以达到较高的转染效率[13]。bPEI1.8K-C12固缩 DNA 的能力虽然比 bPEI1.8K弱,但是 bPEI1.8K-C12的体外基因转染效率却显著高于 bPEI1.8K,甚至与市售转染试剂 lipofectamine2000 相当。bPEI1.8K-C12体外基因转染效率高的原因可能有以下三点:①烷基化修饰增强了 bPEI1.8K-C12与细胞膜的亲和力,使细胞对 bPEI1.8K-C12/DNA 复合颗粒的摄取效率大大增加;②在细胞内,DNA 能更有效地从 bPEI1.8K-C12/DNA 中离解出来;③复合颗粒 zeta 电位的绝对值远远大于 bPEI1.8K/DNA,bPEI1.8K-C12/DNA 在转染介质(含血清 DMEM)中具有更高稳定性。
单一材料或者制剂方法已无法满足将基因药物安全高效递送入体内的需求,现在多采用复合材料或组合制剂技术来实现这一目标。就分子量而言,与高分子量 PEI 相比,低分子量 PEI 更便于与其他材料构成复合材料或与功能配基键合,或将PEI 与 DNA 的静电复合方法与其他制剂技术整合构建多功能剂型[7],如逐层自组装[14]。本文构建的 bPEI1.8K-C12基因转染效率高,毒性低,且制备方法简单,将其作为一种制剂中间体,有望开发出有前景的复合材料或组合制剂技术。
[1] O'Connor L, Glynn B. Recent advances in the development of nucleic acid diagnostics. Expert Rev Med Devices, 2010, 7(4):529-539.
[2] Singha K, Namgung R, Kim WJ. Polymers in small-interfering RNA delivery. Nucleic Acid Ther, 2011, 21(3):133-147.
[3] Lai WF. In vivo nucleic acid delivery with PEI and its derivatives: current status and perspectives. Expert Rev Med Devices, 2011, 8(2): 173-185.
[4] Thomas M, Klibanov AM. Enhancing polyethylenimine’s delivery of plasmid DNA into mammalian cells. Proc Natl Acad Sci U S A, 2002, 99(23):14640-14645.
[5] Masotti A, Moretti F, Mancini F, et al. Physicochemical and biological study of selected hydrophobic polyethylenimine-based polycationic liposomes and their complexes with DNA. Bioorg Med Chem, 2007, 15(3):1504-1515.
[6] Díaz-Moscoso A, Vercauteren D, Rejman J, et al. Insights in cellular uptake mechanisms of pDNA-polycationic amphiphilic cyclodextrin nanoparticles (CDplexes). J Control Release, 2010, 146(3):318-325.
[7] Xue HY, Wong HL. Solid lipid-PEI hybrid nanocarrier: an integrated approach to provide extended, targeted, and safer siRNA therapy of prostate cancer in an all-in-one manner. ACS Nano, 2011, 5(9):7034- 7047.
[8] Yang F, Huang W, Li Y, et al. Anti-tumor effects in mice induced by survivin-targeted siRNA delivered through polysaccharide nanoparticles. Biomaterials, 2013, 34(22):5689-5699.
[9] Kichler A, Leborgne C, Coeytrux E, et al. Polyethylenimine-mediated gene delivery: a mechanistic study. J Gene Med, 2001, 3(2):135-144.
[10] Witte KN, Kim S, Won YY. Self-consistent field theory study of the effect of grafting density on the height of a weak polyelectrolyte brush. J Phys Chem B, 2009, 113(32):11076-11084.
[11] Lee SY, Huh MS, Lee S, et al. Stability and cellular uptake of polymerized siRNA (poly-siRNA)/polyethylenimine (PEI) complexes for efficient gene silencing. J Control Release, 2010, 141(3):339-346.
[12] Aravindana L, Bicknell KA, Brooksb G, et al. Effect of acyl chain length on transfection efficiency and toxicity of polyethylenimine. Int J Pharm, 2009, 378(1-2):201-210.
[13] Kirby AJ, Camilleri P, Engberts JB, et al. Gemini surfactants: new synthetic vectors for gene transfection. Angew Chem Int Ed Engl, 2003, 42(13):1448-1457.
[14] Ariga K, Hilla JP, Ji QM. Layer-by-layer assembly as a versatile bottom-up nanofabrication technique for exploratory research and realistic application. Phys Chem Chem Phys, 2007, 9(19):2319-2340.
Alkylated low molecular polyethylenimine as a gene delivery vector
LIU Shan, HUANG Wei, JIN Ming-ji, QUAN Xiu-quan, GAO Zhong-gao
Preliminary evaluation of the safety and efficiency of alkylated low molecular polyethylenimine as a gene delivery vector.
bPEI1.8K-C12was synthesized with branch PEI (Mw 1800; bPEI1.8K) and 1-bromododecane, and structurally confirmed with1H-NMR. Cytotoxicity and biocompatibility of bPEI1.8K-C12were evaluated by MTT method and hemolysis assay, respectively. Size distribution and zeta potential of bPEI1.8K-C12/DNA polyplexes were determined, and cellular uptake of the DNA polyplexes was visualized with confocal laser scanning microscope (CLSM). DNA condensation ability of bPEI1.8K-C12was studied by gel retardation assay, andgene delivery efficiency was investigated with luciferase and green fluorescent protein reporter gene, respectively.
bPEI1.8K-C12was successfully synthesized after confirmation by1H-NMR. Cytotoxicity of bPEI1.8K-C12on MCF-7 cells was as low as bPEI1.8K, and systematic delivery of high dose bPEI1.8K-C12may cause hemolysis. The average size of bPEI1.8K-C12/DNA polyplexes was bigger than that of bPEI1.8K/DNA polyplexes at the same weight ratio, and the zeta potential of bPEI1.8K-C12/DNA polyplexes was higher than that of bPEI1.8K/DNA polyplexes at the same weight ratio. After alkylation, the DNA condensation ability of bPEI1.8K-C12was reduced, but the cellular uptake of bPEI1.8K-C12/DNA polyplexes was greatly enhanced.gene transfection efficiency of bPEI1.8K-C12/DNA was significantly higher than that of bPEI1.8K, and was comparable to that of lipofectamine2000.
bPEI1.8K-C12is a safe and efficient gene delivery vector, and holds great promise for further development.
Polyethyleneimine; Antineoplastic agents, alkylating; Gene delivery; Gene therapy
GAO Zhong-gao, Email: zggao@imm.ac.cn
10.3969/cmba.j.issn.1673-713X.2014.06.003
北京市自然科学基金(7142114、2141004);国家自然科学基金(81373342);协和青年科研基金学生创新项目(2012-1007- 017)
高钟镐,Email:zggao@imm.ac.cn
2014-03-11
Author Affiliations: State Key Laboratory of Bioactive Substance and Functioins of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Science & Peking Union Medical College, Beijing 100050, China (LIU Shan, HUANG Wei, JIN Ming-ji, GAO Zhong-gao); Department of Respiratory Medicine, The Affiliated Hospital of Yanbian University, Yanji 133000, China (QUAN Xiu-quan)

