基于TNF功能表位设计新型人源单链抗体
常宏,吕明,乔春霞,李新颖,耿晶,周婷婷,林周,沈倍奋,冯健男
基于TNF功能表位设计新型人源单链抗体
常宏,吕明,乔春霞,李新颖,耿晶,周婷婷,林周,沈倍奋,冯健男
100850 北京,军事医学科学院基础医学研究所(常宏、吕明、乔春霞、李新颖、耿晶、周婷婷、林周、沈倍奋、冯健男);050200 石家庄,河北中医学院基础医学院(常宏)
开发基于 TNF 功能表位的新型人源单链抗体。
利用自主研制的鼠抗 TNF-α 中和单抗 Z12 能特异性识别 TNF-α 的 141 ~ 146 位功能表位特性,通过理论模拟构建 TNF/抗体 Z12 相互作用的复合物模型设计获得功能性拮抗肽(PT2、PT3、PT4、PT7)以及单域抗体 PTVH5(以人抗体可变区重链框架 VH5 为支架合理展示 PT2、PT3、PT4),利用计算机辅助分子设计以及同源模建、分子对接方法,进一步合理选择人抗体可变区轻链框架(Vκ1)作为展示支架,通过构象判别、作用能比较以及识别区域确认并选择合适的连接肽设计新型单链分子ScFv_AB1。
理论分析发现,ScFv_AB1 稳定性较好,识别 TNF-α 的 141 ~ 146 功能位点(即 Z12 识别的位点)。生物学实验证明,ScFv_AB1 能与 TNF-α 结合、抑制 TNF-α 与 TNFR 的结合、抑制TNF-α 介导的细胞毒作用。
初步验证了“借助计算机模建,基于人抗体可变区的框架结构和拮抗肽设计单链抗体分子”的策略是可行的,从而为人源小分子抗体的制备提供了一条可供选择的途径。
肿瘤坏死因子α; 单链抗体; 计算机辅助设计; 支架; 同源模建; 拮抗肽
肿瘤坏死因子 α(TNF-α)是一种多功能的细胞因子,主要由激活的单核细胞/巨噬细胞、T 淋巴细胞分泌,其他如中性粒细胞、肥大细胞及内皮细胞在一定条件下也能产生[1-3]。成熟的 TNF-α(17 kD)由膜型 TNF-α(26 kD)切割而产生,两种形式的 TNF-α 都具有生物活性[4]。TNF-α 有3 个与受体结合的主要活性表位,即 29 ~ 36、84 ~ 91 和 141 ~ 146 位。TNF-α 以活性三聚体的形式与细胞表面的 TNF-α 受体(TNFR)结合,从而启动信号通路,发挥生物学功能[5-8]。
TNF-α 的过表达与类风湿性关节炎(rheumatoid arthritis,RA)、克罗恩病、多发性硬化症等自身免疫性疾病的密切关系已得到证实[9-11]。TNF-α 还是一个重要的前炎性细胞因子,可以介导多种炎性因子的释放,如 IL-1、IL-6、GM-CSF[12]。越来越多的疾病被发现与 TNF-α 的过量分泌有关,TNF-α 已经成为治疗这类疾病的一个有效靶标[13-15]。
目前,已被 FDA 批准的 TNF-α 拮抗剂有:依那西普(商品名:恩利)是 TNFRII-Fc 融合蛋白;Remicade(infliximab)是一种人-鼠嵌合单抗;Humira(adalimumab)是利用抗体库技术筛选得到的人源单抗,它们主要用于 RA 和结肠克罗恩病的治疗[15-16]。
课题组在 TNF-α 中和抗体制备、TNF-α 拮抗分子设计方面已取得了一定进展:确定了具有自主知识产权的鼠源中和抗体 Z12 识别的 TNF-α 的功能表位(141 ~ 146 位氨基酸残基)[17];根据TNF/抗体相互作用的立体结构信息,设计了一系列具有中和活性的拮抗肽(PT2、PT3、PT4、PT7)[18-19];为提高拮抗肽的稳定性和活性,将拮抗肽 PT4 与人 IgG1 的 Fc 段连接构建 PT4-Fc 融合蛋白[20];尝试利用人抗体可变区的重链 VH5 框架来展示 TNF-α 拮抗肽(PT2、PT3、PT4),设计得到人源单域抗体 PTVH5[21]。结果显示,与单独的拮抗肽相比,新构建的 PT4-Fc 或 PTVH5 的稳定性增强,生物学活性明显提高,而且抗体可变区框架比 Fc 段更适于展示拮抗肽。
抗体可变区框架的应用价值已被抗体库的蓬勃发展充分证实[22-24],尽管所设计的拮抗分子的活性还不能令人满意,但已证明这是一条比较合理的设计拮抗分子的途径,它促使我们进一步去开发活性更好的拮抗分子。
分析认为,在单域抗体 PTVH5 的基础上设计单链抗体,可能会获得活性更好的拮抗分子。理论上讲,随着 VL的加入,其 LCDR3 与 HCDR3 能形成较强的疏水口袋,通过“锁-钥匙”结构与抗原表位紧密结合,加上其他重、轻链 CDR 区的作用,有利于抗原-抗体复合物的形成,也更符合天然抗体识别抗原的模式;同时,与单域抗体相比,单链抗体的半衰期将大大延长。基于此,本论文依据已有的拮抗肽(PT2、PT3、PT4、PT7)以及人抗体可变区基因聚类分析结果(七类 VH,七类 VL),尝试利用人抗体重、轻链可变区框架合理展示拮抗肽,设计人源单链抗体构象库;借助 TNF/抗体相互作用的立体结构信息,合理设计、筛选新型 TNF 拮抗分子。
1 材料与方法
1.1 材料
计算机模建所用硬件为美国 Silicon Graphics Inc.(SGI)图形工作站、IBM 工作站。软件为Insight II(2005)程序包。
pET22b(+) 质粒、表达菌株 BL21(DE3,基因型为 F-ompT hsdSB r-m-gal dcm)由本研究室保存;限制性内切酶购自美国 NEB 公司;T4 DNA 连接酶购自美国 Gibco 公司;高保真 Taq 酶(pyrobest)购自日本 Takara 公司;螯合 Ni2+的琼脂糖凝胶层析柱购自北京本元正阳基因技术有限公司;Anti-His 抗体购自美国Invitrogen 公司;HRP 标记的羊抗鼠 IgG 由本室制备保存;人可溶性 TNFRI 及 TNFRII 购自美国 R & D systems 公司;荧光检测试剂盒购自美国Promega 公司;TNF 抗原由本研究室表达、纯化获得,英夫利昔单抗(商品名:Remicade)购自美国强生公司。
1.2 方法
1.2.1 同源模建 根据 Knappik 的聚类分析结果[22],利用 Homology 模块对构建的人抗体轻链可变区(拮抗肽 PT7 替换 CDR3)构象进行模拟。以单域抗体 PTVH5(拮抗肽 PT2、PT3、PT4 依次替换 CDR1、CDR2、CDR3)构象为基础,通过通用连接肽 (GGGGS)3与构建的人抗体轻链可变区构象进行组合,形成单链抗体 scFv,利用Homology 模块对 scFv 构象进行模拟。
1.2.2 力学优化 依次选择 CVFF、Gromos96力场,经最陡下降(收敛步长 6000,收敛判据0.05 kJ/mol)、共轭梯度(收敛步长 10000,收敛判据 0.01 kJ/mol),利用 Discover_3 模块对获得的轻链可变区及 scFv 构象进行最小化处理。
1.2.3 分子对接 基于 TNF 晶体结构(PDB 号:1tnf)以及 TNF/Z12 相互作用复合物模型,利用Docking 4.0 对获得的 scFv 与 TNF-α 作用的复合物结构进行模拟。
1.2.4 反向翻译 针对理论设计获得的 ScFv_AB1 氨基酸序列,利用 www.expasy.ch/tool 中的 Reverse Translate 程序对其进行反向翻译,得到其 DNA 序列。选择 Remicade 的单链抗体形式作为阳性对照(命名为 S-Remicade),按照 S-Remicade 的氨基酸序列进行反向翻译,确定其 DNA 序列。考虑到原核表达系统,在翻译过程中选用偏好密码子。
1.2.5 重组蛋白表达质粒的构建、诱导表达及复性纯化 对于获得的 ScFv_AB1、S-Remicade 的基因序列,通过 Overlap PCR 方法进行全合成。通过 DNA 片段和质粒的酶切、连接反应、转化 JM109 感受态细胞,挑取单克隆,利用 PCR 方法和酶切方法进行鉴定。
利用重组质粒诱导表达、包涵体复性、重组蛋白纯化获得新抗体。
1.2.6 与 TNF-α 的结合试验 以 TNF-α(1 μg/ml)包被酶标板,4 ℃过夜;TBST 洗涤 1 遍,10%胎牛血清 37 ℃封闭 1 h;TBST 洗涤 3 遍,加入不同浓度(0.22、0.44、0.88、1.75、3.5 μmol/L)的 ScFv_AB1,37 ℃孵育 1 h;TBST 洗涤 3 遍,加入鼠抗 His 抗体(1:5000),37 ℃孵育 1 h;TBST洗涤 3 遍,加入二抗 GAM-HRP(1:3000),室温孵育 1 h;TBST 洗涤 3 遍,加入 OPD 底物显色液,室温显色 10 min,2 mol/L H2SO4终止反应;492 nm 波长下测值。以 S-Remicade 为阳性对照,带 His-tag 的无关蛋白为阴性对照,所有反应液均为每孔 50 μl。
1.2.7 竞争抑制试验 以 TNF-α(1 μg/ml)包被酶标板,4 ℃过夜;TBST 洗涤 1 遍,10%胎牛血清 37 ℃封闭 1 h;TBST 洗涤 3 遍,加入 Z12-HRP(1:1600)与不同浓度 ScFv_AB1 的混合液,室温孵育 1 h;TBST 洗涤 3 遍,加入 OPD 底物,室温显色 10 min,2 mol/L H2SO4终止反应;492 nm 波长下测值。以 IgG 嵌合抗体作对照,所有反应液均为每孔 50 μl。
抑制率按以下公式计算:
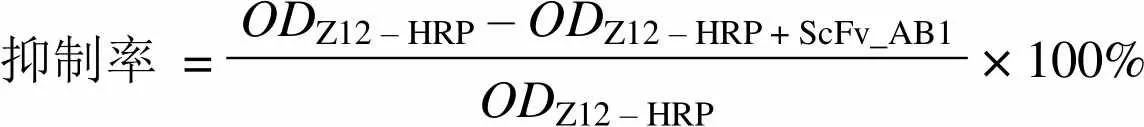
抑制率 =ODZ12 – HRP – ODZ12 – HRP + ScFv_AB1× 100% ODZ12 – HRP
1.2.8 抑制 TNF-α 与 TNFR 结合的实验 以TNFRI 或 TNFRII(1.25 μg/ml)包被酶标板,4 ℃过夜;TBST 洗涤 1 遍,10%胎牛血清 37 ℃封闭 1 h;TBST 洗涤 3 遍,加入 TNF-HRP(1:800)与不同浓度 ScFv_AB1 的混合液,室温孵育 1 h;TBST 洗涤 3 遍,加入 OPD 底物,室温显色10 min,2 mol/L H2SO4终止反应;492 nm 波长下测值。以 S-Remicade 为阳性对照,IgG 嵌合抗体为阴性对照,所有反应液均为每孔 50 µl。
抑制率按以下公式计算:
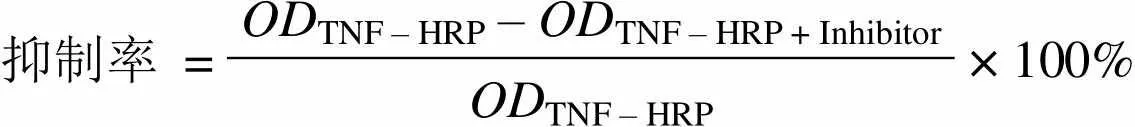
抑制率 =ODTNF – HRP – ODTNF – HRP + Inhibitor× 100% ODTNF – HRP
1.2.9 对 TNF-α 细胞毒的抑制实验 将生长状态良好的 L929 细胞用胰酶消化,接种于 96 孔板,3 × 104个/孔,每孔 80 µl,加入终浓度为 1 μg/ml 的放线菌素 D(dactinomycin D);加入 TNF-α(终浓度为 10 ng/ml)与不同浓度(0.125、0.25、0.5、1、2 μg/ml)的 ScFv_AB1混合液,每孔 20 μl,37 ℃培养 20 h;加入 MTT(5 mg/ml),每孔 10 μl,37 ℃培养 4 h;加入 MTT 终止液(0.01 mol/L HCl、10% SDS),每孔 100 μl,37 ℃或室温 8 h;测 570 nm值。以 S-Remicade、Remicade 为阳性对照,IgG 嵌合抗体为阴性对照。
抑制率按以下公式计算:
抑制率 =
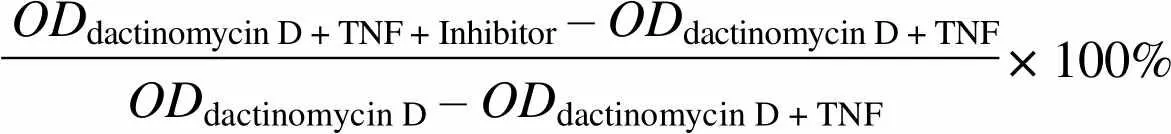
ODdactinomycin D + TNF + Inhibitor – ODdactinomycin D + TNF× 100% ODdactinomycin D – ODdactinomycin D + TNF
2 结果
2.1 单链抗体 scFv 的设计及空间结构模拟
在单域抗体 PTVH5 的基础上,以七类 VL框架为轻链候选支架,用活性较好的拮抗肽 PT7 替换 VL框架的 CDR3 区,并以(GGGGS)3作为柔性linker,设计新型 scFv 分子,设计中所用的 4 个 TNF-α 拮抗肽(PT2、PT3、PT4、PT7)的氨基酸序列及其在 scFv 中的位置见表 1,组成 7 个 scFv 分子的 VH、VL类型见表 2。
在同源模建过程中,由于静电斥力和空间位阻的影响,有些 scFv 的三维结构因不合理且不稳定,不能通过同源模建的方法搭建,因此只获得了3 个 scFv 分子的三维结构模型(ScFv_AB1、ScFv_AB3、ScFv_AB5),如图 1 所示。
2.2 单链抗体 scFv 与 TNF-α 相互作用复合物的结构预测
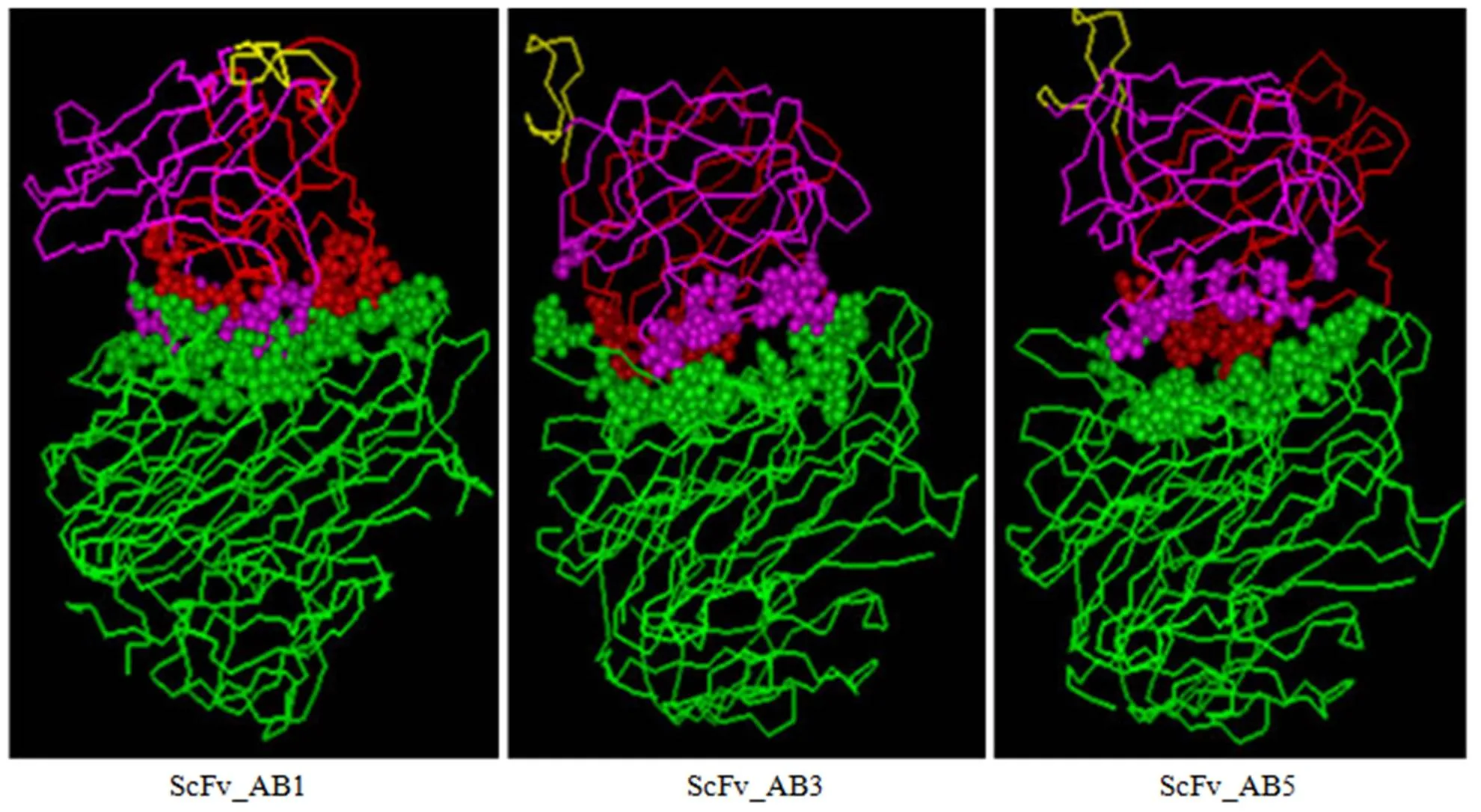
借助理论设计获得的新型分子 scFv 空间构象(图 1),以 TNF 晶体结构(PDB号:1tnf)为模板,考虑静电互补、结构匹配,通过 TNF/Z12 相互作用的空间结构模式,构建 scFv 与 TNF-α 相互作用的立体结构,经分子力学、动力学优化获得复合物的常温稳定构象(图 2)。从图 2 可以看出,设计获得的新型单链抗体分子 ScFv_AB1、ScFv_AB3、ScFv_AB5 均能够与 TNF-α 作用。

表 1 TNF-α 拮抗肽的氨基酸序列及在 scFv 中的位置
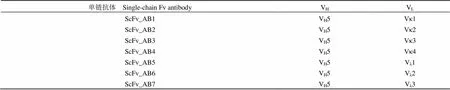
表 2 组成 scFv 的 VH、VL类型
2.3 scFv 与 TNF-α 相互识别位点判别
根据模建获得的 3 个新型 scFv 分子与 TNF-α 相互作用的复合物模型,通过距离几何学、计算机图形学技术分析它们各自所识别的 TNF-α 的位点及相关位置。从表 3 可以看出,ScFv_AB1 与 TNF-α 的作用区域较广,识别的活性氨基酸(位于活性部位的氨基酸)和总氨基酸较多。3 个 scFv 分子都分别能识别 TNF-α 3 个活性部位中的两个,但 ScFv_AB1 能够完整地识别 141 ~ 146 位,其他两个 scFv 分子只能部分识别这一活性表位。该表位也是单抗 Z12 识别并中和 TNF-α 活性的主要位点。鉴于此,ScFv_AB1 最有可能会中和 TNF-α 的毒性作用。
进一步分析 scFv 与 TNF-α 形成的复合物模型可以发现,ScFv_AB1 中参与识别 TNF-α 的氨基酸残基最多,ScFv_AB1 中 HCDR2(61 ~ 77)、HCDR3(110 ~ 125)、LCDR3(239 ~ 254)参与了识别 TNF-α;而 ScFv_AB3 和 ScFv_AB5 中,仅 HCDR2(61 ~ 77)和LCDR3(240 ~ 255)参与了识别作用,HCDR3(110 ~ 125)几乎不发挥作用。
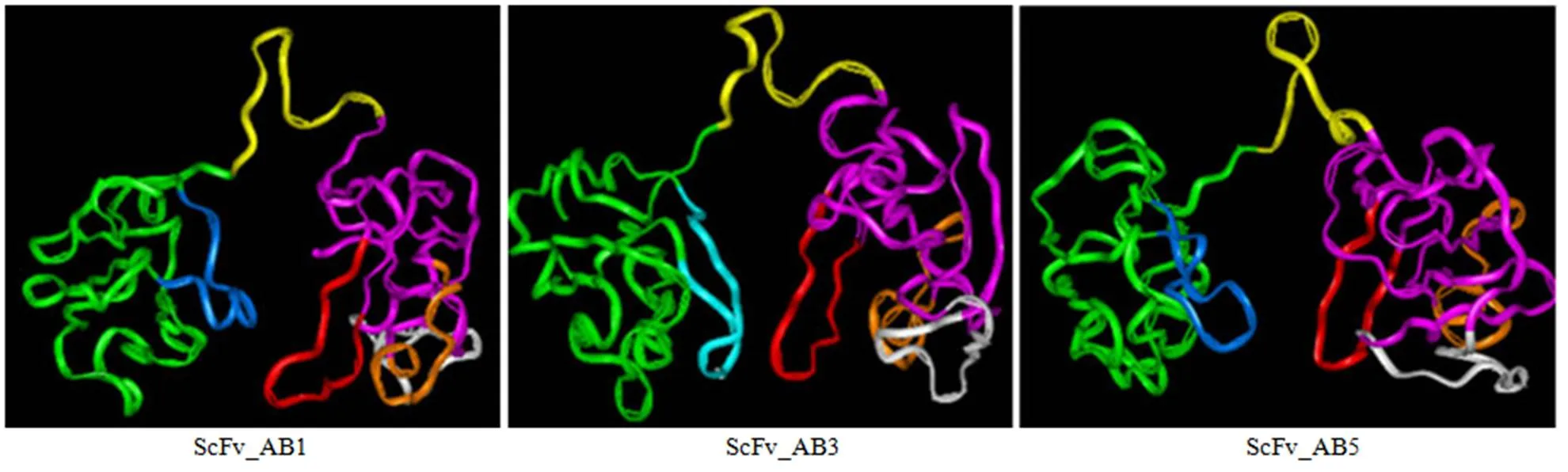
绿色飘带为 VL框架;粉色飘带为 VH框架;黄色飘带为 linker;蓝色为 LCDR3(PT7);深黄色为 HCDR1(PT2);白色为 HCDR2(PT3);红色为 HCDR3(PT4)
Figure 1 The 3-D structure model of scFv molecule based on homology modeling method
绿色线条为 TNF 三聚体,绿色球为 TNF 被识别的表位;红色线条为 VL框架,红色球为 LCDR3(PT7);粉色线条为 VH框架,粉色球为 HCDR3(PT4);黄色线条为 linker
Figure 2 The complex structure of TNF and scFv based on computer-guided molecular docking and dynamics simulation methods

表 3 scFv 分子识别 TNF 三聚体的区域
注:A、B、C 分别代表 TNF 三聚体中的 3 个单体;aa:氨基酸。
Notes: A, B and C represent the three monomer of TNF trimer, aa: amino acid.

红色、粉色和绿色球分别代表 VL、VH和 TNF-α 中发生相互作用的氨基酸残基
Figure 3 The localization analysis of the binding domain between scFv and TNF-α
很多研究表明,HCDR3 和 LCDR3 在与抗原结合中发挥主要作用,而 HCDR3 看起来比 LCDR3 更关键[25-26]。由此可见,理论上,ScFv_AB1 的活性要明显好于 ScFv_AB3 和 ScFv_AB5。
2.4 scFv 分子与 TNF-α 相互识别模式分析
利用计算机图形学技术,结合 scFv 与 TNF-α 相互识别位点,确定了 scFv 与 TNF-α 识别区域的结构特征,如图 3 所示,ScFv_AB1 与 TNF-α 作用堆积最为紧密,相互识别的范围较广,而 ScFv_AB3、ScFv_AB5 与 TNF-α 作用面接触较差,作用分散。
根据所设计的 3 个scFv分子与 TNF-α 相互作用的复合物模型,分别计算它们与TNF-α 相互作用的自由能。从表 4 中可以看出,在 3 个 scFv 分子中,ScFv_AB1 与 TNF-α 之间作用的自由能最低,结合 TNF-α 的作用最强。
2.5 反向翻译获得 ScFv_AB1的 DNA 序列
选择偏好密码子,将 ScFv_AB1 的氨基酸序列反向翻译成 DNA 序列,长 795 bp,需要全合成的部分为 420 bp(图 4)。将 ScFv_AB1 序列中需要合成部分的正链和负链 DNA 各分成6 段,正链与负链中的相应两段重叠 18 ~ 22 bp,有利于 PCR 过程的延伸。分析每段的二级结构,修改碱基,消除过多的发夹结构,便于 PCR 扩增。
2.6 新型单链抗体 ScFv_AB1 的生物学活性
2.6.1 与 TNF 的特异性结合 ELISA 结果表明,ScFv_AB1 能够与包被在酶标板上的 TNF-α 结合(图5A),结合能力随着 ScFv_AB1 的浓度增加而增加,带 His-tag 的无关蛋白不能与 TNF-α 结合。

表 4 理论模型下的 scFv 分子与 TNF 的相互作用能(kCal/mol)
Z12-HRP 与不同浓度的 ScFv_AB1 混合,竞争与 TNF-α 结合。竞争 ELISA 的结果显示,ScFv_AB1 可以与 Z12-HRP 竞争结合包被在酶标板上的 TNF-α,竞争抑制率随着ScFv_AB1 的浓度增加而增加。这表明 ScFv_AB1 和 Z12 一样,能与 TNF-α 的 141 ~ 146 功能表位结合,预示着ScFv_AB1 能中和 TNF-α 的活性(图5B)。
2.6.2 ScFv_AB1 抑制 TNF-α 与 TNFR 的结合 ScFv_AB1 能与 TNF-α 结合,这促使我们进一步去验证 ScFv_AB1 是否能阻断 TNF-α 与 TNFR 的结合。结果表明,ScFv_AB1 能以浓度依赖方式阻断 TNF-α 与 TNFRI(图6A)、TNFRII(图6B)的结合,从而可能抑制 TNF-α 的生物活性。ScFv_AB1 浓度为 3.5 μmol/L 时,抑制率达到60% 以上。

图 4 ScFv_AB1 的氨基酸序列反向翻译成 DNA 序列
Figure 4 The reverse translation of ScFv_AB1
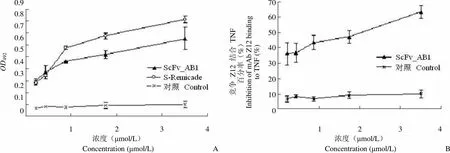
OD4920.90.80.70.60.50.40.30.20.10 竞争 Z12 结合 TNF百分率(%)Inhibition of mAb Z12 bindingto TNF (%)706050403020100 1 2 3 4 1 2 3 4 浓度(μmol/L)Concentration (μmol/L)A 浓度(μmol/L)Concentration (μmol/L)B
Figure 5 The specific binding of ScFv_AB1 and TNF (A: The binding between ScFv_AB1 an TNF; B: The competition binding between ScFv_AB1 and Z12)
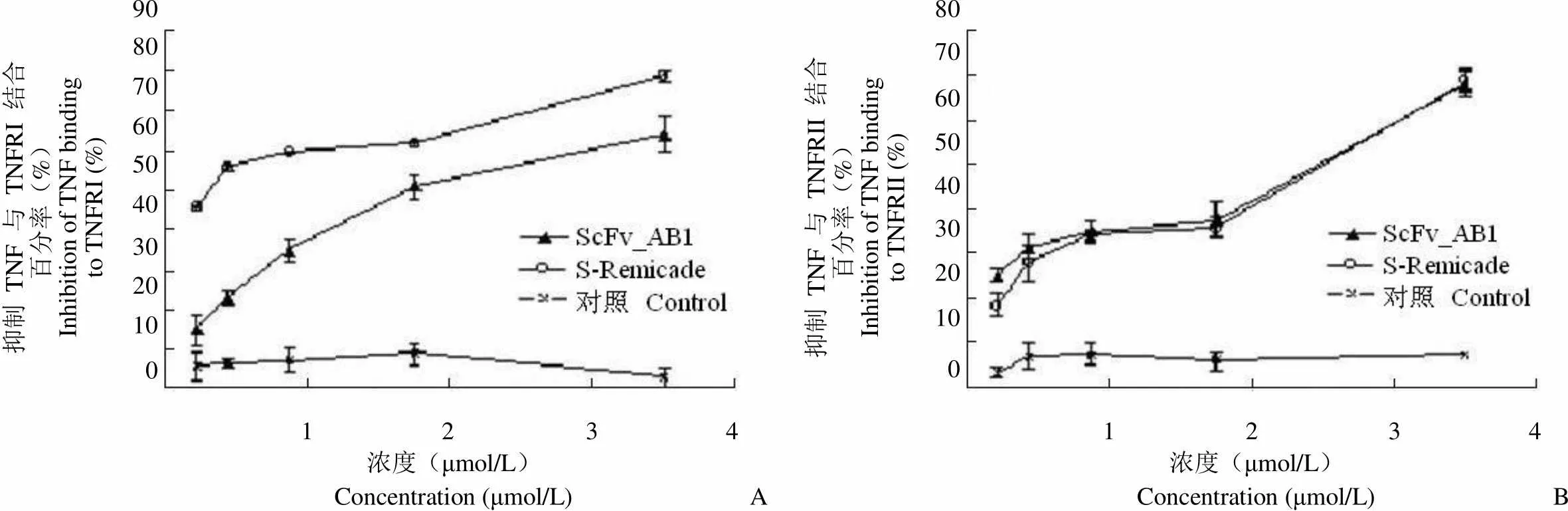
抑制 TNF 与 TNFRI 结合百分率(%)Inhibition of TNF bindingto TNFRI (%)9080706050403020100 抑制 TNF 与 TNFRII 结合百分率(%)Inhibition of TNF bindingto TNFRII (%)80706050403020100 1 2 3 4 1 2 3 4 浓度(μmol/L)Concentration (μmol/L)A 浓度(μmol/L)Concentration (μmol/L)B
Figure 6 Inhibition of ScFv_AB1 to TNF and TNFR (A: Inhibition of TNF and TNFRI; B: Inhibition of TNF and TNFRII)
2.6.3 ScFv_AB1 对 TNF-α 细胞毒的抑制效应 鼠成纤维细胞 L929 为 TNF-α 特异敏感的靶细胞。实验中,在 10 ng/ml rhTNF-α 的作用下,70% 的 L929 细胞发生凋亡,凋亡的程度与 TNF-α 的活性成正相关。ScFv_AB1 可明显抑制 TNF-α 对 L929 细胞的毒性作用(图7),但其抑制活性与 S-Remicade 和 Remicade 相比要弱。
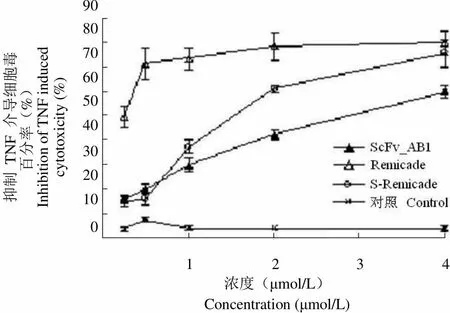
抑制 TNF 介导细胞毒百分率(%)Inhibition of TNF inducedcytotoxicity (%)9080706050403020100 1 2 3 4 浓度(μmol/L)Concentration (μmol/L)
Figure 7 Inhibition effect of ScFv_AB1 on TNF-α induced cytotoxicity
3 讨论
研究证实,源于 TNF-α 中和性抗体的 CDRs 的短肽,或是根据其 CDRs 合理设计的短肽,都能够与 TNF-α 结合,其特异性与母本抗体相似,但其活性离临床应用相距甚远[27-28]。分析原因可能是:自由的肽可以拥有多种空间构象,可能只有一小部分有利的构象适于与抗原分子结合;而且肽分子太小,不具备足够的空间位阻以阻断抗原与其受体的结合[29]。所以,需要一个合适的框架来支撑自由的肽,以求获得有利的空间构象、稳定的三级结构和足够的空间位阻。
已有很多蛋白框架被开发用于拮抗分子的构建[30]。在课题组前期的研究中,曾用人 IgG1 的Fc 片段及人抗体可变区的 VH5 框架来展示 TNF-α 拮抗肽[20-21]。结果表明,与单独的肽相比,新构建的拮抗分子的活性明显提高,而且抗体可变区框架比 Fc 片段更适于作为支架来展示拮抗肽,这促使我们利用这一合理的设计策略进一步去开发活性更好的拮抗分子。
在这部分工作中,以前面设计的单域抗体 PTVH5(以 VH5 为框架)为基础,从七类轻链可变区框架中选择与之匹配的 VL框架,以通用的(GGGGS)3为连接肽,设计新型单链抗体,其中 VL框架的 CDR3 被拮抗肽 PT7 取代。由于前期研究已显示 LCDR1 和 LCDR2 在与 TNF-α 的结合中不起主要作用[17, 20],所以取代不涉及 LCDR1 和 LCDR2。经过同源模建和分子对接,搭建 TNF/scFv 复合物模型。分析发现,以 VH5 和 Vκ1 为框架设计的 ScFv_AB1 与 TNF-α 之间的结合能力较 ScFv_AB3、ScFv_AB5 强,能够识别TNF-α 中重要的活性表位 141 ~ 146 位。
纯化的 ScFv_AB1 能够与 TNF-α 结合、竞争性抑制 Z12-HRP 与 TNF-α 的结合、抑制 TNF-α 介导的细胞毒作用。但与 S-Remicade 相比,ScFv_AB1 的活性要弱。最大的可能性是,ScFv_AB1 是在 VH5 框架的基础上设计的,而 VH5 与Vκ1 可能并非是最佳组合。其他的可能性还有 ScFv_AB1 与 TNF-α 间较弱的氢键作用、拮抗肽的效力等。如果进一步模建时考虑所有的 VH和 VL框架,确定拮抗肽的最佳展示位置,可能会获得活性更好的拮抗分子。
[1] Carswell EA, Old LJ, Kassel RL, et al. An endotoxin-induced serum factor that causes necrosis of tumors. Proc Natl Acad Sci U S A, 1975, 72(9):3666-3670.
[2] Pennica D, Nedwin GE, Hayflick JS, et al. Human tumour necrosis factor: precursor structure, expression and homology to lymphotoxin. Nature, 1984, 312(5996):724-729.
[3] Sherry B, Cerami A. Cachectin/tumor necrosis factor exerts endocrine, paracrine, and autocrine control of inflammatory responses. J Cell Biol, 1988, 107(4):1269-1277.
[4] Orlinick JR, Chao MV. TNF-related ligands and their receptors. Cell Signal, 1998, 10(8):543-551.
[5] Bazzoni F, Beutler B. The tumor necrosis factor ligand and receptor families. N Engl J Med, 1996, 334(26):1717-1725.
[6] Boone E, Vanden Berghe T, Van Loo G, et al. Structure/Function analysis of p55 tumor necrosis factor receptor and fas-associated death domain. Effect on necrosis in L929sA cells. J Biol Chem, 2000, 275(48):37596-37603.
[7] Loetscher H, Stueber D, Banner D, et al. Human tumor necrosis factor alpha (TNF alpha) mutants with exclusive specificity for the 55-kDa or 75-kDa TNF receptors. J Biol Chem, 1993, 268(35):26350-26357.
[8] Yamagishi J, Kawashima H, Matsuo N, et al. Mutational analysis of structure--activity relationships in human tumor necrosis factor-alpha. ProtEIN Eng, 1990, 3(8):713-719.
[9] Nakae S, Suto H, Kakurai M, et al. Mast cells enhance T cell activation: importance of mast cell-derived TNF. Proc Natl Acad Sci U S A, 2005, 102(18):6467-6472.
[10] Palucka AK, Blanck JP, Bennett L, et al. Cross-regulation of TNF and IFN-alpha in autoimmune diseases. Proc Natl Acad Sci U S A, 2005, 102(9):3372-3377.
[11] Ware CF. Network communications: lymphotoxins, LIGHT, and TNF. Annu Rev Immunol, 2005, 23:787-819.
[12] Scallon BJ, Moore MA, Trinh H, et al. Chimeric anti-TNF-alpha monoclonal antibody cA2 binds recombinant transmembrane TNF-
alpha and activates immune effector functions. Cytokine, 1995, 7(3): 251-259.
[13] Camussi G, Lupia E. The future role of anti-tumour necrosis factor (TNF) products in the treatment of rheumatoid arthritis. Drugs, 1998, 55(5):613-620.
[14] O'Dell JR. Therapeutic strategies for rheumatoid arthritis. N Engl
J Med, 2004, 350(25):2591-2602.
[15] Leonardi CL, Powers JL, Matheson RT, et al. Etanercept as monotherapy in patients with psoriasis. N Engl J Med, 2003, 349(21): 2014-2022.
[16] Keane J, Gershon S, Wise RP, et al. Tuberculosis associated with infliximab, a tumor necrosis factor-alpha neutralizing agent. N Engl J Med, 2001, 345(15):1098-1104.
[17] Zhang W, Feng J, Shen B. Identification of binding epitope of a monoclonal antibody (Z12) against human TNF-alpha using computer modeling and deletion mutant technique. Sci China C Life Sci, 2004, 47(3):279-286.
[18] Feng J, Li Y, Zhang W, et al. Rational design of potent mimic peptide derived from monoclonal antibody: antibody mimic design. Immunol Lett, 2005, 98(2):311-316.
[19] Qin W, Feng J, Li Y, et al. De novo design TNF-alpha antagonistic peptide based on the complex structure of TNF-alpha with its neutralizing monoclonal antibody Z12. J Biotechnol, 2006, 125(1):57-63.
[20] Qin W, Feng J, Li Y, et al. Fusion protein of CDR mimetic peptide with Fc inhibit TNF- alpha induced cytotoxicity. Mol Immunol, 2006, 43(6):660-666.
[21] Qin W, Feng J, Li Y, et al. A novel domain antibody rationally designed against TNF-alpha using variable region of human heavy chain antibody as scaffolds to display antagonistic peptides. Mol Immunol, 2007, 44(9):2355-2361.
[22] Knappik A, Ge L, Honegger A, et al. Fully synthetic human combinatorial antibody libraries (HuCAL) based on modular consensus frameworks and CDRs randomized with trinucleotides.J Mol Biol, 2000, 296(1):57-86.
[23] Clackson T, Wells JA. In vitro selection from protein and peptide libraries. Trends Biotechnol, 1994, 12(5):173-184.
[24] Hoogenboom HR. Designing and optimizing library selection strategies for generating high-affinity antibodies. Trends Biotechnol, 1997, 15(2):62-70.
[25] Fleury D, Wharton SA, Skehel JJ, et al. Antigen distortion allows influenza virus to escape neutralization. Nat Struct Biol, 1998, 5(2): 119-123.
[26] Kleinjung J, Petit MC, Orlewski P, et al. The third-dimensional structure of the complex between an Fv antibody fragment and an analogue of the main immunogenic region of the acetylcholine receptor: a combined two-dimensional NMR, homology, and molecular modeling approach. Biopolymers, 2000, 53(2):113-128.
[27] Williams WV, Moss DA, Kieber-Emmons T, et al. Development of biologically active peptides based on antibody structure. Proc Natl Acad Sci U S A, 1989, 86(14):5537-5541.
[28] Döring E, Stigler R, Grütz G, et al. Identification and characterization of a TNF alpha antagonist derived from a monoclonal antibody. Mol Immunol, 1994, 31(14):1059-1067.
[29] Eck MJ, Sprang SR. The structure of tumor necrosis factor- alpha at 2.62 A resolution. Implications for receptor binding. J Biol Chem, 1989, 264(29):17595-17605.
[30] Skerra A. Engineered protein scaffolds for molecular recognition.J Mol Recognit, 2000, 13(4):167-187.
Novel human single chain antibody design based on the functional epitope of TNF
CHANG Hong, LÜ Ming, QIAO Chun-xia, LI Xin-ying, GENG Jing, ZHOU Ting-ting, LIN Zhou, SHEN Bei-fen, FENG Jian-nan
Developed novel human single chain antibody which design based on the functional epitope of TNF.
In a previous study, we obtained a TNF-α neutralizing mAb Z12 and identified the epitope (from 141 to 146 aa in TNF-α) recognized by Z12. Moreover, we explored a series of TNF-α antagonist peptides (. PT2, PT3, PT4 and PT7) and the single domain antibody PTVH5 (using human antibody frame work of variable region of heavy chain,VH5, as scaffold to display the peptides PT2, PT3 and PT4) based on the interaction between TNF-α and mAb Z12. In the present work, based on the computer-guide molecular design, homology modeling and molecular docking method, we used human antibody frame work of variable region of light chain (Vκ1) as dispalying scaffold and obtained a novel single chain antibody, named as ScFv_AB1, according to the conformation, binding energy and identified domain.
Theoretical analysis showed that ScFv_AB1 was stable and recognized the position 141-146 of TNF-α (same as Z12). Biological experiments showed that ScFv_AB1 could bind to TNF-α, competitively inhibit the binding of mAb Z12 to TNF-α, block the binding of TNF-α to TNFR and inhibit TNF-induced cytotoxicity.
This study demonstrated that it is feasible to design novel single chain antibody based on human antibody consensus frameworks and antagonist peptides using computer-guided modeling method. It also provides an alternative way to obtain human small molecular antibody.
Tumor necrosis factor-alpha; Single-chain antibodies; Computer-aided design; Scaffolds; Homology modeling; Antagonist peptide
SHEN Bei-fen, Email: shenbf0714@163.com; FENG Jian-nan, Email: fengjiannan1970@qq.com
10.3969/cmba.j.issn.1673-713X.2014.04.001
国家自然科学基金面上项目(31070820)
沈倍奋,Email:shenbf0714@163.com;冯健男,Email:fengjiannan1970@qq.com
2014-05-28
Author Affiliations: Institute of Basic Medical Sciences, Acadamy of Military Medical Sciences; School of Basic Medical Sciences, Beijing 100850, China (CHANG Hong, LÜ Ming, QIAO Chun-xia, LI Xin-ying, GENG Jing, ZHOU Ting-ting, LIN Zhou, SHEN Bei-fen, FENG Jian-nan); Hebei College of Traditional Chinese Medicine, Shijiazhuang 050200, China (CHANG Hong)

