浅析TNF-α抗体及其代表产品Humira的专利布局
武雪梅,罗洋,曲凯,范东升,时彦卫
浅析TNF-α抗体及其代表产品Humira的专利布局
武雪梅*,罗洋*,曲凯,范东升,时彦卫
100190 北京,国家知识产权局专利局专利审查协作北京中心
编者按
近年,知识产权,特别是专利在促进我国医药生物技术研发和产业发展中的作用越来越大。随着我国国家知识产权战略的逐步推进,医药企业实现由仿制向自主创新的模式转变将成为大势所趋。为了能及时有效地保护科研人员的智力成果,申请专利是最佳选择。为了帮助广大医药工作者进一步了解医药及生物领域知识产权保护的政策和法律法规,提高发明专利申请文件的质量,了解专利局的审查实践,更好地做好专利申请工作。我刊特邀了国家知识产权局专利局专利审查协作北京中心相关专家撰写了系列讲座,希望能够对医药企业,科研院所的相关工作人员提供一定的帮助。
TNF-α 是一种主要由巨噬细胞和单核细胞表达的多功能细胞因子,具有引发和放大机体对感染的防御反应并且促进其他抗炎症介质产生的能力,在炎症反应中起到“哨兵”的作用。基于相同的机制,高浓度或异常表达的 TNF-α 也会导致过度炎症反应和器官损伤,从而引发疾病,比如类风湿性关节炎、克罗恩病和银屑病等[1]。通过开发 TNF 拮抗剂治疗相关疾病成为了制药领域的热点。目前已知的 TNF 拮抗剂有 Humira(adalimumab,阿达木单抗)、Remicade(inflixima,英夫利昔单抗)、Enbrel(etanercept,依那西普)、Cimzia(certolizumab,赛妥珠单抗)和 Simponi(golimumab,戈利木单抗)。在 GEN 进行的 2013 年最畅销的 25 个药物评选中,有 3 个是靶向肿瘤坏死因子TNF-α 的药物,包括最畅销药物 Humira,销量分别排名第二、第五的 Remicade 和 Enbrel。三者的销售额分别达到106.59、89.44和 83.25 亿美元,比 2012 年的销售额分别增长了 15%、8.9% 和 4.5%[2]。
Evaluate Pharma 预测到 2016 年,Humira 的销售额仍将稳居全球之首。Humira 是由 BASF 生物研究公司和剑桥抗体技术(CAT)合作研发的 TNF-α 全人单克隆抗体,通用名阿达木单抗,曾用名 D2E7[3]。2000 年雅培制药公司(Abbott)收购 BASF Knoll,将该抗体市场化。该药物于 2002 年被美国食品药品管理局(FDA)批准并于 2003 年获得欧洲药品管理局(EMEA)批准。最初,该药物仅被用于类风湿性关节炎(RA)的治疗,随后适应证迅速扩展到银屑病关节炎(PsA,2005 年)、强直性脊柱炎(AS,2005 年)、克罗恩病(CD,2007 年)、斑块状银屑病(Ps,2008 年)以及青少年特发性关节炎(JIA,2008 年)。2012 年,FDA 又批准将其适应证扩展到溃疡性结肠炎(UC)[4]。目前由雅培拆分出来的艾伯维(AbbVie)销售。Humira 于 2010 年在中国上市,目前在中国已经获批用于类风湿性关节炎和强制性脊柱炎。
本文通过对 TNF-α 抗体的整体专利申请状况和热销产品 Humira 的专利申请状况进行对比,挖掘 Humira 在较晚进入 TNF-α 抗体领域情况下采取了何种专利申请布局,希望给相关企业提供一定的技术启示和专利策略。
1 Humira 和 TNF-α 抗体的全球专利申请状况对比分析
在德温特专利数据库(WPI)中进行检索,检索截止日为 2014 年 4 月 11 日,其中关于 TNF-α 抗体的全球专利申请共计 1707 项,雅培制药公司(Abbott)和艾伯维(AbbVie)涉及 Humira 的全球专利申请共 101 项。
1.1 专利申请趋势分析
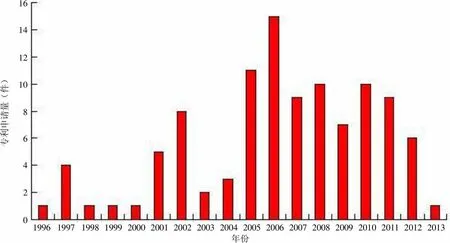
从图 1 可以看出,Humira 专利申请始于 1996 年,1997 – 2004 年专利申请呈年代的零散分布,从2005 年开始申请量增长极为迅速,2006 年达到顶峰,后续申请量的发展较为平缓。
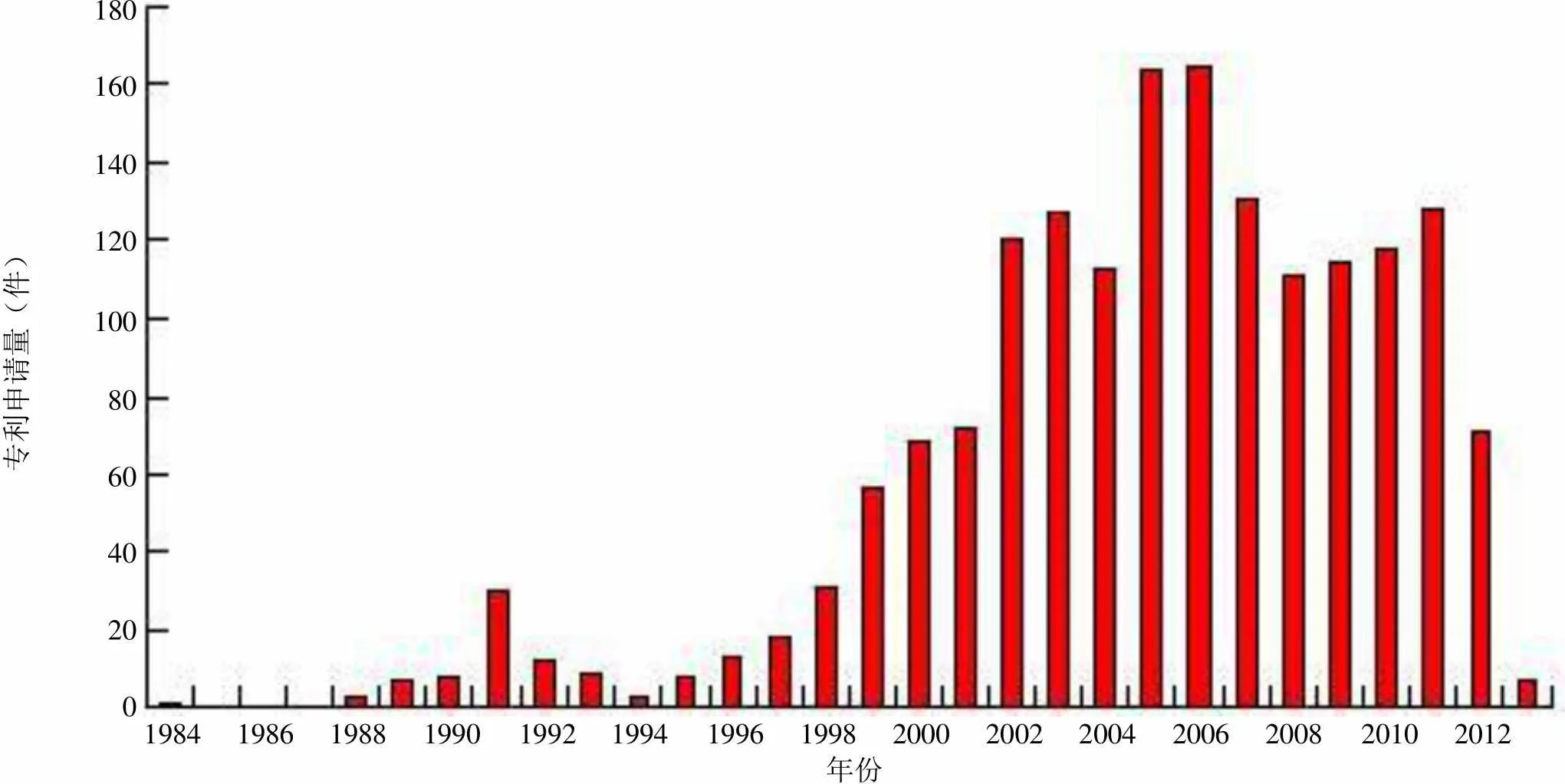
为了便于比较,笔者给出世界范围的 TNF-α 抗体的专利申请年代分布,全球第一件涉及 TNF-α 抗体的专利申请于 1984 年提出,其后十年间并未呈现明显的增长趋势。直至 20 世纪 90年代中叶,随着技术的进步,TNF-α 抗体的专利申请量出现了井喷式发展,结合图 1 和图 2 可知,正是在这种研究热潮之下,1996 年,Humira 作为一种针对 TNF-α 的抗体,也作为全球第一个全人单克隆抗体腾空出世。至 2005 – 2006年,全球范围内对 TNF-α 抗体的研发热情达到顶峰,Humira 相关专利的申请数量也达到最高点并在其后进入了平稳发展期。
虽然 Humira 进入该领域的时间较晚,但是由于其首先占领了 TNF-α 全人抗体的技术制高点,最大程度地克服了非人源抗体的缺陷,从而异军突起成为后起之秀,在销量上领先于上市时间更早的 TNF-α 嵌合抗体 Remicade。
专利申请量(件)16 14 12 10 8 6 4 2 0 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 年份
专利申请量(件)180 160 140 120 100 80 60 40 20 0 1984 1986 1988 1990 1992 1994 1996 1998 2000 2002 2004 2006 2008 2010 2012 年份
1.2 目标国布局分析
Humira 相关专利申请中有 94.7% 是以 PCT 国际专利申请的形式提出,全球 TNF-α 抗体专利申请中仅有72.3% 是以 PCT 国际专利申请的形式提出。通过该比对可以明显看出雅培公司对 PCT 国际专利申请的侧重,也体现了雅培公司对 Humira 相关专利的重视。利用 PCT 专利申请这一方式,雅培公司获得足够的时间进行布局调整,其最早核心专利 WO9729131 总共包括 115 个同族,进入了包括中、美、日、欧、韩等在内的 22 个国家或地区,并利用优先权和分案原则在各国先后提交了多个专利申请,其中中国就有 10 个后续的专利申请。
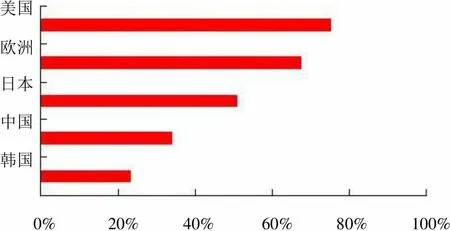
图 3 和图 4 分别展示了 Humira 和全球 TNF-α 抗体相关的 PCT 申请进入中、美、日、欧、韩的比例。可以看出Humira 相关的 PCT 专利申请中,美国是首要的指定国,87.5% 的 PCT 相关申请进入了美国,其次是欧专局(占相关 PCT 申请总数的 75%)和日本(占相关 PCT 申请总数 63.9%)。与美、欧、日三大局相比,进入中国和韩国的申请数量均相对较少(分别占相关 PCT 申请的 55.6% 和 45.3%),但进入中国的专利申请中已经囊括了其最具备应用价值和市场前景的专利申请:如涉及单抗本身及其治疗用途的相关专利。与之相比,全球 TNF-α 抗体相关的PCT 专利申请中,75.1%进入了美国,67.6%进入了欧专局,51.1%进入了日本,34.1%进入了中国,23.3%进入了韩国。Humira 的 PCT 专利申请进入五国的比例均高于全球 TNF-α 抗体进入的比例,可见雅培对各国市场的重视。

美国 欧洲 日本 中国 韩国 0% 20% 40% 60% 80% 100%
美国 欧洲 日本 中国 韩国 0% 20% 40% 60% 80% 100%
1.3 Humira 在中国的专利法律状态分析
中国专利申请的法律状态主要有审查阶段、授权后保护以及失效。与 Humira 相关的中国专利申请总共 73 件。授权后保护的有 14 件(占 19%),失效的有 10 件(占 14%),仍处于审查阶段的有 49 件(占 68%)。已经授权的专利囊括了 Humira 的全人单抗 D2E7、含 D2E7 的含水药物制剂、D2E7 的主要适应证、抗体制备/纯化方法等在内。其中最早核心专利 WO9729131 于 1998 年进入中国并于 2006 年获得专利授权,授权的权利要求覆盖了抗体产品、药用组合物、治疗自身免疫病在内的多种疾病的药物制备用途,保护面非常广,该专利将于 2016 年到期。仿制企业可以等该专利保护期满后上报资料申请上市。WO2004016286 保护了包含 D2E7 的液体制剂,于 2005 年进入中国并于 2011 年获得授权。WO2006125229 扩大适应证范围,保护了包含 D2E7 抗体在内的 TNF-α 抑制剂治疗腐蚀性关节炎的用途,于 2007 年进入中国并于 2013 年获得授权。目前仍处于审查阶段的专利申请,主要是围绕Humira 的高浓度注射制剂、抗体粉末、其他适应证、递送方式等的外围专利。对于正处于实审阶段的申请,国内相关药企也应密切关注,通过研究已有工艺、剂型等,及时进行改进并申请自己的专利,另一方面则可以不符合专利法及其实施细则的相关规定提出合理的公众意见,尽可能地在复审或司法程序前,将竞争方的保护范围尽量缩小,以保证自身的市场地位。
1.4 专利技术发展路线分析
作为 TNF-α 抗体领域的明星产品,Humira 的专利申请涉及多个技术主题,包括产品、制备方法和用途。其中产品类型的专利申请占了总申请的半壁江山,比例高达 44%。相比较而言,制备方法和用途类型的专利申请较少,分别占 29% 和 27%。下面将着重分析 Humira 相关的产品和制备方法的专利技术路线。
⑴产品专利技术路线
图 5 反映了 Humira 产品专利的布局情况。1996 年,核心专利申请 WO9729131 问世,该申请通过噬菌体展示技术获得了 TNF-α 的全人抗体 D2E7 抗体,即阿达木单抗,最大程度地克服了鼠源抗体的缺陷。由图5 可以看出,继该专利提出至 2005 年之间,没有新的抗体结构研发出来,早期阶段申请主要集中在组合物和药物制剂的研发上。对于液体制剂的研究,雅培公司一直致力于解决高浓度蛋白质制剂易聚集、可溶性和稳定性差的问题。WO2004016286 和 WO2009073569 分别对缓冲液系统和渗滤介质进行研究,提高蛋白浓度的同时降低了聚集。WO2012065072 继续前期液体制剂的研究,提出高浓度抗 TNF-α 抗体制剂能够显著减轻注射疼痛。可见在液体制剂的蛋白浓度问题上,雅培公司步步为营,进行了持续而深入的研发。对于固体制剂而言,该公司着力于解决纯蛋白质溶液进行干燥后的失活问题。除了产品制剂外,联合用药的专利申请起步也较早,且发明点通常是另外一种抗体/毒素,将 Humira 与之联合用于同类疾病的治疗,从而编织多层次的专利保护网。从雅培公司对于包含 Humira 的联合用药的申请来看,明显有“专利圈地”的倾向,也即在获得一种新的抗体或化学产品后,随即将其与具备相同功能或相同疾病应用领域的其他药物联合使用并获得专利保护。
随着基因重组技术的发展,针对 2 种或多种特异性抗原结合位点的人工抗体即双价/多价抗体逐渐成为抗体工程领域的热点。从年代分布来看,雅培公司以 Humira 为基础的双价/多价抗体的研究起步于 2009 年。早期的重组抗体多为二价抗体,如 WO2009149185 利用基因重组技术制备了双重可变结构域免疫球蛋白(DVD-Ig)。WO2010006060 和 WO2013101972 采用相同方式制备了能同时结合 TNF-α 和 PEG2 的双价抗体。随着新抗体的出现以及抗体重组技术的纯熟,研究人员开始构建三价乃至多价抗体。但是,除了对双价/单价抗体的抗原结合能力进行验证外,雅培公司并未对上述抗体作为药物的效果进行验证。可能是由于改变结构后的抗体药物性能的研发需要较长时间,为了能尽快占领专利先机,在验证了抗原结合能力后,雅培公司便立即提出了抗体的专利申请。
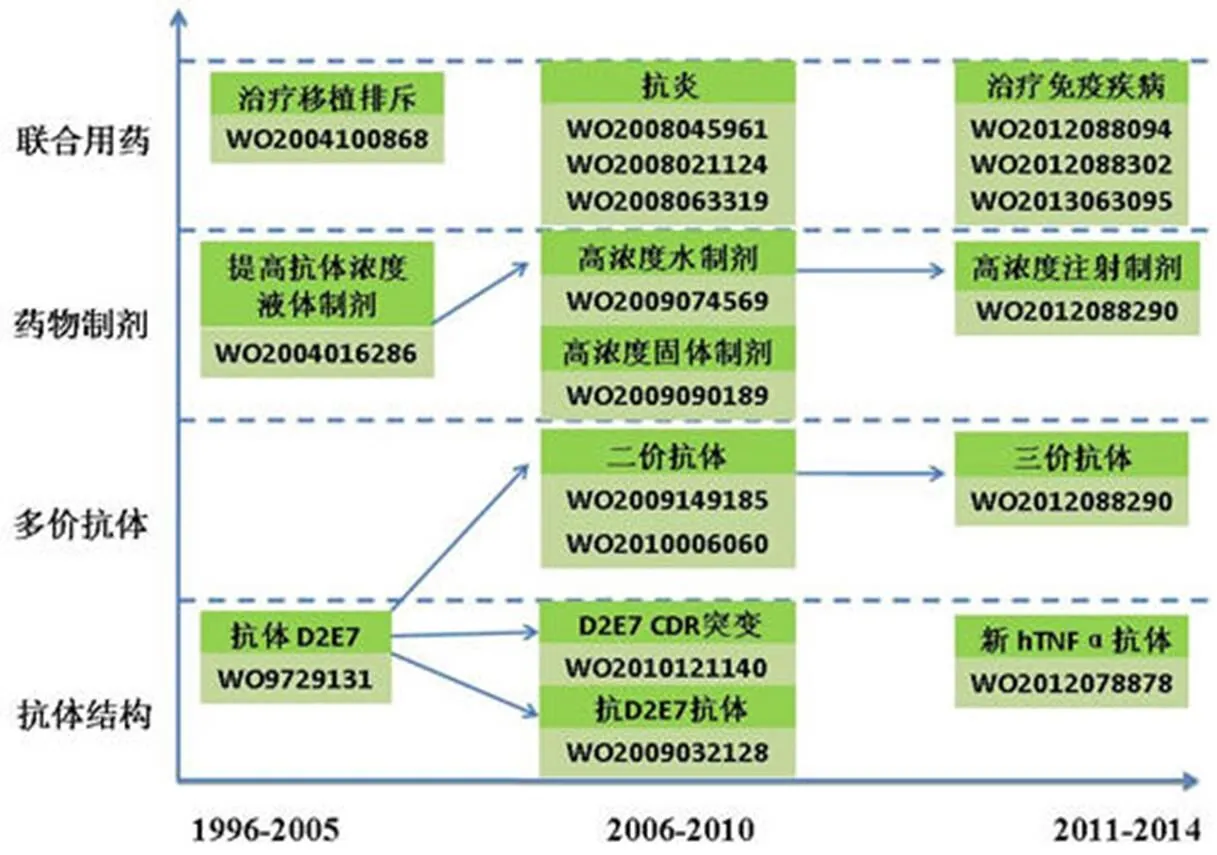
图 5 Humira 产品专利技术路线图
针对抗体的核心结构进行改造是获得新抗体的一大途径,然而,改造后的抗体需要通过漫长的临床试验和药物审批,因此,针对抗体原有序列进行改造的专利申请相对较少。但是,为了防止上市药物专利到期后带来的劣势,及时在上市药物的基础上进行再研发也是必不可少的。因此随着核心抗体专利的即将到期,雅培公司于 2010 年开始将目光转向核心抗体 CDR 的突变,专利申请 WO2010121140 在TNF-α 抗体D2E7 的可变区CDR 的氨基酸序列中进行了特定位点的氨基酸取代,获得与TNF-α 的结合得到改良、免疫原性降低的变异体。此外,除对 D2E7 抗体进行改造外,雅培公司还研发了其他抗 TNF-α 的新抗体,其中 WO2012078878 获得了多个新的人源化 hTNF-α 抗体。WO2009032128 制备了抗阿达木单抗的抗体,用于阻止阿达木单抗与其靶 TNF 的结合。这些改造抗体或新抗体的研发,无疑为以后开发替代阿达木单抗的药物埋下了伏笔。
总体来说,围绕 Humira 的产品专利申请主要集中在药物组合物和药物制剂的改进方面,多价抗体和新抗体的相关专利申请出现时间较晚,均是为了保证雅培公司在专利申请到期之前能够推陈出新,避免专利到期带来的压力。这提示相关企业,在研发力量不足的情况下,可以优先围绕药物的衍生产品进行相关专利布局,在后续研发力量和资金充足时,再进行新产品的开发。
⑵制备方法专利技术路线
抗体药物在临床和商业上的成功必然导致对高质高效的抗体大规模生产工艺的需求。除了研发新抗体之外,对已有抗体药物建立大规模的生产平台也是各大生物公司竞相关注的焦点,因此,为了完善对 Humira 的专利保护,雅培公司围绕阿达木单抗的制备方法也不断进行着改良。
图 6 反映了 Humira 工艺改进上的专利演进情况。雅培公司对工艺技术路线的改良具有明显的时间分布特点。在成功研制获得了有效的全人抗体后,该公司首先对抗体的发酵生产进行了相关专利的申请,并以此为起点开始围绕Humira的制备工艺进行专利布局。
抗体药物的生产主要依赖于重组的动物宿主细胞对外源蛋白的表达,宿主细胞系生产能力的提升是构建工程细胞的核心之一。在该方面,雅培公司着重通过对重组表达载体元件的发现或改进来提升宿主细胞的抗体表达量,先后有两件专利申请在中国被授予了专利权(WO2008121324、WO2009091912),其分别保护了一种增加宿主细胞中重组蛋白表达的重组表达载体元件 rEVE 和包括 orP 复制起点和 SV40 复制起点的附加型载体。
随着上游工艺的改进,人们已经能够有效实现抗体的扩大化生产,但新的问题随之产生,上游细胞培养过程产生的大量高浓度产物以及在培养过程中增多的杂质、异构体对下游纯化步骤构成了巨大的压力[5]。抗体纯化和精制等下游工艺渐渐成为影响生产成本和成品输出量的瓶颈。在这一技术背景下,2007 – 2009 年,雅培公司将对抗体生产工艺的改进集中到了下游纯化领域,其改进策略主要基于对纯化步骤参数的选择和组合,比如选择低 pH 环境(WO2010141093)或进行阳、阴离子交换树脂的联合使用并配合选择导电率、pH 等参数(WO2007117490)。除此之外,该公司还将目光转向了抗体结晶(WO2009020654 和 WO2008057240),对抗体晶体的改进,不仅实现了对下游工艺的改进,获得了稳定性、安全性更强的药物,也实现了对抗体剂型的改进,使高剂量 mAb 制剂成为可能。
抗体异质性也是抗体药物生产中不可避免的一个方面。在生产过程中由于受到诸如酶解反应或自发性降解等复杂培养环境的影响,必然会出现抗体的异质性,这种异质性主要体现在翻译后的修饰和降解上[6],它的最大危害在于可能会影响抗体药物的安全性和疗效。控制或减少抗体异质性产生的异构体可以通过纯化来实现,但异构体的种类和比例更大程度上是由细胞系和细胞培养条件决定,因此主要还是需要从细胞培养工艺入手,通过改良细胞培养工艺控制异构体的比例。近年间,雅培公司在制备工艺上的布局也明显集中到了该领域,先后申请了 4 项专利,分别通过向细胞培养基中添加不同的元素(比如锰、锌)、特定的氨基酸组分、不同成分和比例的水解产物和(或)调节培养基 pH 等参数,控制抗体的糖基化异质性(WO2012149197、WO2014035475)、C 端赖氨酸异质性(WO2013158273)、涉及电荷异质性的酸性异质性(WO2013158275)。尽管这些涉及抗体异质性调控的专利申请均未进入中国,但不排除是由于这些申请相对较新,还未能进入中国国家阶段。
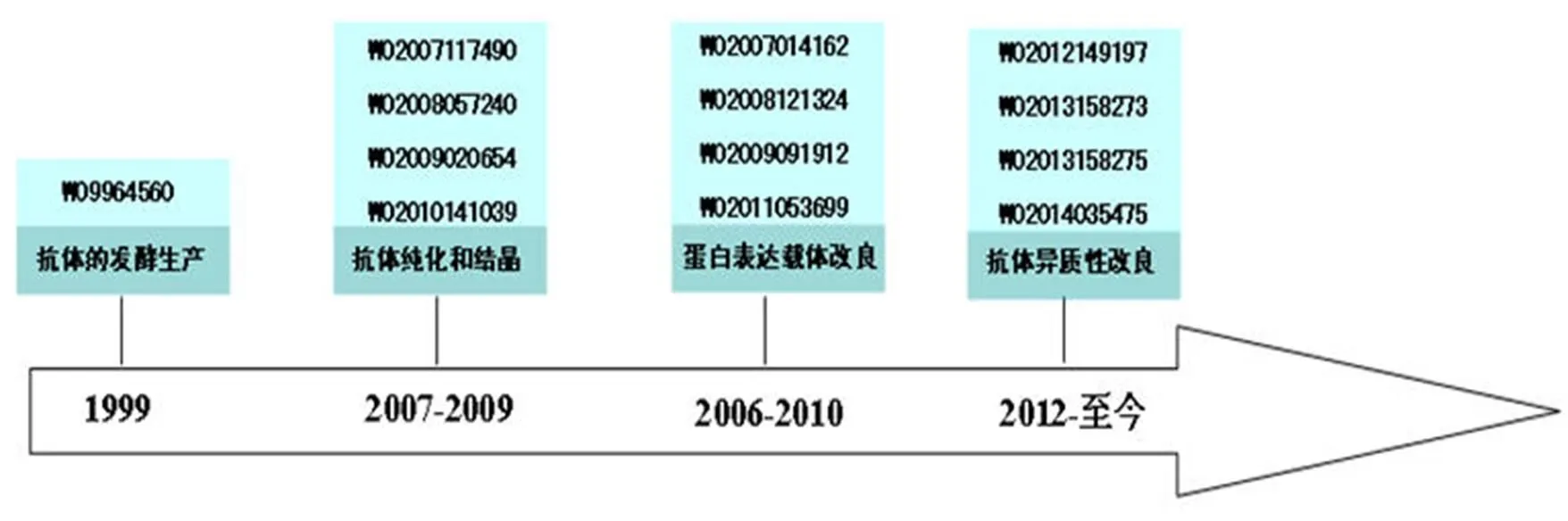
图 6 Humira 制备方法专利技术路线图
尽管抗体大规模生产已经是本领域的常规技术,从原理上看似并不复杂,但抗体的制备是关系到产品疗效、企业成本的关键因素,因此对生产工艺的探索一直都未停止,这也给制备工艺的发展创造了空间。同时,抗体大规模生产技术往往具有通用性,不仅适用于一种抗体,这也提示了国内企业可以从生产技术入手,在现有技术的基础上对抗体大规模生产中的具体方面进行改良并寻求专利保护。
2 专利保护策略
专利保护对于高风险、高投入、高回报的医药公司来说十分重要。相关企业应当重视专利申请,完善自身的知识产权保护制度,加强自身专利网的建设,在激烈的医药竞争中占有一席之地。
2.1 抢占先机,及时扩张
目前大多数国家对专利保护实行先申请制度。而药物研发过程比较漫长,从发现核心化合物到药物上市,通常需要经历几年到十几年,而且后续药物研发过程中参与的人员也越来越多,技术外漏的风险较大。因此对于发现的核心抗体,应当尽早申请产品专利。通常在临床前的研究阶段便申请抗体结构的专利。Humira 的阿达木单抗核心专利比后续的外围专利早了 7 年。
在获得核心专利后,要从多个角度入手,围绕核心专利申请一系列的外围专利,包括剂型专利、组合物、制备工艺、适应证等,编织一个多角度、多层次、宽范围的专利保护网。另外,对于中小企业或研发能力有限的申请人而言,可以在领先专利技术的基础上对其衍生技术进行广泛而高效的研究,变被动为主动,与竞争对手相互制衡。
2.2 多手段延长专利期限
药物的专利保护期为 20 年,对于提早申请的抗体专利而言,药品上市后专利保护期限已经过了一段时间,因此,有效延长专利保护期限是使利益最大化的重要手段。
从 Humira 的专利申请来看,绝大多数都要求了优先权,其利用优先权原则提交了数个专利申请。而专利保护期限的起算日是专利申请日,因此,利用优先权后续提交的专利申请无疑延长了专利寿命。另外,通过外围专利的研发,包括新的药物组合物、新的药物制剂等研发周期短、成果获得快的后续专利也能够延长以核心抗体为基础的药物专利的有效期。
2.3 合理利用 PCT 国际申请
Humira 的绝大部分专利均提交了 PCT 国际申请,核心专利进入了 22 个国家或地区。这一点不仅仅是参与国际竞争的勇气体现,更是药物领域的重要专利保护策略。PCT 国际申请除了能够简化向外国申请专利的手续以外,最重要的优势在于可以推迟申请人的决策时间,有利于申请人获得足够的机会进行市场调查和布局调整,从而准确投入资金,节约成本。因此,无论是从手续的简化或是成本控制和市场布局方面,PCT 专利申请对这种极具市场潜力的药物来说都是最佳的选择。
2.4 避重就轻,降低风险
Humira 的产品专利中,新抗体的数量远远少于药物制剂/组合物的数量,一方面是由于在已上市抗体基础上进行制剂或组合物研发要比新抗体容易,另一方面出于风险考虑,从新抗体或者突变抗体到药物上市,仍然需要重新进行药物审批的各项流程,历时长且不可预测性高。因此,雅培公司将重点放在低风险研究领域,同时对新抗体进行少量研发和申请,以储备新的抗体库。
2.5 关注专利审批过程,跟踪专利法律状态
对于重要专利的审批过程和法律状态应当予以关注,不仅有助于了解技术走向和技术动态,用以指导企业自身的研发,在已有专利的基础上进行二次创新并构建企业自身的专利防护网。同时,针对审批专利提出合法合理的公众意见,有效缩小其授权范围,为企业自身的发展提供更大的空间。
TNF-α 抗体的研发蕴含着无数机会,也潜伏着诸多风险。Humira 的专利保护期限即将到期,这为该领域抗体药物的发展提供了机会和挑战,研究者应当抓住机遇,加大研究力度,积极参与国际竞争,并充分利用专利战略保护创新成果。
[1] Tracey D, Klareskog L, Sasso EH, et al. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Ther, 2008, 117(2):244-279.
[2] Genetic Engineering & Biotechnology News. The top 25 best-selling drugs of 2013. [2014-03-03]. http://www.genengnews.com/insight- and-intelligence/the-top-25-best-selling-drugs-of-2013/77900053/?kwrd=the%20best-selling%20drug.
[3] Kempeni J. Preliminary results of early clinical trials with the fully human anti-TNFalpha monoclonal antibody D2E7. Ann Rheum Dis, 1999, 58 Suppl 1:I70-172.
[4] Tridente G. Adverse events with Biomedicines. Milano: Springer- Verlag Italia, 2014:71-80.
[5] Li F, Lee B, Zhou JX, et al. Current therapeutic antibody production and process optimization. BioProcess J, 2006, 5(4):16-25.
[6] Duan XJ, Liu R, Xu WT, et al.Effect of cell culture conditions on antibody heterogeneity. Chin J Biotech, 2013, 29(12):1880-1886. (in Chinese)
段须杰, 刘睿, 徐卫涛, 等. 细胞培养工艺条件对抗体异质性影响的研究进展. 生物工程学报, 2013, 29(12):1880-1886.
10.3969/cmba.j.issn.1673-713X.2014.04.016
武雪梅,Email:wuxuemei@sipo.gov.cn
*作者武雪梅、罗洋排名不分先后,两人并列第一作者

