基于抗体和配体的肿瘤靶向肽药物研究进展
李斌,郑艳波,李良,甄永苏
过去的二十年,肿瘤治疗已经从非特异性的化疗向具有选择性的基于发病机制的疗法转变[1]。分子靶向治疗作为肿瘤治疗的新手段,正以其疗效高、不良反应少且轻等特点而备受瞩目,现已成为肿瘤治疗领域的研究热点。它以肿瘤微环境、肿瘤细胞细胞膜或细胞内特异性表达或高表达的分子为作用靶点,能够更加特异地作用于肿瘤细胞,阻断其恶性增殖、转移或诱导其凋亡,同时降低了对正常细胞的杀伤作用,因此是十分有前途的肿瘤治疗方法之一[2]。
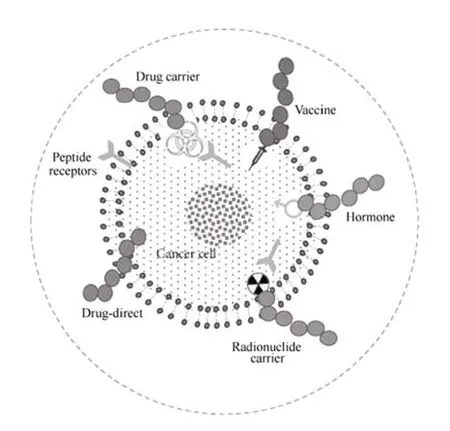
图1 肽类药物在肿瘤中的应用[3]
1 基于抗体的肿瘤靶向肽药物
抗体分子重链和轻链的可变区中,各有 3 个区域的氨基酸序列高度变化,称为高变区(hypervariable region,HVR)或互补决定区(complementarity determining region,CDR),分别为 CDR-H1、CDR-H2、CDR-H3 和 CDR-L1、CDR-L2、CDR-L3,它们共同形成一个能够识别及结合抗原的三维表面互补区(图 2)。CDRs 决定着抗体的特异性与亲和力,在抗原结合中起着关键作用。研究表明,抗体的特异性由为数不多的氨基酸残基决定,这为基于抗体 CDRs 的肽段保留完整抗体的结合活性和生物学功能提供了可能,为抗体的小型化奠定了良好的理论基础[6-7]。
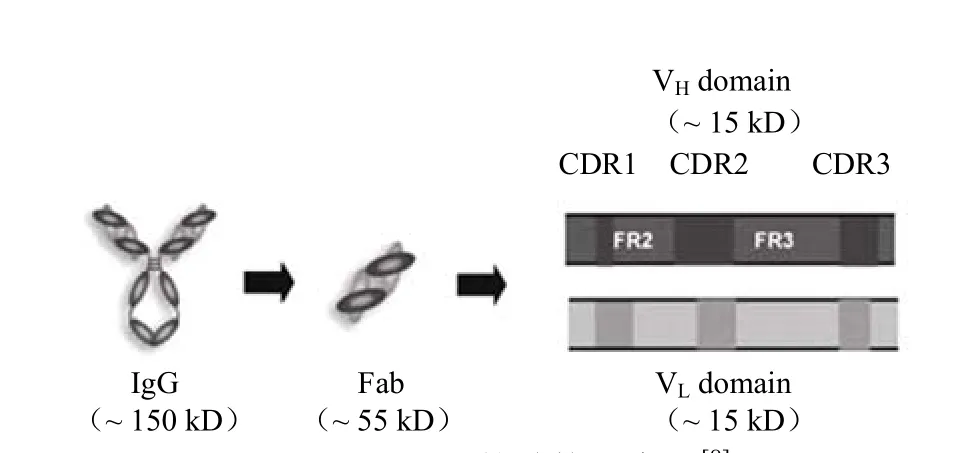
图2 CDRs 的结构示意图[8]
1.1 来源于抗体 CDRs 的肿瘤靶向肽药物
来源于抗体 CDRs 的 CDR-H3 序列也称“微(小)抗体(micro/miniantibody)”,它和完整抗体具有类似的特异性。CDR-H3 位于抗原识别位点的中心位置,在免疫反应中发挥着重要作用,剩下的 CDRs 则围绕其周围以进一步增加其亲和力。最近研究表明,除了 CDR-H3 以外,其他单独的 CDRs 也可能通过先天免疫反应分子来发挥生物活性[7]。C7L1、C7L2、C7L3、C7H1、C7H2 和 C7H3 是衍生于单克隆抗体 C7(抗白色念珠菌细胞壁甘露糖蛋白抗体)CDRs 6 个区域的 6 种肽段,Blast 比对结果表明它们和生物体分泌的天然肽类的氨基酸序列存在很大差异。这些肽段经过一系列体外体内测试后,发现基于 CDR-H2 的C7H2 肽(YISCYNGATSYNQKFK)具有最佳的抗肿瘤效果。它能显著抑制鼠黑色素瘤细胞 B16F10 的生长(IC50值为 50 μmol/L)、引起 DNA 的降解,此外还可导致黑色素瘤细胞以及白血病细胞的凋亡(caspase 依赖型),其凋亡活性与肽的受体结合活性有关[7]。后续研究表明,C7H2 的分子靶点为 β-肌动蛋白,它可诱导 β-肌动蛋白的聚合、F-肌动蛋白的稳定以及肿瘤细胞的死亡,而且可以抑制肿瘤的转移,但对正常细胞以及小鼠无明显的毒性[9]。
同时来自于 CDRs 的肽段,其体内生物活性的有无可能与 CDR 的选择以及有无间隔区有关。为了确定最佳的配对方式,有人将抗 EB 病毒包膜抗原的 HB-168 抗体 CDR1 或 CDR2 与 CDR3 通过 CDR 以外区域的骨架区 2(framework region,FR2)连接起来,形成不同组合的拟肽,其中以 CDR H1-FR H2-CDR L3(含 28 个氨基酸)形式组合的拟肽的抗原结合活性最高,且其穿透并富集于实体瘤的能力比完整抗体强;而无间隔区的拟肽,如 CDR H1-CDR L3、6 个 CDRs 形成的环肽等,由于缺乏“准生理学”间隔区,它们与抗原表位界面的结合有所减弱。由此可见通过间隔区连接的 CDRs 更加接近天然抗体 CDR 的构型,而且处于对角线位置的 CDR1 和 CDR3 对抗原的识别起着重要的作用[10-11]。
1.2 模拟抗体和受体相互作用的肿瘤靶向肽药物
表皮生长因子受体 2(human epithelial growth factor receptor 2,HER2/ErbB2)是表皮生长因子家族成员之一,与其他 3 个家族成员不同,HER2 没有与之对应的配体,且以同源或异源二聚体形式发挥作用。HER2 的表达水平与乳腺癌的生长、转移及预后呈现明显的正相关性。帕妥珠单抗(用于治疗 HER2 阳性转移性乳腺癌的人源化单克隆抗体)拟肽 HRAP(Ac-PHAHF-NH2)是首次利用基于结构的药物设计(structure-based drug design,SBDD)软件模拟帕妥珠单抗和 HER2 的结合位点,并通过优化得到的一条可以特异性地与 HER2 二聚体功能域结合的短肽。该肽可通过抑制 PTEN 和 Akt 的磷酸化来抑制 HER2 过度表达的乳腺癌细胞的增殖,此外它还可以增强紫杉醇的细胞凋亡诱导活性[8,12]。
肽疫苗是肽类药物研究的热点之一,最新临床数据表明目前进入临床试验的肽类药物大部分为肽疫苗[13]。MVF 266 Cyc 是基于帕妥珠单抗结合 HER2 胞外域的单晶结构模拟设计的一种帕妥珠单抗样肽疫苗,其动物体内疗效与帕妥珠单抗相差无几,但无抗体常见的副反应。MVF 597 Cyc 是利用同样的方法设计的肽疫苗,其生物活性与曲妥珠单抗类似。另外一种已进入临床 I 期试验,用于免疫疗法的肽疫苗 14633 则是由帕妥珠单抗样肽段 MVF HER-2 [597-626]和帕妥珠单抗样肽段 MVF HER-2 [266-296] 两部分组成,可以靶向 HER-2 胞外域的两个不同表位[14]。
AHNP(anti-HER2/neu peptidomimetic)是以抗 HER2单克隆抗体 4D5(Herceptin,赫塞汀,用于治疗 HER2 过度表达的转移性乳腺癌)和 HER2 复合物的三维结构为基础设计出的一段环外小肽(FCDGFYACYKDV,分子量为1.5 kD)。AHNP 二级结构与抗体的 CDR3 类似(同为β-转角结构),向外延伸的疏水性尾巴则与抗体的 FR 类似(呈现 β-折叠样的扩展结构)。体外结果表明 AHNP 和HER2 具有很高的结合能力,其亲和力常数 KD值高达300 nmol/L,体内结果则表明 AHNP 可以模拟抗体 4D5的功能,从而发挥抗肿瘤疗效。此外,AHNP 与其他化疗药物联用可以增加它们的疗效。目前,AHNP 作为一种新颖的小分子探针已广泛用于临床前研究[15-16]。
AERP(anti-EGF receptor peptidomimetic)则是基于相同原理,以抗体 C225的 CDR-H3 为模板设计的一段抗EGFR 十六肽(YCASRDYDYDGRCYFD)。AERP 和 EGFR的结合呈现浓度依赖性,其 KD为 400 nmol/L,经99mTc标记的 AERP 可在肿瘤部位特异性富集,其肿瘤与血液的浓度比是单链抗体(single-chain antibody fragment,scFv)的 3.2 倍,但不足的是它在肝脏和肾脏也有大量分布,其药代动力学有待进一步提高[16-17]。
综上所述,宫颈新柏氏技术抹片异常患者行阴道镜下活检有助于提高宫颈疾病的诊断率,且检测Ki-67、p16及p53蛋白的表达结果提示三者过高表达可能参与CIN、宫颈癌的发病过程。
2 基于配体的肿瘤靶向肽药物
自从发现特异性受体以来,配体的肽类似物就因为具有良好的受体结合活性、低免疫原性以及独特的生物动力学行为而广泛用于癌症的诊断和治疗[18-21]。本部分以目前常见的受体来对基于配体的肿瘤靶向肽药物进行分类。
2.1 作用于激素受体
促黄体激素释放激素(luteinizing hormone-releasing hormone,LHRH)肽类激动剂是治疗前列腺癌的最经典的例子。目前,已上市的激动剂有:布舍瑞林、戈舍瑞林、组氨瑞林、亮丙瑞林和曲普瑞林。这些激动剂是 LHRH 的类似物,可以下调垂体的促黄体激素释放激素受体,从而抑制促卵泡激素、促黄体激素以及睾丸酮的释放。随后发现的肽类拮抗剂如阿巴瑞克、西曲瑞克、地加瑞克等进一步提高了激素阻断疗法的疗效[3]。
自 20 世纪 80年代以来,大量数据表明多数肿瘤细胞胰岛素样生长因子受体(insulin-like growth factor-1 receptors,IGF-1R)呈现高表达。流行病学研究也显示血清 IGF-1 水平和患乳腺癌及前列腺癌的风险相关。IGF 信号系统在肿瘤发生发展中起着至关重要的作用,IGF-1R 作为靶向治疗的靶点被广泛研究[22-23]。JB3(D-CSKAPKLPAAYC)作为IGF-1 最有效的类似物,可以和内源性配体竞争性结合IGF-1R,从而抑制某些肿瘤的生长。JB3 通过二硫键形成12 肽,其中包含一个 D 型氨基酸,可有效对抗酶的水解。简化 JB3 后得到的环 4 肽 JB9(D-CSKC)也可有效地富集于 IGF-1R 阳性肿瘤部位[24]。
另外,与肿瘤有关的激素受体还包括生长抑素受体(somatostatin receptors,SSTRs)、血管活性肠肽受体(vasoactive intestinal peptide receptors,VIPRs)等[19]。
2.2 作用于 EGFR
表皮生长因子受体(epidermal growth factor receptor,EGFR)在许多肿瘤细胞中过量表达,与肿瘤细胞的增殖、分化和转移等关系密切[25]。
EGFR 的天然配体 EGF 具有很强的生物活性,可能引起免疫原性等问题,因此必须寻找新的靶向分子。EGF 含3 个由二硫键形成的环状结构,其中 B 环与 EGFR 结合有关,活性区序列为 CMYIEALDKYAC。人工合成的环肽可以靶向 EGFR 过表达肿瘤细胞,并可作为药物的载体以提高化疗药物的抗肿瘤疗效、降低全身性毒性[26]。
另外,也有研究表明 EGF 的 C-端在配体-受体结合过程中发挥着重要作用[27]。通过基因工程技术将 EGF 的C 环 22 个氨基酸(简写成 Ec)与力达霉素的辅基蛋白(lidamycin apoprotein,LDP)融合形成的融合蛋白 Ec-LDP便是一个很好的例证。ELISA 和细胞流式检测结果均显示Ec-LDP 蛋白对 EGFR 高表达的肿瘤细胞系 A431 和MCF-7 都有很强的免疫结合活性,而对不表达 EGFR 的NIH3T3 细胞则无结合活性,免疫荧光实验也证实 Ec-LDP蛋白可与 A431 细胞膜受体结合。在此基础上构建的双靶向融合蛋白 Ec-LDP-Hr 可同时靶向 EGFR 和 HER2,进一步证实了 Ec 寡肽的靶向性[28-29]。
2.3 作用于整合素受体
整合素(integrin)是由 α 亚基和 β 亚基组成的异源二聚体,它是一类细胞表面受体,其配体是细胞外基质蛋白,如胶原蛋白、纤黏连蛋白、层黏连蛋白、细胞间黏附分子、血管细胞黏附分子等[30]。影响肿瘤血管生成的整合素主要包括 4 种:αvβ3、αvβ5、α5β1和 α2β1。其中 αvβ3是最引人关注的肿瘤血管新靶标[31]。
整合素和配体的识别过程与配体的特定氨基酸序列有关。1997年,Pasqualini 等[32]注意到大多数整合素与细胞外基质的识别位点都含有一个共同的 Arg-Gly-Asp(RGD)三肽模体,并首次证明包含 RGD 序列的短肽可与整合素αv(αvβ3以及 αvβ5)特异性结合。西仑吉肽(EMD121974,cilengitide)为环状 RGD 肽 c(RGDfV)的 N-甲基化衍生物,是第一个以 αvβ3为靶点进入 III 期临床的抗肿瘤药物,II 期临床结果表明对多种肿瘤有效。另外一个靶向整合素 αvβ3、αvβ5和 α5β1的药物 ATN-161(Ac-PHSCN),已经进入 II 期临床,用于治疗头颈部肿瘤[33]。
包含 RGD 序列的短肽不仅可以单独发挥作用,还可以和其他生物活性蛋白融合在一起,协同发挥抗肿瘤作用。含有 4 个半胱氨酸的短肽 ACDCRGDCFCG(RGD-4C)和比内皮抑素活性强 20 倍的含 192 个氨基酸的血管内皮生长抑制剂 VEGI-192 的 N-端融合形成的双功能融合蛋白 RGD-rhVEGI-192,不仅可以抑制鸡胚绒毛尿囊膜新生血管的形成,而且可以强效抑制内皮细胞的生长,从而在移植乳腺癌模型中显示了较好的抗肿瘤疗效[34]。
2.4 作用于 CD13
含 Asn-Gly-Arg(NGR)序列的短肽作用的受体为CD13。CD13 又称氨肽酶 N(aminopeptidase N,APN),是一种跨膜糖蛋白,过度表达于肿瘤新生血管内皮细胞和大部分肿瘤细胞,在肿瘤血管生成过程中扮演着重要的角色[35-36]。
2000年,意大利研究人员采用基因工程技术将含NGR 的序列(CNGRC)与人 TNF-α 的 N-端连接制备了融合蛋白 NGR-TNF[37]。I 期和 II 期临床试验表明NGR-TNF 单独使用或与化疗药物联合治疗复发性乳腺癌以及亚种群胸膜间皮瘤和肝细胞癌时,不仅可以达到较好的抗肿瘤效果,同时患者可以耐受。目前,该蛋白(NGR015)正处于 III 期临床试验,用于治疗恶性胸膜间皮瘤[38-40]。
此后,类似的融合蛋白相继出现,如 NGR-IFN α2a 和NGR-LDP。其中 NGR-IFN α2a 是将含环状 NGR(CNGRC)与干扰素 α2a(IFN α2a)的 C-端融合而成的融合蛋白。放射性锝标记的 NGR-IFN α2a 在荷瘤 MHCC97-H 小鼠体内获得了令人满意的显像结果。临床前毒性研究表明NGR-IFN α2a 单独使用时在达到治疗剂量的情况下小鼠和猴可以耐受[41-44]。
NGR-LDP 则是将 CNGRC 和力达霉素辅基蛋白(LDP)通过 GCG 连接形成的融合蛋白。结合实验证实该蛋白可特异性地和高表达 CD13 的 HT-1080 细胞结合。NGR-LDP 和力达霉素烯二炔发色团(AE)组装后得到的强化融合蛋白 NGR-LDP-AE 可以显著地抑制鼠 H22 肝癌和人 HT-1080 纤维肉瘤的生长,其抑瘤率分别达到了95% 和 87%;免疫组化结构表明 NGR-LDP 可以结合肿瘤血管[45]。
除上述研究结果外,目前正处于研究阶段的肿瘤靶向肽药物相关受体还有血管内皮生长因子受体[46]、转铁蛋白受体[47]、白介素受体[48]、B 细胞受体[49]等。
3 靶向肽-药物偶联物
抗体-药物偶联物(antibody-drug conjugate,ADC)是一类将抗癌制剂偶联于抗体的药物,主要用于肿瘤的治疗。最近来,随着“小型化”概念的提出,肽-药物偶联物也不断涌现。
3.1 单功能靶向肽-药物偶联物
部分肿瘤靶向肽可以直接发挥抗肿瘤作用,还有部分可以作为药物的靶向输送载体。KCCYSL 肽是可以特异性和ErbB2 结合、可用于肿瘤显像的六肽序列,将该序列和裂解肽通过连接形成的杂合肽,对所有测试的卵巢癌和乳腺癌细胞,甚至对曲妥珠单抗和拉帕替尼耐药的细胞均显示出较高的细胞毒活性,在 5 min 内即可裂解 ErbB2 高表达的SK-BR-3 细胞的细胞膜。另外,该杂合肽还可以显著地抑制荷瘤 BT-474 和 MDA-MB-453 裸鼠肿瘤的生长[50-51]。KCCYSL 肽和高效酸肌醇激酶抑制剂 TGX-D1 通过 PSA可裂解肽 SSKYQ 偶联形成的偶联物(KCC-TGX)可以被前列腺癌表达的 PSA 断裂而释放母体药物 TGX-D1。体外实验表明,高表达 ErbB2 的前列腺癌 LNCaP 细胞对KCC-TGX 的摄取量明显高于 TGX-D1,且 KCC-TGX 的活性得到了保留[52]。
低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein,LRP)可透过血脑屏障将配体转运进入内皮细胞。LRP 受体不仅表达于脑毛细血管内皮细胞而且在多种恶性胶质瘤中有表达。抑肽酶(aprotinin)是低密度脂蛋白受体相关蛋白配体的抑制剂,在牛脑毛细血管内皮细胞的转胞吞作用比转铁蛋白至少高 10 倍[53-54]。肽家族angiopeps 是基于抑肽酶氨基酸序列和人 Kunitz 型结构域设计出的一类肽类化合物,体外血脑屏障模型和原位脑灌注模型证明该家族成员特别是 angiopep-2(TFFYGGSRGKRN NFKTEEY)具有比抑肽酶更强的转胞吞能力[53]。Angiopep-2和紫杉醇、阿霉素、依托泊苷偶联形成的偶联物 ANG1005、ANG1007、ANG1009 均能很好地通过血脑屏障进入脑部位。临床前研究表明,ANG1005 进入脑实质部位的浓度是紫杉醇的 100 倍左右,并且可以绕过 p-糖蛋白。2007年,Angiochem 公司以惊人的速度将其推入 I 期临床试验,主要针对恶性胶质瘤和脑转移瘤患者,2008年的评估结果显示 ANG1005 安全且耐受性良好[55]。
RGD 和 NGR 三肽由于作用靶点明确,特异性高,常被用作靶向载体。为了提高喜树碱类化疗药物的治疗指数,意大利技术人员合成了一系列 RGD 肽-喜树碱偶联物,其中有 2 个偶联物(两个 RGD 肽和喜树碱衍生物通过溶酶体可断裂的丙氨酸-瓜氨酸二肽序列和多个分支乙二醇链连接而成)具有高受体亲和力、高肿瘤细胞黏附力、高细胞毒性以及良好的稳定性,现正处于临床前的体内疗效和急性毒性评价中[56]。另外有研究表明将 RGD 三肽和抗肿瘤抗生素云南霉素制成偶联物后,其细胞毒活性较 RGD 肽强,且具有与 RGD 肽相当的抗肿瘤细胞侵袭能力[57]。早在NGR 序列发现之初,有学者就尝试将 NGR 和阿霉素偶联,并取得了较为满意的结果[58]。NGR-LDP-PYM 则是利用 NGR-LDP 融合蛋白作为支架,将抗肿瘤抗生素平阳霉素(pingyangmycin,PYM)偶联于其上形成的蛋白-药物偶联物。该偶联物不仅保留了 PYM 的部分细胞毒活性和DNA 切割活性,而且可以特异地与 CD13/APN 高表达的肿瘤细胞结合,此外偶联作用还可显著增强 PYM 抵抗博来霉素水解酶水解的能力[59]。
3.2 双功能靶向肽-药物偶联物
有些药物与靶向肽偶联以后并没有达到预想的抗肿瘤效果,可能原因是其内化效率低。细胞穿透肽(cell-penetrating peptide,CPP)是一种富含碱性氨基酸的短肽,可以轻易穿透细胞膜。为了克服上述偶联物的不足,有研究者将肿瘤靶向肽和穿透肽通过柔性氨基酸相连,形成靶向-穿透双功能肽如 GRD-Tat、PEGA-pVEC、gHo-pVEC等。以这些肽作为载体形成的偶联物可以特异性地将DNA、基因、化疗药物带入肿瘤细胞内,从而达到消灭肿瘤细胞的目的[60-63]。
最近,科学家们还把焦点放在了一种同时具有靶向和穿膜功能的细胞穿透归巢肽(cell penetrating homing peptides,CPHPs)上[64]。2009年,伯纳姆医学研究所癌症研究中心首次报道了内化 RGD(internalizing-RGD,iRGD,CRGDKGPDC),该序列既包含 RGD 基序又包含在血管生成、心血管发育和感应血管渗透性方面发挥着重要作用的靶向神经纤毛蛋白(neuropilin-1,NRP-1)的 R(K)XXR(K) 基序。该基序为 VEGF-A165 的一部分,只有处于 C-端,即符合“C 端规则”时才能显示出穿透能力[65]。iRGD 通过三步进入肿瘤细胞,首先 iRGD 的 RGD 基序和肿瘤血管整合素 αvβ3、αvβ5结合;然后在蛋白酶的作用下,暴露出RGDK 基序;最后和神经纤毛蛋白结合,穿透细胞膜进入细胞。iRGD 和其他药物联合使用,可以提高多种药物如小分子化合物、纳米药物和单克隆抗体的疗效指数,用 IRDye 800CW、DOTA 标记的 iRGD 可以靶向肿瘤显像。另外,iRGD 和其他试剂偶联,可明显提高肿瘤显像敏感性,增强抗肿瘤药物的疗效[66-67]。
2013年,该研究中心又根据 iRGD 序列,重新设计了内化 NGR(internalizing-NGR,iNGR,CRNGRGPDC),其靶向肿瘤血管和渗透肿瘤组织的能力比 NGR 肽更加有效,另外它还可将偶联的纳米粒带入肿瘤内部,从而更好地发挥纳米药物的疗效[68]。
4 结语
肽是蛋白质-蛋白质相互作用的基础,对特定分子靶点有高度特异性;同时,组成肽链的氨基酸可随意组合,易于设计针对不同靶点的靶向肽;此外,肽还可以进行拼接和组装,可作为药物的靶向载体。这些优点使得肽在肿瘤诊断和靶向治疗方面有着无可比拟的优势。然而,肽类药物也有一定的局限性,如半衰期相对较短、靶向性不如抗体及配体等,这些不足限制了肽类药物的临床应用。但化学家也有相应的应对办法,比如可以通过化学方法(如将 L 型氨基酸置换成 D 型氨基酸、引入新的官能团、与放射性核素及细胞毒药物偶联)来优化它们的生物活性、酶稳定性以及药代动力学等性质,从而提高它们疗效[16,69-70]。
[1] Vanneman M, Dranoff G.Combining immunotherapy and targeted therapies in cancer treatment.Nat Rev Cancer, 2012, 12(4):237-251.
[2] Zhan Q.Progress in the application of molecular targeted drugs for cancer therapy.Shanghai Med Pharm J, 2011, 32(12):577-581.(in Chinese)詹琼.肿瘤分子靶向治疗药物的应用进展.上海医药, 2011, 32(12):577-581.
[3] Thundimadathil J.Cancer treatment using peptides: current therapies and future prospects.J Amino Acids, 2012, 2012:967347.
[4] Brown KC.Peptidic tumor targeting agents: the road from phage display peptide selections to clinical applications.Curr Pharm Des,2010, 16(9):1040-1054.
[5] Zhang XX, Eden HS, Chen X.Peptides in cancer nanomedicine: drug carriers, targeting ligands and protease substrates.J Control Release,2012, 159(1):2-13.
[6] Levi M, Sällberg M, Rudén U, et al.A complementarity-determining region synthetic peptide acts as a miniantibody and neutralizes human immunodeficiency virus type 1 in vitro.Proc Natl Acad Sci U S A,1993, 90(10):4374-4378.
[7] Polonelli L, Pontón J, Elguezabal N, et al.Antibody complementaritydetermining regions (CDRs) can display differential antimicrobial,antiviral and antitumor activities.PLoS One, 2008, 3(6):e2371.
[8] Nakajima H, Mizuta N, Sakaguchi K, et al.Development of HER2-antagonistic peptides as novel anti-breast cancer drugs by in silico methods.Breast Cancer, 2008, 15(1):65-72.
[9] Arruda DC, Santos LC, Melo FM, et al.β-Actin-binding complementarity-determining region 2 of variable heavy chain from monoclonal antibody C7 induces apoptosis in several human tumor cells and is protective against metastatic melanoma.J Biol Chem,2012, 287(18):14912-14922.
[10] Qiu XQ, Wang H, Cai B, et al.Small antibody mimetics comprising two complementarity-determining regions and a framework region for tumor targeting.Nat Biotechnol, 2007, 25(8):921-929.
[11] Qiu XQ.CDR-FR peptides//KontermannR, Dubel S.Antibody engineering Vol.2.Germany: Springer, 2010:267-276.
[12] Nakajima H, Mizuta N, Sakaguchi K, et al.Enhancement of paclitaxel-induced apoptosis in HER2-overexpressing human breast cancer cells by a pertuzumab mimetic peptide, HRAP.J Biosci Bioeng,2010, 110(2):250-253.
[13] Ahrens VM, Bellmann-Sickert K, Beck-Sickinger AG.Peptides and peptide conjugates: therapeutics on the upward path.Future Med Chem, 2012, 4(12):1567-1586.
[14] Kaumaya PTP, Foy KC.Peptide vaccines and targeting HER and VEGF proteins may offer a potentially new paradigm in cancer immunotherapy.Future Oncol, 2012, 8(8):961-987.
[15] Park BW, Zhang HT, Wu C, et al.Rationally designed anti-HER2/neu peptide mimetic disables P185HER2/neu tyrosine kinases in vitro and in vivo.Nat Biotechnol, 2000, 18(2):194-198.
[16] Murali R, Greene MI.Structure based antibody-like peptidomimetics.Pharmaceuticals (Basel), 2012, 5(2):209-235.
[17] Ponde DE, Su Z, Berezov A, et al.Development of anti-EGF receptor peptidomimetics (AERP) as tumor imaging agent.Bioorg Med Chem Lett, 2011, 21(8):2550-2553.
[18] Riccabona G, Decristoforo C.Peptide targeted imaging of cancer.Cancer Biother Radiopharm, 2003, 18(5):675-687.
[19] Reubi JC.Peptide receptors as molecular targets for cancer diagnosis and therapy.Endoc Rev, 2003, 24(4):389-427.
[20] Lee S, Xie J, Chen X.Peptide-based probes for targeted molecular imaging.Biochemistry, 2010, 49(7):1364-1376.
[21] Rufini V, Calcagni ML, Baum RP.Imaging of neuroendocrine tumors.Semin Nucl Med, 2006, 36(3):228-247.
[22] Werner H.Tumor suppressors govern insulin-like growth factor signaling pathways: implications in metabolism and cancer.Oncogene,2012, 31(22):2703-2714.
[23] Arcaro A.Targeting the insulin-like growth factor-1 receptor in human cancer.Front Pharmacol, 2013, 4:30.
[24] Wickstrom E, Thakur ML, Sauter ER.Receptor-specific targeting with complementary peptide nucleic acids conjugated to peptide analogs and radionuclides.Lett Pept Sci, 2003, 10(3-4):191-214.
[25] Guo Y, Li ZH, Gu JR, et al.Study on the binding ability of new peptide ligand GE11 and EGFR.J Instrumental Anal, 2008, 27(21):1318-1321.(in Chinese)郭妍, 李宗海, 顾健人, 等.新多肽配体 GE11与表皮生长因子受体的结合能力分析.分析测试学报, 2008, 27(21):1318-1321.
[26] Ai S, Duan J, Liu X, et al.Biological evaluation of a novel doxorubicin-peptide conjugate for targeted delivery to EGF receptoroverexpressing tumor cells.Mol Pharm, 2011, 8(2):375-386.
[27] van de Poll ML, van Vugt MJ, Lenferink AE, et al.Identification of the minimal requirements for binding to the human epidermal growth factor (EGF) receptor using chimeras of human EGF and an EGF repeat of Drosophila Notch.J Biol Chem, 1998, 273(26):16075-16081.
[28] Guo XF, Zhong GS, Miao QF, et al.Construction of energized fusion protein consisting of epidermal growth factor receptor oligopeptide ligand and lidamycin and its antitumor activity.Chin J Cancer, 2009,28(6):561-568.(in Chinese)郭晓芳, 钟根深, 苗庆芳, 等.靶向表皮生长因子受体的寡肽与力达霉素强化融合蛋白的构建及其抗肿瘤活性.癌症, 2009, 28(6):561-568.
[29] Guo XF, Zhu XF, Shang Y, et al.A bispecific enediyne-energized fusion protein containing ligand-based and antibody-based oligopeptides against epidermal growth factor receptor and human epidermal growth factor receptor 2 shows potent antitumor activity.Clin Cancer Res, 2010, 16(7):2085-2094.
[30] Sun CF, Chu RT.Integrin and tumor angiogenesis.J Oncol, 2004,10(5):357-359.(in Chinese)孙成法, 褚容涛.整合素与肿瘤血管生成.肿瘤学杂志, 2004,10(5):357-359.
[31] Yan XY.Angiogenesis: a promising strategy for tumor therapy.Acta Biophys Sinica, 2010, 26(3):180-193.(in Chinese)阎锡蕴.肿瘤新生血管及分子靶向治疗新策略.生物物理学报,2010, 26(3):180-193.
[32] Pasqualini R, Koivunen E, Ruoslahti E.Alpha v integrins as receptors for tumor targeting by circulating ligands.Nat Biotechnol, 1997,15(6):542-546.
[33] Mas-Moruno C, Rechenmacher F, Kessler H.Cilengitide: the first anti-angiogenic small molecule drug candidate design, synthesis and clinical evaluation.Anticancer Agents Med Chem, 2010, 10(10):753-768.
[34] Wu J, Jiang Y, Yang W, et al.Dual function of RGD-modified VEGI-192 for breast cancer treatment.Bioconjug Chem, 2012, 23(4):796-804.
[35] Pasqualini R, Koivunen E, Kain R, et al.Aminopeptidase N is a receptor for tumor-homing peptides and a target for inhibiting angiogenesis.Cancer Res, 2000, 60(3):722-727.
[36] Wang X, Wang B, Zhang Q.Anti-tumor targeted drug delivery systems mediated by aminopeptidase N/CD13.Acta Pharm Sinica B,2011, 1(2):80-83.
[37] Curnis F, Sacchi A, Borgna L, et al.Enhancement of tumor necrosis factor alpha antitumor immunotherapeutic properties by targeted delivery to aminopeptidase N (CD13).Nat Biotechnol, 2008, 18(11):1185-1190.
[38] Dondossola E, Gasparri AM, Colombo B, et al.Chromogranin A restricts drug penetration and limits the ability of NGR-TNF to enhance chemotherapeutic efficacy.Cancer Res, 2011, 71(17):5881-5890.
[39] Lorusso D, Malaguti P, Scambia G, et al.NGR-hTNF plus doxorubicin in recurrent ovarian cancer.Eur Oncol Haematol, 2012, 8(2):107-110.
[40] Lorusso D, Scambia G, Amadio G, et al.Phase II study of NGR-hTNF in combination with doxorubicin in relapsed ovarian cancer patients.Br J Cancer, 2012, 107(1):37-42.
[41] Meng J, Yan Z, Wu J, et al.High-yield expression, purification and characterization of tumor-targeted IFN-alpha2a.Cytotherapy, 2007,9(1):60-68.
[42] Li JC, Wang J, Ren BX, et al.The distribution and scintigraphy of 99Tcm labeled NGR-interferon-alpha2a in tumor bearing mice.Chin J Nucl Med, 2011, 31(1):14-18.(in Chinese)李江城, 汪静, 任炳秀, 等.99Tcm-NGR-IFN-α2a在荷瘤小鼠体内分布及SPECT/CT显像.中华核医学杂志, 2011, 31(1):14-18.
[43] Meng J, Yan Z, Wu Y, et al.Preclinical safety evaluation of IFN α2a-NGR.Regul Toxicol Pharm, 2008, 50:294-302.
[44] Sui WJ, Liu YL, Lei XY, et al.Effects of IFN α2a-NGR combined with 5-fluorouracil on the sensitivity of A549 cell line.Lett Biotechnol, 2011, 22(3):317-320.(in Chinese)隋文君, 刘永兰, 雷小英, 等.肿瘤血管导向性干扰素 IFN α2a-NGR与5-氟尿嘧啶联合应用对A549细胞增殖的影响.生物技术通讯, 2011, 22(3):317-320.
[45] Zheng YB, Shang BY, Li Y, et al.An NGR-integrated and enediyne-energized apoprotein shows CD13/APN-targeting antitumor activity.Biomed Pharmacother, 2013, 67(2):164-171.
[46] He J, Yang L, Li YJ, et al.Preparation of liposome ultrasonic contrast agent with ligand peptide K237.Chin J Med Imaging Technol, 2011,27(1):3-7.(in Chinese)何洁, 杨莉, 李颖嘉, 等.以短肽 K237为配体的靶向脂质体超声造影剂构建方法.中国医学影像技, 2011, 27(1):3-7.
[47] Lee JH, Engler JA, Collawn JF, et al.Receptor mediated uptake of peptides that bind the human transferrin receptor.Eur J Biochem,2001, 268(7):2004-2012.
[48] Yang L, Horibe T, Kohno M, et al.Targeting interleukin-4 receptor α with hybrid peptide for effective cancer therapy.Mol Cancer Ther,2012, 11(1):235-243.
[49] Wehr C, Müller F, Schüler J, et al.Anti-tumor activity of a B-cell receptor-targeted peptide in a novel disseminated lymphoma xenograft model.Int J Cancer, 2012, 131(2):E10-E20.
[50] Quinn TP, Karasseva NG.Erb-2 receptor targeting peptide: US,7585509.2009-09-08.
[51] Kawamoto M, Horibe T, Kohno M, et al.HER2-targeted hybrid peptide that blocks HER2 tyrosine kinase disintegrates cancer cell membrane and inhibits tumor growth in vivo.Mol Cancer Ther, 2013,12(4):384-393.
[52] Tai W, Shukla RS, Qin B, et al.Development of a peptide-drug conjugate for prostate cancer therapy.Mol Pharm, 2011, 8(3):901-912.
[53] Demeule M, Régina A, Ché C, et al.Identification and design of peptides as a new drug delivery system for the brain.J Pharmacol Exp Ther, 2008, 324(3):1064-1072.
[54] Yan H, Wang J, Yi P, et al.Imaging brain tumor by dendrimer-based optical/paramagnetic nanoprobe across the blood-brain barrier.Chem Commun (Camb), 2011, 47(28):8130-8132.
[55] Régina A, Demeule M, Ché C, et al.Antitumour activity of ANG1005,a conjugate between paclitaxel and the new brain delivery vector Angiopep-2.Br J Pharmacol, 2008, 155(2):185-197.
[56] Dal Pozzo A, Esposito E, Ni M, et al.Conjugates of a novel 7-substituted camptothecin with rgd-peptides as α(v)β3 integrin ligands: an approach to tumor-targeted therapy.Bioconjugate Chem,2010, 21(11):1956-1967.
[57] Zheng YB, Xu XD, Huang YH, et al.Synthesis of yunnanmycin-RGD(OCH3)2 conjugate compound and its anti-invasive activity against cancer cells.Chin J Antibiot, 2009, 34(2):83-86.(in Chinese)郑艳波, 许先栋, 黄云虹, 等.云南霉素-RGD 二甲酯偶联物的合成及其抗肿瘤细胞侵袭活性.中国抗生素杂志, 2009, 34(2):83-86.
[58] Arap W, Pasqualini R, Ruoslahti E.Cancer treatment by targeted drug delivery to tumor vasculature in a mouse model.Science, 1998, 279(5349):377-380.
[59] Li B, Zheng YB, Li DD, et al.Preparation and evaluation of a CD13/APN-targeting and hydrolase-resistant conjugate that comprises pingyangmycin and NGR motif-integrated apoprotein.J Pharm Sci,2014, 103 (4):1204-1213.
[60] Renigunta A, Krasteva G, König P, et al.DNA transfer into human lung cells is improved with Tat-RGD peptide by caveoli-mediated endocytosis.Bioconjug Chem, 2006, 17(2):327-334.
[61] Liu K, Wang X, Fan W, et al.Degradable polyethylenimine derivate coupled to a bifunctional peptide R13 as a new gene-delivery vector.Int J Nanomedicine, 2012, 7:1149-1162.
[62] Myrberg H, Zhang L, Mäe M, et al.Design of a tumor-homing cell-penetrating peptide.Bioconjug Chem, 2008, 19(1):70-75.
[63] Eriste E, Kurrikoff K, Suhorutšenko J, et al.Peptide-based glioma-targeted drug delivery vector gHoPe2.Bioconjugate Chem,2013, 24(3):305-313.
[64] Svensen N, Walton JG, Bradley M.Peptides for cell-selective drug delivery.Trends Pharmacol Sci, 2012, 33(4):186-192.
[65] Teesalu T, Sugahara KN, Kotamraju VR, et al.C-end rule peptides mediate neuropilin-1-dependent cell, vascular, and tissue penetration.Proc Natl Acad Sci U S A, 2009, 106(38):16157-16162.
[66] Sugahara KN, Teesalu T, Karmali PP, et al.Tissue-penetrating delivery of compounds and nanoparticles into tumors.Cancer Cell,2009, 16(6):510-520.
[67] Sugahara KN, Teesalu T, Karmali PP, et al.Coadministration of a tumor-penetrating peptide enhances the efficacy of cancer drugs.Science, 2010, 328(5981):1031-1035.
[68] Alberici L, Roth L, Sugahara KN, et al.De novo design of a tumor-penetrating peptide.Cancer Res, 2013, 73(2):804-812.
[69] Vlieghe P, Lisowski V, Martinez J, et al.Synthetic therapeutic peptides:science and market.Drug Discov Today, 2010, 15(1-2):40-56.
[70] Magliani W, Conti S, Cunha RL, et al.Antibodies as crypts of antiinfective and antitumor peptides.Curr Med Chem, 2009, 16(18):2305-2323.

