人CaMKKβ蛋白的原核表达、纯化及活性测定
刘亚晋,谭初兵,时丽丽,潘晓菲,徐为人
人CaMKKβ蛋白的原核表达、纯化及活性测定
刘亚晋,谭初兵,时丽丽,潘晓菲,徐为人
300070 天津医科大学基础医学院(刘亚晋、潘晓菲);300193 天津药物研究院天津新药设计与发现重点实验室(谭初兵、时丽丽、徐为人)
对原核体系表达的 CaMKKβ 蛋白体外活性进行探索,为针对 CaMKKβ、AMPK 药物研发提供科研基础。
克隆人 CaMKKβ 基因,建立原核表达载体 pET28a-CaMKKβ,将其转化入Rosetta(DE3) 感受态细胞内,在 16 ℃、0.02 mmol/L IPTG 条件下诱导重组表达 CaMKKβ 蛋白,Ni-NTA 纯化6His-CaMKKβ 蛋白,并利用 Glo™ Max Assay 方法检测其活性。
通过基因测序表明 pET28a-CaMKKβ 质粒构建成功;重组人 CaMKKβ 蛋白可溶性表达量较高,Ni-NTA 纯化 6His-CaMKKβ 蛋白纯度可达 80% 以上,活性检测结果表明,大肠杆菌体系内表达的人 CaMKKβ 蛋白在 CaM/Ca2+存在与否情况下,酶活基本一致。
成功构建原核表达载体 pET28a-CaMKKβ,实现重组人 CaMKKβ 在原核体系内可溶性表达,活性测定表明原核体系内表达的 CaMKKβ 自主酶活性较强,受 CaM/Ca2+影响较小。
钙-钙调素依赖性蛋白激酶; 腺苷酸活化蛋白激酶; 色谱法,亲和; CaM/Ca2+
钙调蛋白(calmodulin,CaM)作为一种广泛存在的第二信使,受 Ca2+浓度的调节,参与细胞内众多信号通路的调控:cAMP 合成与分解的腺苷酸环化酶和磷酸二酯酶酶活调控、CaMKs/CaM(Ca2+/calmodulin-dependent protein kinase,CaMKs)信号级联的调控等[1-2]。CaMKs 还包括 CaMKI、CaMKII、CaMKIV等[3],CaMKK(Ca2+/calmodulin- dependent protein kinase kinase,CaMKKs)是 CaMKs 家族中的主要成员,有CaMKKα 和CaMKKβ 两种亚型,可通过磷酸化激活 CaMKI、CaMKIV、PKB、SAD-B 等[4-6]。CaMKKα 活性仅受 CaM/Ca2+信号的调控,而 CaMKKβ 除受 CaM/Ca2+信号调控外,还具有自主活性,后者可通过磷酸化 Thr/Ser 位点激活下游底物腺苷酸活化蛋白激酶(AMPK)等[7-8]。
CaMKKβ 在体内广泛分布,尤其在神经系统[9-10]、睾丸、脾脏、肝脏、肺等组织器官内,可参与多种生理活性的调控,如神经系统、肿瘤、能量代谢[11]、外围髓系粒细胞发育调控[12]等,是功能最广泛的 CaMKs 之一。CaMKKs 的信号级联反应对神经元进程中的磷酸化起重要作用,这些进程包括学习和记忆形成[13-14]、神经分化和迁移[9-10]、轴突生长和突触发生[15-16]等。在中枢神经系统内,CaMKKβ 广泛分布于海马区、嗅球、齿状回、杏仁核、下丘脑、小脑[17],因此,CaMKKβ 在海马记忆、小脑发育、下丘脑激素分泌及能量摄入-消耗调控中发挥着重要的作用。研究证明,在下丘脑神经元内 CaMKKβ 与 AMPK、Ca2+/CaM 形成复合物,发挥着调控能量动态平衡的重要作用;基因敲除 CaMKKβ 后,AMPK 活性降低,同时 NPY(neuropeptide Y)和 AgRP(agouti-related protein)基因表达下调,虽然可避免小鼠形成由饮食诱导的肥胖、高血糖和胰岛素抵抗等[18-19],但同正常喂养的野生小鼠相比,CaMKKβ 基因缺失的小鼠含有较多脂肪组织,且生长缓慢。此外,在肝脏、肌肉、脂肪等组织器官内,CaMKKβ 均可通过调整 AMPK 活性在能量平衡中发挥重要功能。在原代肝细胞内,CaMKKβ 可通过改变胞内葡萄糖-脂肪的能源利用模式,提升整个机体的葡萄糖能量平衡[20]。在前脂肪细胞内敲除 CaMKKβ 基因,促进了前脂肪细胞到脂肪细胞的分化[21]。CaMKKβ 在外周组织营养过剩的调节中发挥关键作用,因此被认为是治疗 2 型糖尿病药物开发的潜在靶点。另外有研究表明,CaMKKβ 与雄激素受体调控的前列腺肿瘤密切相关,其抑制剂 STO-609 在前列腺肿瘤的抑制方面也表现出较好的作用[22-24]。
本文旨在原核体系内有效表达人 CaMKKβ 蛋白,通过研究 CaMKKβ 功能与活性,为建立 CaMKKβ 及 AMPK 药物筛选模型及相关药物研发提供基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒TOP10 感受态细胞购自天根生化科技(北京)有限公司;Rosetta(DE3) 菌株和 pET28a 质粒由本实验室保存;pOTB7-CaMKKβ 质粒购自广州复能基因有限公司。
1.1.2 试剂 限制性核酸内切酶I、I,primer STARHSDNA 聚合酶、T4DNA 连接酶均购自大连宝生物公司;5000 bp DNA 分子量标准购自北京天为时代科技有限公司;PCR 纯化试剂盒、DNA 凝胶回收试剂盒、BCA 蛋白浓度测定试剂盒购自北京原平皓生物技术有限公司;质粒小量抽提试剂盒购自天根生化科技(北京)有限公司;大肠杆菌培养基蛋白胨、酵母提取物和琼脂粉购自美国 Oxoid 公司;琼脂购自美国 Difco 公司;IPTG 购自德国 Merck 公司;卡那霉素、氯霉素、咪唑、重组人钙调蛋白购自美国Amresco 公司;Glo™ Max Assay 试剂盒购自美国 Promega 公司;ATP、DTT 购自美国 Sigma 公司;AMPK 肽由北京恒宇视野生物科技有限公司合成;其他均为国产或进口分析纯。
1.2 方法
1.2.1 PCR 扩增人 CaMKKβ 基因 根据 GenBank公布的人 CaMKKβ 基因(No. NM_006549.3)核酸序列,用 Omega 软件设计引物,CaMKKβ 上游引物:5' GGAATTCCATATGGACTGTGTGCAGCT GAATCA 3',CaMKKβ 下游引物:5' CCGCTCGAG TCACTTCACCAGGATCACGGTT 3',以 pOTB7- CaMKKβ 质粒为模板进行基因扩增,PCR 反应程序为:98 ℃预变性 3 min;98 ℃变性 10 s,56 ℃退火 30 s,72℃延伸2 min,30 个循环;72 ℃延伸 10 min;4 ℃保存备用。
1.2.2 构建 pET28a-CaMKKβ 表达载体 以I 和I 双酶切处理经琼脂糖凝胶回收的 CaMKKβ PCR 扩增产物,与经I 和I 双酶切处理的 pET28a 载体片段连接,转化至感受态TOP10 细胞内,涂布至含有卡那霉素(50 μg/ml)的 LB 固体培养基上,挑取阳性单克隆进行菌落 PCR 及I/I 双酶切鉴定,经 DNA 测序确证无误的克隆命名为 pET28a- CaMKKβ。
1.2.3 确定CaMKKβ 蛋白表达诱导条件
⑴IPTG 浓度确定:分别将表达载体 pET28a、pET28a-CaMKKβ 转化至Rosetta(DE3)感受态细胞内,挑取单克隆至含有 25 μg/ml 卡那霉素和 17 μg/ml 氯霉素的 LB 液体培养基中培养;将活化好的菌体接种于新的 LB(含 25 μg/ml 卡那霉素和 17 μg/ml 氯霉素)培养基中,37 ℃,220 r/min 振摇 3 h;待菌液600至 0.6,加入 IPTG(IPTG 浓度设置为 0、0.02、0.1、0.5、1.0 mmol/L),培养条件为 16 ℃,220 r/min 振摇过夜,进行蛋白表达诱导;离心收集菌体,制备样品,进行 10% SDS-PAGE 电泳检测重组蛋白表达情况。
⑵温度确定:将活化好的含有质粒 pET28a、pET28a-CaMKKβ 的Rosetta(DE3) 菌体接种于含有 25 μg/ml 卡那霉素和 17 μg/ml 氯霉素的 LB 培养基中,37 ℃,220 r/min 振摇 3 h;待菌液600至 0.6,加入 IPTG 至 0.02 mmol/L,温度设置为:16、20、25、30、37 ℃,220 r/min 振摇过夜,进行蛋白表达诱导;离心收集菌体,制备样品,进行 10% SDS-PAGE 电泳检测重组蛋白表达情况。
1.2.4 Ni-NTA 亲和层析纯化重组人 CaMKKβ 蛋白 按上述确定好的条件进行 CaMKKβ 蛋白表达诱导,表达条件为:IPTG 终浓度为 0.02 mmol/L,16 ℃,220 r/min 振摇过夜;收集菌体;用缓冲液25 mmol/L Tris-HCl,pH 7.5,250 mmol/L NaCl,20 mmol/L 咪唑,1 mmol/L 苯甲基磺酰氟重悬菌体,冰上静置 30 min,于 4 ℃进行高压匀浆破碎菌体;裂解液中添加 Triton X-100 至终浓度 0.03%,4 ℃、10 000 ×离心 60 min,上清经 0.45 μm 滤膜过滤,使用自动蛋白纯化仪 AKTA 进行 Ni-NTA 亲和层析;目的蛋白经 20 ~ 250 mmol/L 咪唑线性梯度洗脱,SDS-PAGE 凝胶电泳检测;蛋白样本经 4 ℃透析,超滤浓缩并测定浓度,于–80 ℃保存。
1.2.5 BCA 法测定蛋白浓度 根据 BCA 蛋白浓度定量试剂盒使用说明进行操作,测定纯化的 CaMKKβ 蛋白浓度。
1.2.6 测定重组人 CaMKKβ 蛋白酶活 将重组人 CaMKKβ 蛋白溶液用新鲜的透析缓冲液分别稀释至 1、0.5、0.25、0.1、0.05 mg/ml,冰上放置;在白色 384 孔板中待测孔内加入备好的 CaMKKβ 蛋白液10 μl,反应液 10 μl(50 mmol/L HEPES pH 7.5,300 mmol/L NaCl,1 mmol/L DTT,10 mmol/L MgCl2,400 μmol/L ATP,10% 丙三醇,500 μmol/L AMPK 肽,序列为:GEFLRTSCGSP),Ca2+/CaM组另加入 1 mmol/L CaCl2和 0.2 μmol/L 钙调蛋白,共 20 μl,充分混匀,30 ℃孵育 30 min;加入 ADP-Glo™ 激酶检测试剂 20 μl,30 ℃孵育 30 min;加入 ADP-Glo™ Max 检测试剂 40 μl,酶标仪动态检测 1 h。
2 结果
2.1 人 CaMKKβ 基因片段的扩增
以 pOTB7-CaMKKβ 质粒为模板,扩增人 CaMKKβ 基因片段,PCR 产物经 1%琼脂糖凝胶电泳检测。结果表明,在 1000 ~ 2000 bp 之间有一特异性明亮条带,大小与预期值 1767 bp 相符,见图 1。

bp M 1 500030002000 1000750500
Figure 1 PCR product of human CaMKKβ gene
2.2 表达载体 pET28a-CaMKKβ 的构建
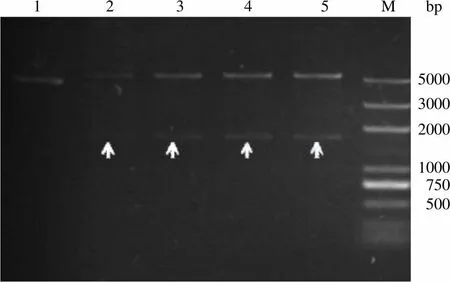
对提取的 pET28a 载体及回收的 CaMKKβ PCR 产物进行I 和I 双酶切,切胶回收酶切后的载体片段及基因片段,经 T4DNA 连接酶进行连接,转化入TOP10 感受态细胞内,挑取阳性克隆子进行菌落 PCR 验证(图 2),未转化的TOP10 菌株未见明显扩增条带,菌株 2 ~ 6 号均扩增出与预期大小一致的基因条带;提取质粒进行I/I 双酶切验证,结果见图 3,空载体 pET28a 并未见有目的条带被切下,而阳性克隆子的质粒 2 ~ 5 号均酶切下与预期大小一致的基因条带;同时,经 DNA 测序结果可知,插入基因片段及阅读框完全正确,此载体命名为 pET28a-CaMKKβ。

1 2 3 4 5 6 Mbp 2000 1000 750500 100
Figure 2 Colony PCR validation of pET28a-CaMKKβ vector construction
1 2 3 4 5 Mbp 500030002000 1000 750500
M:蛋白分子量标准;1:pET28a 空载体;2 ~ 5:pET28a-CaMKKβ 转化TOP10 阳性克隆子
M: DNA marker; 1: Product of pET28a plasmid digested withI/I; 2 - 5: Product of pET28a-CaMKKβ plasmid digested withI/I
注:箭头指示为双酶切下的CaMKKβ 基因片段
Note:The arrows indicate gene fragment digested withI/I
图 3I/I 双酶切验证 pET28a-CaMKKβ 载体
Figure 3 pET28a-CaMKKβ digested withI/I
2.3 重组人 CaMKKβ 蛋白表达条件确定
如图 4 所示,经 16 ℃、220 r/min 过夜培养,CaMKKβ 蛋白在不同浓度 IPTG 诱导后均有表达,IPTG 浓度为 0.02 mmol/L 时蛋白表达量已达到平台期,且主要为可溶性表达,蛋白大小为 65.5 kD,随着 IPTG 浓度升高,重组蛋白表达量并未见明显升高,确定 IPTG最佳诱导浓度均为0.02 mmol/L。CaMKKβ 酶可磷酸化下游底物AMPK,使得AMPK 活性大幅提升(数据未列出),表明此蛋白重组表达成功。

kD M 1 2 3 4 5 6 7 8 9 170130957255433426 CaMKKβ
Figure 4 Determination of IPTG concentration for inducing recombinant CaMKKβ expression
2.4 重组人 CaMKKβ 蛋白纯化
将 pET28a-CaMKKβ 质粒转化至Rosetta(DE3) 内,表达条件为:16 ℃、220 r/min、0.02 mmol/L IPTG,过夜诱导表达,重组人 CaMKKβ 蛋白大部分以可溶形式存在。经 Ni-NTA 柱亲和层析纯化,得到纯度 80% 以上的目的蛋白(Quantity one 软件测定),见图 5。
2.5 重组人 CaMKKβ 蛋白活性测定
通过 BCA 法测定重组人 CaMKKβ 蛋白浓度,将蛋白浓度调整到 1 mg/ml,使用Glo™ Max Assay 法测定蛋白活性。结果显示,在不加 Ca2+/CaM 反应体系里,CaMKKβ 活性为浓度依赖性升高;在含有 Ca2+/CaM 活性体系内,CaMKKβ 活性也是浓度依赖性升高,但加入 Ca2+/CaM 后对 CaMKKβ 活性并无提升作用,与未加入 Ca2+/CaM 组相比,其活性略低(图 6),但无统计学意义,与文献[25]中报道的大肠杆菌表达 CaMKKβ 的酶活受 Ca2+/CaM 影响较小的结果一致。
3 讨论
CaMKKβ 的 cDNA 片段分析结果显示,约90% 物种的 CaMKKβ 的编码氨基酸序列相似度较高,仅仅在 3' 端非编码区域存在异质性[26]。CaMKKβ 与其他 CaMKs 有着类似结构组成:激酶催化结构域(kinase domain,KD)、C 端自主抑制结构域(auto-inhibitory domain,AID)、包含在 AID 中的钙调素结合结构域(calmodulin-binding domain,CBD)[7]。其参与级联反应的过程为:细胞内 CaM 与 Ca2+结合后构象发生改变,可结合靶点蛋白 CaMKs[9];CaMKs 与 Ca2+/CaM 结合后构象也随之发生改变,释放激酶的自主抑制结构域;随之,CaMKKβ 磷酸化 CaM I(Thr-200)和 CaM IV(Thr-177),可显著提高后者的活性,调控相应的信号通路。另外,AMPKα 也是 CaMKKβ 的主要作用底物,在 LKB1 缺乏的细胞内,AMPK 的磷酸化及酶活的提升主要依赖 CaMKKβ 完成[27]。

kD M 1 2 3 4 5 6 7 8 9 10 11 17013095 725543 34
Figure 5 Ni-NTA affinity chromatography purification of recombinant CaMKKβ
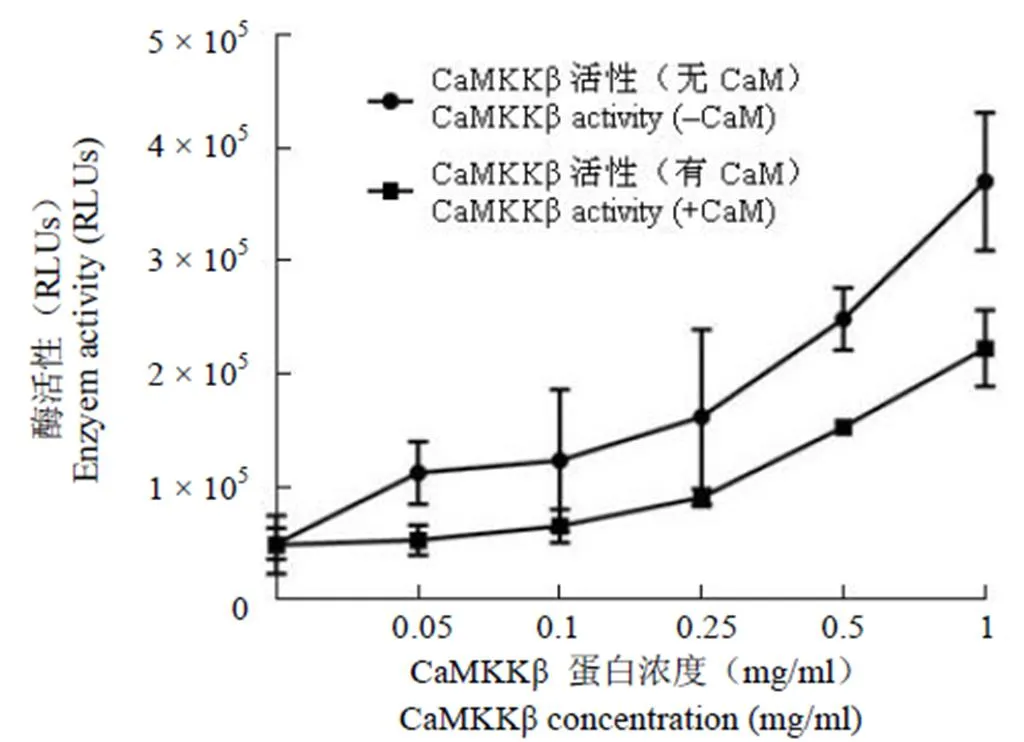
图6 Glo™ Max Assay 法测定重组人CaMKKβ 活性
Figure 6 Recombinant CaMKKβ activity determination by Glo™ Max Assay method
目前,调控 CaMKKβ 酶活性的详细机制并不清楚,CaMKKα 活性受 CaM/Ca2+严格控制,而 CaMKKβ 在缺乏 CaM/Ca2+下表现出一定的自主活性,可占总活性的 60% ~ 70%[25]。通过截短突变(位于 N 端催化区域的 129-151 aa 被切掉)实验,证明 AID 区是 CaMKKβ 酶活调控的一个最主要的调控因素。同时,通过质谱检测小鼠、大鼠、人不同种属间的 CaMKKβ,结果发现 Ser-129、Ser-133、Ser-137 三个磷酸化位点是相当保守存在的,此三位点被 CDK5/GSK3 磷酸化后其自主活性明显降低。三位点未突变的 CaMKKβ 酶活表现出了明显的自主活性,但在 CaM/Ca2+依赖的酶活中并没有明显不同,显然,磷酸化 Ser-129、Ser-133、Ser-137 三个位点能提高 CaMKKβ 蛋白稳定性[25]。而针对底物 CaMKI、CaMKII、CaMKIV,CaMKKβ 在 CaM/Ca2+不存在时即可将其磷酸化;对于底物 AMPK,AMPK、CaMKKβ 两者必须均在活化状态下才能将前者磷酸化,此有助于解释相同的变构激活剂负责两种酶级联反应的难题。同时,从哺乳动物细胞内纯化的 CaMKKβ 蛋白组成型磷酸化,所以其活性的调控更依赖 CaM/Ca2+,而从原核表达体系内纯化的 CaMKKβ 在上述三个位点并未被磷酸化,所以其自主活性较高,活性的调控对 CaM/Ca2+依赖性较低。本实验构建原核表达载体 pET28a-CaMKKβ,将其转化入BL(DE3) 内,IPTG 诱导后经 Ni-NTA 亲和层析纯化得到纯度达 80% 以上的重组人 CaMKKβ 蛋白,经 Glo™ Max Assay 检测,结果发现 CaMKKβ 重组蛋白在 CaM/Ca2+存在与否的条件下,酶活基本一致,此结果也验证了在大肠杆菌系统内重组表达的人 CaMKKβ 自主酶活性较强,受 CaM/Ca2+影响较小,为后期的人 CaMKKβ 蛋白结构、活性研究及针对此靶点的药物筛选模型建立和药物发现提供了理论基础。
[1] Berridge MJ. The versatility and complexity of calcium signalling. Novartis Found Symp, 2001, 239:52-64.
[2] Chin D, Means AR. Calmodulin: a prototypical calcium sensor. Trends Cell Biol, 2000, 10(8):322-328.
[3] Fujisawa H. Regulation of the activities of multifunctional Ca2+/calmodulin-dependent protein kinases. J Biochem, 2001, 129(2): 193-199.
[4] Hook SS, Means AR. Ca(2+)/CaM-dependent kinases: from activation to function. Annu Rev Pharmacol Toxicol, 2001, 41:471-505.
[5] Fujimoto T, Yurimoto S, Hatano N, et al. Activation of SAD kinase by Ca2+/calmodulin-dependent protein kinase kinase. Biochemistry, 2008, 47(13):4151-4159.
[6] Anderson KA, Means RL, Huang QH, et al. Components of a calmodulin-dependent protein kinase cascade. Molecular cloning, functional characterization and cellular localization of Ca2+/ calmodulin-dependent protein kinase kinase beta. J Biol Chem, 1998, 273(48):31880-31889.
[7] Hawley SA, Pan DA, Mustard KJ, et al. Calmodulin-dependent protein kinase kinase-beta is an alternative upstream kinase for AMP-activated protein kinase. Cell Metab, 2005, 2(1):9-19.
[8] Woods A, Dickerson K, Heath R, et al. Ca2+/calmodulin-dependent protein kinase kinase-beta acts upstream of AMP-activated protein kinase in mammalian cells. Cell Metab, 2005, 2(1):21-33.
[9] Cao W, Sohail M, Liu G, et al. Differential effects of PKA-controlled CaMKK2 variants on neuronal differentiation. RNA Biol, 2011, 8(6):1061-1072.
[10] Kokubo M, Nishio M, Ribar TJ, et al. BDNF-mediated cerebellar granule cell development is impaired in mice null for CaMKK2 or CaMKIV. J Neurosci, 2009, 29(28):8901-8913.
[11] Anderson KA, Ribar TJ, Lin F, et al. Hypothalamic CaMKK2 contributes to the regulation of energy balance. Cell Metab, 2008, 7(5):377-388.
[12] Teng EC, Racioppi L, Means AR. A cell-intrinsic role for CaMKK2 in granulocyte lineage commitment and differentiation. J Leukoc Biol, 2011, 90(5):897-909.
[13] Peters M, Mizuno K, Ris L, et al. Loss of Ca2+/calmodulin kinase kinase beta affects the formation of some, but not all, types of hippocampus-dependent long-term memory. J Neurosci, 2003, 23(30):9752-9760.
[14] Mizuno K, Antunes-Martins A, Ris L, et al. Calcium/calmodulin kinase kinase beta has a male-specific role in memory formation. Neuroscience, 2007, 145(2):393-402.
[15] Michaelsen K, Lohmann C. Calcium dynamics at developing synapses: mechanisms and functions. Eur J Neurosci, 2010, 32(2):218-223.
[16] Wayman GA, Lee YS, Tokumitsu H, et al. Calmodulin-kinases: modulators of neuronal development and plasticity. Neuron, 2008, 59(6):914-931.
[17] Rina-Susilowati, Jusuf AA, Sakagami H, et al. Distribution of Ca(2+)/calmodulin-dependent protein kinase I beta 2 in the central nervous system of the rat. Brain Res, 2001, 911(1):1-11.
[18] Andersson U, Filipsson K, Abbott CR, et al. AMP-activated protein kinase plays a role in the control of food intake. J Biol Chem, 2004, 279(13):12005-12008.
[19] Kalra SP, Kalra PS. NPY and cohorts in regulating appetite, obesity and metabolic syndrome: beneficial effects of gene therapy. Neuropeptides, 2004, 38(4):201-211.
[20] Anderson KA, Lin F, Ribar TJ, et al. Deletion of CaMKK2 from the liver lowers blood glucose and improves whole-body glucose tolerance in the mouse. Mol Endocrinol, 2012, 26(2):281-291.
[21] Lin F, Ribar TJ, Means AR. The Ca2+/calmodulin-dependent protein kinase kinase, CaMKK2, inhibits preadipocyte differentiation. Endocrinology, 2011, 152(10):3668-3679.
[22] Karacosta LG, Foster BA, Azabdaftari G, et al. A regulatory feedback loop between Ca2+/calmodulin-dependent protein kinase kinase 2 (CaMKK2) and the androgen receptor in prostate cancer progression.J Biol Chem, 2012, 287(29):24832-24843.
[23] Shima T, Mizokami A, Miyagi T, et al. Down-regulation of calcium/calmodulin-dependent protein kinase kinase 2 by androgen deprivation induces castration-resistant prostate cancer. Prostate, 2012, 72(16):1789-1801.
[24] Racioppi L. CaMKK2: a novel target for shaping the androgen- regulated tumor ecosystem. Trends Mol Med, 2013, 19(2):83-88.
[25] Green MF, Scott JW, Steel R, et al. Ca2+/Calmodulin-dependent protein kinase kinase beta is regulated by multisite phosphorylation.J Biol Chem, 2011, 286(32):28066-28079.
[26] Vinet J, Carra S, Blom JM, et al. Cloning of mouse Ca2+/calmodulin-dependent protein kinase kinase beta (CaMKKbeta) and characterization of CaMKKbeta and CaMKKalpha distribution in the adult mouse brain. Brain Res Mol Brain Res, 2003, 111(1-2): 216-221.
[27] Hurley RL, Anderson KA, Franzone JM, et al. The Ca2+/calmodulin- dependent protein kinase kinases are AMP-activated protein kinase kinases. J Biol Chem, 2005, 280(32):29060-29066.
Prokaryotic expression, purification and activity assay of human CaMKKβ protein
LIU Ya-jin, TAN Chu-bing, SHI Li-li, PAN Xiao-fei, XU Wei-ren
To facilitate drug discovery based on CaMKKβ and AMPK, cloning, expression and purification of human CaMKKβ were performed in.
Human CaMKKβ gene was cloned to bacterial expression vector pET28a-CaMKKβ, and then transformed intoRosetta(DE3) cells. The recombinant CaMKKβ protein was induced with 0.02 mmol/L IPTG at 16 ℃, 6His-CaMKKβ was purified through Ni-NTA chromatography and activity was assessed by Glo™ Max Assay.
The expression vector pET28a-CaMKKβ was confirmed via DNA sequencing. After optimization of induction condition, recombinant human CaMKKβ protein was expressed at high level mainly as soluble form. Single step Ni-NTA chromatography generated high purity product (greater than 80%). Activity analysis revealed that CaM/Ca2+did not modulate the enzymatic activity of recominant CaMKKβ.
pET28a-CaMKKβ vector is constructed successfully. Recombinant human CaMKKβ is purificatied by Ni-NTA, and strong autonomous activity of recombinant CaMKKβ expressed in prokaryotic system is not affected by CaM/Ca2+.
Ca(2+)-calmodulin dependent protein kinase; AMP-activated protein kinase; Chromatogrophy affinity; CaM/Ca2+
SHI Li-li, Email: shill@tjipr.com
10.3969/cmba.j.issn.1673-713X.2014.03.009
天津市应用基础及前沿技术研究计划(13JCQNJC13700、12JCYBJC18800)
时丽丽,Email:shill@tjipr.com
2013-11-19
Author Affiliations: Basic Medical College, Tianjin Medical University, Tianjin 300070, China (LIU Ya-jin, PAN Xiao-fei), Tianjin Key Laboratory of Molecular Design and Drug Discovery, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China (TAN Chu-bing, SHI Li-li, XU Wei-ren)

