三氧化二砷联合顺铂抑制C6胶质瘤细胞增殖的实验研究
王志刚,钟根深,马鹏举,岳双柱,周国胜
三氧化二砷联合顺铂抑制C6胶质瘤细胞增殖的实验研究
王志刚,钟根深,马鹏举,岳双柱,周国胜
453100 河南卫辉,新乡医学院第一附属医院神经外科/河南省神经病学研究所
探讨三氧化二砷(As2O3)联合顺铂(CDDP)抑制 C6 神经胶质瘤细胞增殖情况及其分子机制。
体外实验采用 MTT 法检测对 C6 神经胶质瘤细胞的抑制率,流式细胞法检测 C6 胶质瘤细胞的凋亡及周期,Western blot 检测 caspase-3、PTEN、PI3K、Akt 蛋白表达水平;体内实验采用免疫组化法检测 caspase-3、IκB-α 调控因子的表达,并观察大鼠的生存情况。
As2O3、CDDP 及联合应用分别作用于 C6 神经胶质瘤细胞 24 h 后的细胞增殖最大抑制率分别为 34.37%、31.73% 和 76.40%,其相应药物浓度分别为 12.5、10.0、(12.5 + 10.0)μmol/L;两者联用后对 C6 胶质瘤细胞作用 24 h 后的凋亡率分别为从单独用药时的(4.60 ± 1.12)%、(14.59 ± 0.79)% 提高到(36.13 ± 1.55)%;采用 PI 单染检测的细胞周期也进一步证明了联合用药增加了 C6 细胞的周期抑制作用。Caspase-3、PTEN 蛋白在联合组 C6 胶质瘤细胞中表达显著上调,而 PI3K、Akt 蛋白在联合组C6 胶质瘤细胞中表达下调;免疫组化法检测结果显示,caspase-3 调控因子在联合组用药的 C6 胶质瘤细胞中的表达上调,而IκB-α 调控因子表达下调;但体内实验表明,在 18 d 观察期内各组大鼠的生存期无明显差异(= 0.2531)。
As2O3联合 CDDP 通过上调 caspase-3 和 PTEN,下调 PI3K、Akt 及IκB-α 抑制胶质瘤细胞体内外的生长。
顺铂; 神经胶质瘤; 细胞凋亡; 三氧化二砷; 药物疗法,联合
恶性肿瘤的术后化疗可以阻滞肿瘤细胞的生长、侵袭及扩散,进而提高患者的生活质量,延长患者的生存期。近年来研究发现,As2O3不仅对急性早幼粒细胞白血病有很好疗效,而且对实体肿瘤,如胃癌、肺癌、肝癌、前列腺癌、乳腺癌等也显现了一定的抗肿瘤效果[1-5]。另有研究表明,As2O3与顺铂(CDDP)联合应用,在不增加 CDDP 对肾毒性作用情况下,还能提高 CDDP 的化疗效果[6-7]。同时亦有研究发现,As2O3脂质体可使更多的 As2O3通过血脑屏障,诱导脑胶质瘤细胞凋亡,并具有明显的剂量-时间依赖性关系[8]。CDDP 在胶质瘤的化疗中应用较为广泛,本研究欲通过 As2O3与 CDDP 联合应用的体外、体内实验,来探讨临床 As2O3与 CDDP 联合应用治疗脑胶质瘤的可行性及其可能的机制;并探讨中西药结合治疗脑胶质瘤的优势。
1 材料与方法
1.1 材料
1.1.1 细胞株及实验动物 C6 胶质瘤细胞由河南省神经病学研究所提供,常规传代培养;雌性SD 大鼠,体重 150 ~ 200 g,购自河南省实验动物中心,许可证编号:SCXK(京)2013-0001,普通环境饲养。
1.1.2 主要药物和试剂 As2O3、CDDP(20061001)为云南生物谷灯盏花药业有限公司产品;caspase-3、IκB-α、PTEN、PI3K、Akt 单克隆抗体及 ABC 免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司;BCA 蛋白定量试剂盒及定影液、显影液购自武汉博士德生物工程有限公司。
1.1.3 主要仪器 Multiskan MK3 酶标仪由美国 Thermo Electron 公司生产;BM-IX 生物组织包埋机由孝感医疗器械公司生产;HI122 型烤片机由德国 Leica Microsystem Nussloch 公司生产;江湾I 型脑立体定向仪为第二军医大学生产。
1.2 方法
1.2.1 细胞培养及处理 C6 胶质瘤细胞常规传代培养,取对数生长期的细胞以 5 × 103个/孔接种于 96 孔板中。分为 4 组:①对照组;②As2O3组;③CDDP 组;④As2O3+ CDDP 组。CDDP 浓度分别为 10、5、2.5 μmol/L,As2O3浓度为 12.5、6.25 和 3.125 μmol/L。对照组加入无药物的 RPMI 1640 细胞培养液,终体积为 0.2 ml/孔。培养 24 h 后,加入 MTT(5 mg/ml)溶液 20 μl,于细胞培养箱中继续培养 4 h。取出后,将培养液丢弃,加入150 μl 二甲基亚砜,置水平摇床振荡 20 min 后,酶标仪上测定570。两药联合指数(CI)根据文献[9-10]计算,公式为:


1.2.2 流式细胞术测定细胞周期和凋亡 取对数生长期细胞,以 5 × 104个/孔接种于 6 孔板中,分为 4 组:①对照组;②As2O3组(12.5 μmol/L);③CDDP 组(10 μmol/L);④As2O3+ CDDP[(12.5 + 10)μmol/L]联用组。加入药物后,继续培养 24 h,收集各组细胞于 1.5 ml EP 管中,其中检测细胞周期的细胞采用预冷的 70%乙醇固定,4 ℃碘化丙啶(PI)染色 30 min,过滤,以流式细胞仪及 ModFit 分析软件检测细胞周期;检测细胞凋亡的细胞不固定,采用 Annexin V/PI 双染试剂盒,按试剂盒说明书检测细胞凋亡。每组实验重复 3 次。
1.2.3 Western blot 实验 按照 BCA 蛋白定量试剂盒说明书进行蛋白提取。caspase-3、PTEN、PI3K 和 Akt 抗体使用时按照 1:500 进行稀释,同时 4 ℃孵育过夜。蛋白电泳(10% 的SDS- PAGE)进行相关抗体的电泳实验。
1.2.4 SD 大鼠 C6 胶质瘤模型的建立 10% 水合氯醛(3.0 ml/kg)麻醉 SD 大鼠,固定在脑立体定向仪上,选取对数生长期的 C6 胶质瘤细胞制备成单细胞悬液,接种至大鼠右侧尾状核区(前囟中点旁 3 mm,冠状缝前 1 mm),接种细胞数为 5 × 105个,共 15 μl,速度为 1 μl/min,注射完毕留针 5 min,缓慢拔针,骨蜡封闭骨孔,消毒,缝合皮肤[11-12]。
1.2.5 动物分组治疗及病理检测 大鼠经 Gd-DTPA 强化 MRI 扫描检测成瘤后,随机分4 组,每组 10 只大鼠:①对照组,0.9%氯化钠溶液腹腔注射 1 mg/kg;②As2O3组,腹腔注射 As2O31 mg/kg;③CDDP 组,腹腔注射 CDDP1 mg/kg;④As2O3+ CDDP 组,腹腔注射 CDDP 和 As2O3均为 1 mg/kg。连续给药 7 d 后,每组处死 4 只大鼠,取出脑组织,切取含瘤灶部位 4 mm 厚组织,福尔马林溶液固定,石蜡包埋,4 μm 厚连续切片,用于免疫组织化学检测。
1.2.6 免疫组织化学分析 采用 ABC 免疫组织化学法,按照检测试剂盒说明书进行。200 倍视野下,随机选取 10 个视野(high power field,hpf),计数 800 ~ 1000 个细胞中阳性细胞百分比(%/hpf)。IκB-α 阳性表达定位于细胞核或细胞质,呈棕黄色或棕褐色颗粒沉着;caspase-3 阳性表达定位于细胞质,呈棕黄色颗粒沉着。
1.2.7 生存分析 根据剩余大鼠死亡情况,采用 Graphpad prism 5 软件作 Kaplan-Meier 生存分析。
1.3 统计学处理
2 结果
2.1 对 C6 胶质瘤细胞的抑制作用
各实验组(不包括对照组)24 h 后对 C6 胶质瘤细胞均有抑制作用,且具有较明显的剂量-时效关系,抑制作用随着药物浓度的提高及作用时间的延长而增强;同时从实验结果中能够观测到各浓度 As2O3与 CDDP 联合用药对 C6 胶质瘤细胞的生长抑制明显增强(< 0.05)。如图 1 所示,不同浓度联合用药时,CI 值分别为 0.59、0.67 和 0.95,说明 CDDP 和 As2O3在高、中浓度联合用药组对脑胶质瘤细胞的生长抑制率增加更为明显,具有较好的协同作用。

抑制率(%)Inhibition rate (%)1009080706050403020100 CDDP 10 5 2.5 As2O3 12.5 6.25 3.125 药物浓度(μmol/L)Drug concentration (μmol/L)
Figure 1 Inhibition efficiency of CDDP, As2O3and their combination on proliferation of glioma cell line C6 (*< 0.05)
2.2 对 C6 胶质瘤细胞凋亡及周期的影响
通过 MTT 法我们测得CDDP、As2O3及联合用药对 C6 胶质瘤细胞抑制率最高的药物浓度。根据 CI 值,选择 CDDP 10 μmol/L 和 As2O312.5 μmol/L 作为细胞凋亡和周期时的药物浓度,作用于 C6 胶质瘤细胞并测得其凋亡及周期曲线(图2 和图3)。

图 2 不同药物对C6 胶质瘤细胞凋亡的影响
Figure 2 Effect of CDDP, As2O3and their combinationon apoptosis of glioma cell line C6

图 3 不同药物对C6 胶质瘤细胞周期的影响
Figure 3 Effect of CDDP, As2O3and their combinationon cell cycle distribution of glioma cell line C6
由图 2 可知,采用 PI/Annexin V 双染的方法检测细胞凋亡,结果表明As2O3、CDDP 及联合应用对 C6 胶质瘤细胞作用 24 h 后的凋亡率分别从单独用药时的(4.60 ± 1.12)%、(14.59 ± 0.79)% 增加到(36.13 ± 1.55)%。联用组能够明显促进 C6 胶质瘤细胞凋亡,与 CDDP 或者 As2O3单独用药相比,差异具有统计学意义(< 0.05)。在采用 PI 单染的情况下检测细胞周期,由图 3 可知,联用组能够显著阻止 C6 胶质瘤细胞周期停在 G2/S 期,导致亚 G1 峰的细胞碎片大量增加,说明联合后能够增强细胞增殖抑制的效果。
2.3 Western blot 检测蛋白表达
Western blot 结果显示,caspase-3、PTEN 蛋白在联用组表达明显上调,而 PI3K、Akt 蛋白在联用组则表达量明显下降(图 4)。
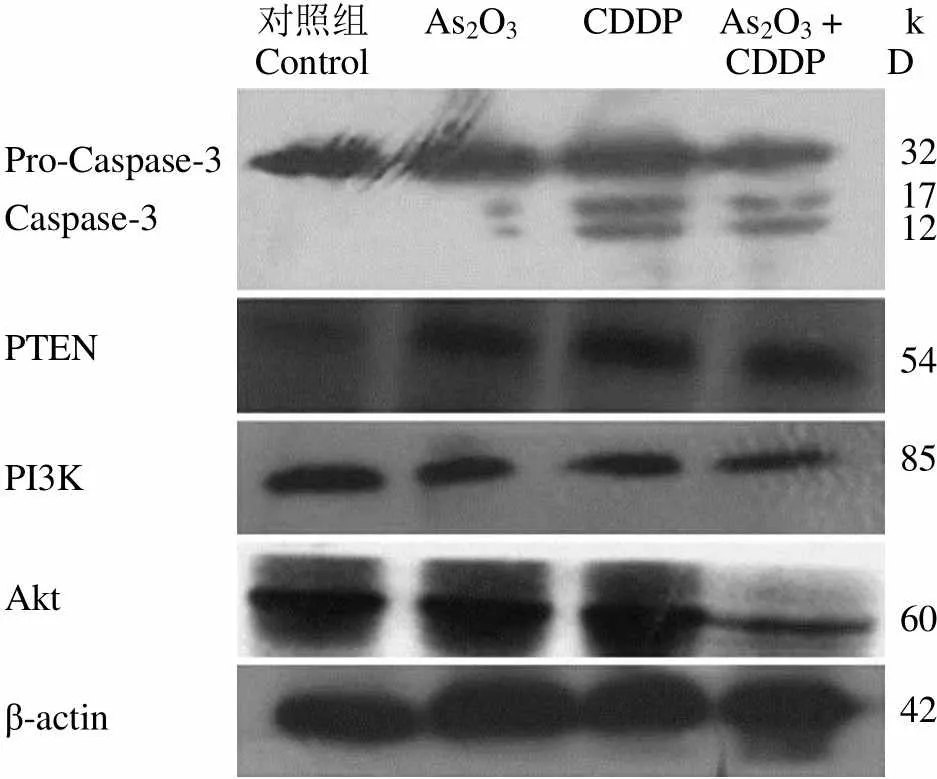
对照组 As2O3 CDDP As2O3 +Control CDDPkD Pro-Caspase-3Caspase-3 PTEN PI3K Akt β-actin 321712 54 85 60 42
Figure 4 Effect of CDDP, As2O3and their combination on caspase-3, PTEN, PI3K, Akt protein expression in glioma cell line C6
2.4 免疫组化检测 IκB-α 在 C6 胶质瘤细胞中的表达
采用免疫组织化学法检测了 IκB-α 的表达,以肿瘤细胞中见淡黄色至棕黄色者为阳性细胞,显微镜下观察结果表明,IκB-α 在联用组 C6 胶质瘤细胞中表达明显减少,且表达的 C6 胶质瘤细胞数目较少(图 5)。
2.5 大鼠生活状态观察和生存分析
对照组大部分大鼠精神较差,饮食量明显较其他各实验组差,活动迟缓,行走旋转,皮肤毛发紊乱潮湿,接种侧眼球突出并见球结膜充血水肿,整体大鼠呈消瘦状态,随着时间的推移,在第 18 天时对照组大鼠全部死亡。As2O3及CDDP 组的大鼠生活情况较对照组稍好。联合组用药后的大鼠精神较用药前明显改善,饮食量尚可,四肢活动无明显旋转运动,皮肤毛发清洁干燥,接种肿瘤侧的眼球无明显突出,未见球结膜充血水肿,体型正常,随着时间的推移,大鼠死亡数量较对照组少。肿瘤接种后 1 周内各组大鼠死亡数目相差不多,但随着用药后,各组之间大鼠死亡数有一定差异,在第 18 天时对照组全部死亡,CDDP 组和 As2O3组各还有 2 只存活,联合组有 4 只存活。但在 18 d 的观察期内,虽然各组大鼠死亡数目不同,但 Kaplan-Meier 分析结果显示,各组之间差异并不显著(= 0.2531)(图 6)。


IκB-α 阳性率(%/hpf)IκB-α positive ratio (%/hpf)0.04 0.03 0.02 0.01 0 对照组 As2O3 CDDP As2O3 +Control CDDPE
A:对照组;B:As2O3组;C:CDDP 组;D:As2O3+ CDDP 组;E:各组药物作用胶质瘤细胞后 IκB-α 表达的定量分析;**与对照组相比,< 0.05;△△与 As2O3和 CDDP 组相比,< 0.05。
A: Control group; B: As2O3group;C: CDDP group; D: As2O3+ CDDP group; E: Quantitative analysis of various drugson IκB-α expression in glioma cell;**Compared with control group,< 0.05;△△Compared with As2O3and CDDP group,< 0.05.
图 5 免疫组化分析 CDDP 和As2O3对胶质瘤细胞 IκB-α 的表达影响(200 ×)
Figure 5 Effects ofCDDP and As2O3on IκB-α expression in glioma cell as determined byimmunohistochemical staining (200 ×)

存活率(%)Percent survival (%)100 80 60 40 20 0 5 10 15 20 时间(d)Time (d)
Figure 6 Various experimental group of rats survival curve
3 讨论
胶质瘤是颅内常见的恶性肿瘤,早期诊断困难,治愈率低,具有高复发率、高致残率、高死亡率的特点[13]。目前主要通过手术治疗,并联合化疗、放疗减少肿瘤的复发及转移,但其治愈率仍较低,为此需寻找新的治疗药物。As2O3是中药砒霜的主要成分,近些年来用于临床治疗急性早幼粒细胞白血病,同时对实体瘤也有明显疗效,但 As2O3的毒副作用较大,治疗剂量和致死剂量很接近[14-15]。CDDP是临床上常用的抗癌药物,其疗效呈剂量相关性,但大剂量可引起不可逆性肾功能损害及严重的胃肠道反应,从而限制了临床应用[16-17]。任何抗癌药单独应用,疗效总是有限的,过分提高药物剂量或药物浓度,都会明显地增加毒性,因此临床上主张联合用药,以便提高疗效、降低毒性、延缓或防止耐药。
肿瘤的发生与正常细胞内抑癌基因和癌基因的平衡失调有关。Caspase-3 是一种重要的细胞促凋亡因子,在正常细胞内通过级联反应而使细胞凋亡,也可通过水解蛋白质导致细胞解体,最终形成凋亡小体[4]。在肿瘤治疗过程中,caspase-3 蛋白表达上调,或者说 pro-caspase-3 切割的增加,常意味着细胞凋亡的增加。PTEN 基因是胶质瘤的抑癌基因,PTEN 蛋白的正常表达可抑制肿瘤的发生。在人脑胶质瘤中,PTEN 基因常发生突变或缺失,导致肿瘤的发生[18]。相关研究表明,As2O3与CDDP 联合应用在体内外实验中可抑制肿瘤细胞的生长发育。主要机制为阻滞细胞周期[19]、诱导肿瘤细胞的凋亡[20-21]及诱导肿瘤细胞的分化。本研究结果显示,As2O3与 CDDP 联合应用可上调 C6 胶质瘤细胞中 caspase-3 和 PTEN 蛋白的表达,进而诱导 C6 胶质瘤细胞的凋亡。PI3K-Akt 信号通路可调节肿瘤细胞的增殖和存活[22]。其主要机制是 PI3K 可使 Akt 活化,而活化的 Akt 通过磷酸化作用激活或抑制其下游靶蛋白 caspase3、IκB-α、p27 等,进而调节细胞的增殖、分化、凋亡等。PI3K-Akt 信号通路的活性可以被类脂磷酸酶 PTEN 负调节[23]。本实验结果显示,对照组中 PI3K/Akt 蛋白表达显著,而联合用药组 PI3K/Akt 蛋白表达减低,说明 As2O3与 CDDP 联合应用可破坏 PI3K-Akt 信号通路导致肿瘤细胞凋亡的增加,也可能是 As2O3与 CDDP 联合应用上调 PTEN 蛋白的表达而起到负性调节 PI3K-Akt 信号通路的作用,进而抑制肿瘤细胞的增殖。IκB-α 与肿瘤细胞的生长、增殖和浸润、转移的关系密切,还能调控肿瘤细胞的凋亡和免疫活性[24-25]。本实验结果显示,As2O3与 CDDP 联合应用可使 IκB-α 的表达减少。IκB-α 表达下调,常意味着 NF-κB p65 亚基的释放,导致 p65 蛋白转移入核,诱导相关抗凋亡基因的表达,从而对抗 As2O3与 CDDP 诱导的凋亡作用。因此,在 As2O3与 CDDP 诱导细胞凋亡过程中,IκB-α 在其中所扮演的作用可能是多方面的,其作用机制可能还需进一步研究。
本实验可得出以下结论:①As2O3、CDDP 对脑胶质瘤细胞有一定抑制作用,尤其是两者联合使用效果更加明显;②As2O3与 CDDP 联合使用可通过提高 caspase3、PTEN 的表达,抑制或降低 IκB-α、PI3K/Akt 的表达来调节脑胶质瘤细胞凋亡及周期阻滞。因此,As2O3与 CDDP 联合使用可影响脑胶质瘤细胞的增殖。
虽然本实验体外结果证明了 As2O3与 CDDP 联合可促进脑胶质瘤细胞的凋亡,抑制其生长,阻滞其细胞周期的循环,体内实验表明可提高大鼠的存活率,但本实验因观察时间有限(仅 18 d),实验结果经统计分析表明两者联用并不能有效地延长大鼠的生存期,这也指导我们在临床化疗过程中,如遇到胶质瘤晚期患者,在可预测的生存期有限的情况下,如何合理选择两药联用,需要仔细斟酌,以便获得最佳的临床疗效,让患者最大获益。
[1] Doyle D. Notoriety to respectability: a short history of arsenic prior to present day use in haematology. Br J Haematology, 2009, 145(3):309- 317.
[2] Akao Y, Mizoguchi H, Kojima S, et al. Arsenic induces apoptosis in B-cell leukaemic cell lines in vitro: activation of caspases and down-regulation of Bcl-2 protein. Br J Haematol, 1998, 102(4):1055- 1060.
[3] Zheng CY, Lam SK, Li YY, et al. Combination of arsenic trioxide and chemotherapy in small cell lung cancer. Lung Cancer, 2013, 82(2): 222-230.
[4] Li X, Ding X, A drian TE. Arsenic trioxide induces apoptosis in pancreatic cancer cells via changes in cell cycle, caspase activation, and GADD expression. Pancreas, 2003, 27(2):174-179.
[5] Chou WC, Chen HY, Yu SL, et al. Arsenic suppresses gene expression in promyelocytic leukemia cells partly through Sp1 oxidation. Blood, 2005, 106(1):304-310.
[6] Cao HX, Xia W, Shen Q, et al. Mechanism of differentiation and apoptosis in acute promyelocytic leukemia cells by JWA involving in retinoic acid, 12-o-tetradecanoylphorbol-13-acetate and arsenic trioxide. Chin Sci Bull, 2001, 46(23):1979-1983. (in Chinese)
曹海霞, 夏薇, 沈群, 等. JWA参与维甲酸、佛波酯和三氧化二砷诱导急性早幼粒细胞性白血病细胞分化和凋亡的可能机制. 科学通报, 2001, 46(23):1979-1983.
[7] Huang JY, Cai H, Huang JL. Effect of arsenic trioxide used in combination with cisplatin in inhibiting mice transplantation tumor and its effect on kidney. Jiangsu J Traditional Chin Med, 2006, 27(6): 57-59. (in Chinese)
黄建元, 蔡横, 黄金玲. 三氧化二砷联合顺铂对小鼠移植性肿瘤的抑制作用及其对肾功能的影响. 江苏中医药, 2006, 27(6):57-59.
[8] Zhang X, Zhao SG, Ren Y, et al. Preparation and effects of arsenic trioxide liposome on glioma cell apoptosis in rats. Chin J Minimally Invasive Neurosurg, 2007, 12(6):269-272. (in Chinese)
张旭, 赵世光, 任颖, 等. 三氧化二砷脂质体的制备及其对鼠脑胶质瘤的影响. 中国微侵袭神经外科杂志, 2007, 12(6):269-272.
[9] Romanelli S, Perego P, Pratesi G, et al. In vitro and in vivo interaction between cisplatin and topotecan in ovarian carcinoma systems. Cancer Chemother Pharmacol, 1998, 41(5):385-390.
[10] Mai Z, Blackbrun GL, Zhou JR. Soy phytochemicals synergistically enhance the preventive effect of tamoxifen on the growth of estrogen-dependent human breast carcinoma in mice. Carcinogenesis, 2007, 28(6):1217-1223.
[11] Morreale VM, Herman BH, Der-Minassian V, et al. A brain-tumor model utilizing stereotacic implantation of a permanent cannula.J Neurosurg, 1993, 78(6):959-965.
[12] De Ridder L. Behaviour of gliomas in vitro vs histopathological grading. Int J Devl Neuroscience, 1999, 17(5-6):541-546.
[13] Hadziahmetovic M, Shirai K, Chakravarti A. Recent advancements in multimodality treatment of gliomas. Future Oncol, 201l, 7(10):1169- 1183.
[14] Kanzawa T, Kondo Y, Ito H, et al. Induction of autophagic cell death in malignant glioma cells by arsenic trioxide. Cancer Res, 2003, 63(9):2103-2108.
[15] Carré M, Carles G, André N, et al. Involvement of microtubules and mitochondria in the antagonism of arsenic trioxide on paclitaxel- induced apoptosis. Biochem Pharmacol, 2002, 63(10):1831-1842.
[16] Lane DP. Cancer. A death in the life of p53. Nature, 1993, 362(6423): 786-787.
[17] Hall AG, Tillby MJ. Mechanisms of action, and modes of resistance to, alkylating agents used in the treatment of hematological malignancies. Blood Rev, 1992, 6(3):163-173.
[18] Weng LP, Smith WM, Dahia PL, et al. PTEN suppresses breast cancer cell growth by phosphatase activity dependent G1 arrest followed by cell death. Cancer Res, 1999, 59(22):5808-5814.
[19] Seol JG, Park WH, Kim ES, et al. Effect of arsenic trioxide on cell cycle arrest in head and neck cancer cell line PCI-1. Biochem Biophys Res Commun, 1999, 265(2):400-404.
[20] Desagher S, Martinou JC. Mitochondria as the central control point of apoptosis. Trends Cell Biol, 2000, 10(9):369-377.
[21] Green DR, Kroemer G. The pathophysiology of mitochondrial cell death. Science, 2004, 305(5684):626-629.
[22] Vivanco I, Sawyers CL. The phosphatidylinositol 3-Kinase AKT pathway in human cancer. Nat Rev Cancer, 2002, 2(7):489-501.
[23] Jimenez C, Jones DR, Rodríguez-Viciana P, et a1. Identification and characterization of a new oncogene derived from the regulatory subunit of phosphoinositide 3-kinase. EMBO J, 1998, 17(3):743-753.
[24] Tang WZ, Xia YJ. Expression of nuclear factor-kappaBP65 in human brain glioma and human brain metastatic carcinoma and its significance. J First Mil Med Univ, 2004, 24(1):75-78. (in Chinese)
唐万忠, 夏玉军. 人脑胶质瘤与人脑转移瘤中NF-κBP65的表达及意义. 第一军医大学学报, 2004, 24(1):75-78.
[25] Nagai S, Washiyama K, Kurimoto M, et al. Aberrant nuclear factor-kappaB activity and its participation in the growth of human malignant astrocytoma. J Neurosurg, 2002, 96(5):909-917.
Effect of arsenic trioxide in combination with cisplatin on the proliferation of glioma C6 cells
WANG Zhi-gang, ZHONG Gen-shen, MA Peng-ju, YUE Shuang-zhu, ZHOU Guo-sheng
To investigate the effects of arsenic trioxide in combination with cisplatin on the proliferation of glioma cells C6.
In theexperiment, the proliferation inhibition of glioma cell line C6 was assessed by MTT assay, and the cell cycle distribution and apoptosis ratio of the cells were detected by flow cytometry. The expression levels of caspase-3, PTEN, PI3K and Akt were examined by Western blot. In theexperiment, the expression levels of caspase-3 and IκB-α were measured by immunohistochemical methods, and the rats’ life span was observed.
At the dosage of 12.5 µmol/L of As2O3and 10.0 µmol/L of CDDP, the proliferation inhibitory ratios of As2O3, CDDP and co-treatment group on glioma cell line C6 after 24 hours were 34.37%, 31.73% and 76.40%, respectively. Correspondingly, the apoptosis ratios after 24 hours were (4.60 ± 1.12)%, (14.59 ± 0.79)% and (36.13 ± 1.55)% respectively. Apoptosis induction was also proved by FACS using PI-stained method. The expression levels of caspase-3 and PTEN were up-regulated, while the expression levels of PI3K and Akt were down-regulated in the co-treatment group. Forexperiment, the expression of caspase-3 was up-regulated and IκB-α was down-regulated in the co-treatment group. However, the rats’ survival rate in different treatment groups was similar in the limited observation time (= 0.2531).
As2O3combined with CDDP has potent inhibitory action on glioma cells proliferation through up-regulating caspase-3 and PTEN and down-regulating PI3K, Akt and IκB-α expression levels.
Cisplatin; Glioma cell; Apoptosis; Arsenic trioxide; Drug therapy, combination
ZHOU Guo-sheng, Email: 745772199@qq.com; ZHONG Gen-shen, Email: genshenzhong@163.com
10.3969/cmba.j.issn.1673-713X.2014.03.002
国家自然科学基金青年科学基金(81201765);河南省卫生科技创新型人才工程(4160)
周国胜,Email:745772199@qq.com;钟根深,Email:genshenzhong@163.com
2013-12-31
Author Affiliation: The Institute of Neurology, Department of Neurosurgery, The First Affiliated Hospital of Xinxiang Medical University, 453100 Henan Weihui, China

