不同菌株发酵培养过程中脂肪酶活性的检测与分析
樊国庆,雒晓芳,王 瑾,鄢圣林,闫瑞祥
(1.西北民族大学 生命科学与工程学院,甘肃 兰州730030;2.西北民族大学 实验中心,甘肃 兰州730030;)
脂肪酶也就是三酰基甘油酰基水解酶,其作用底物通常为油脂,通过催化作用可以使其产生脂肪酸、甘油和甘油单酯或二酯[1],这个反应通常是在油—水的界面上完成的[2],如果底物能够分散均匀或者是具有很好的水溶性,那么反应就油[7].在环境治理方面,可以用脂肪酶的微生物修复功能将含有脂肪酶以及其他成分的复合制剂来作用于海中的石油,就能够很好地治理海洋中的石油污染[8].脂肪酶的应用广泛,在食品工业中,可以用于食品原料的生产[3],也可以用来作为食品中的添加物质[4],还可以增强食品的品质[5].在医药领域中可以作为诊断工具以及治疗药物[6],在能源领域,可以用来生产生物柴在有机合成中的应用,利用脂肪酶的催化反应特性,即立体选择性和区域选择性,反应条件温和、无污染等等,可以用来合成一些功能强大的化合物[9].随着社会的发展以及科技的进步,脂肪酶的应用前景必定会越来越好.
本试验通过分离选择得到了不同种的、高效的降解石油的菌株,并且对脂肪酶的形成条件和脂肪酶活性的测定方法进行优化,这样有利于工业生产脂肪的研究以及脂肪酶酶活测定方法的多样性探讨.
1 材料和方法
1.1 实验材料
1.1.1 产脂肪酶菌株的筛选
微生物菌株B1,B3,M3,M4,D1,D4,L5,A6均由西北民族大学微生物实验室从甘肃陇东油田石油污染土样中分离纯化得到,其分子生物学鉴定还有待于进一步进行.
1.1.2 培养基
营养肉汤培养基,发酵培养基,分离培养基均按照《微生物学实验》[10]配制.
1.1.3 试剂
1)橄榄油(Oliver oil),化学纯,由江苏省南通市黔台商贸有限公司提供.
2)聚乙烯醇(PVA-124),购自中国医药集团(上海)化学试剂有限公司.
3)其他试剂全部都是分析纯,分别为 (NH4)2·SO4,K2HPO4,KCl,MgSO4·7H2O,FeSO4·7H2O,NaOH,无水乙醇,NaNO3.
1.2 实验方法
1.2.1 菌种的富集
1)富集培养:挑取一环新鲜斜面种子,接于营养肉汤培养基中,置于恒温培养箱,37℃培养48h.
2)分离:从混浊的营养肉汤培养液中取样,用无菌水作10倍稀释倍数进行稀释 .取稀释倍数分别为10、100、1 000的稀释液,各取0.2mL均涂布于分离平板,颠倒培养基,于恒温培养箱中控制温度37℃作用60h.如果细菌的菌落边缘能够出现黄色的透明圈,说明这种菌株能很好地降解油脂成分.
3)发酵培养:通过分离得到高效降油菌后,移取富集培养液1mL转移到发酵培养基中,于转速为120r/min的摇床中恒温37℃,培养48h.
1.2.2 脂肪酶活性的测定方法 橄榄油乳化法1.2.3 脂肪酶酶活的计算公式

其中:V1实验组所滴加碱的体积(mL);V2空白组所用碱的体积(mL);50~1mL 0.05mol/L NaOH的微克分子数;n稀释的倍数;t反应所消耗的时间(min).
2 结果与分析
2.1 温度对脂肪酶酶活的影响

图1 温度对脂肪酶酶活的影响
如图1所示,菌种B1,M4,D1,L5,A6的脂肪酶酶活都在40℃时最大,也就是说40℃是其酶促反应的最适宜温度.在40℃之前,随着温度的升高脂肪酶酶活会逐渐升高,而40℃之后,温度再升高,酶活反而会降低 .因为酶是蛋白质,温度的升高大于其最适温度时,酶的空间结构会被改变而变性,导致其酶活的降低 .菌种B3,D4脂肪酶活性一直处于上升状态,菌种M3脂肪酶酶活则一直处于下降状态,这三种菌在所测温度范围内均没有出现脂肪酶活性的先上升后下降,说明在此温度范围内可能没有所测菌种的最适温度 .陈士恩等[10]关于酶促反应条件的优化研究表明,温度对酶活性的影响呈倒“U”型,即随着温度的增加,酶的活性也在增大,当温度增加到某一值时酶活性达到最大,之后温度增加会使酶活性下降,与本文试验结果一致.
2.2 反应时间对脂肪酶酶活的影响
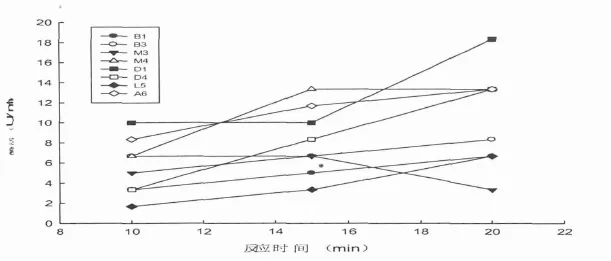
图2 反应时间对脂肪酶酶活的影响
如图2所示,菌种B1,B3,D1,D4,L5,A6在所测的反应时间范围内,脂肪酶的活性随着时间的增加而逐渐升高,说明在所测反应时间内,酶促反应一直在进行中,所产生的酸不断增加,导致滴定所消耗的NaOH也不断增加 .对于菌种M4,酶活随着反应时间的增加会先增加后不变,根据本实验所用脂肪酶酶活的计算公式(V1-V2)×50×n/t,其中体积差表明的是实验组与对照组所消耗碱量的差,n,t为定值 .时间增加而酶活不变说明了酶促反应仍然在进行中,产物的量仍然在增加 .对于菌种M3,如图所示的曲线,酶活随着时间的增加是先增加后减小的 .根据公式说明,酶活在增加到最大后,酶促反应进行完全,底物的量也不再增加,而时间的继续增加导致计算所得的酶活会变小.
2.3 不同缓冲液量对脂肪酶活性的影响

如图3所示,对于菌种M3,M4,D1,D4,L5,A6,在所测的缓冲液量的范围内,缓冲液的量对于酶活的影响并不大 .由于脂肪酶对环境pH的变化比较敏感[11],加入一定量的缓冲液能够稳定酶的活力,在实验所测的4~6mL的范围内,缓冲液的体积可以适应于体系酸碱的改变,不会出现所要加入的氢氧化钠体积的变化 .菌种B1,B3缓冲液的量对其酶活的影响较大,B1在缓冲液为4mL时,缓冲液的量能应对反应体系的pH变化 .如果继续添加缓冲液,过量的缓冲液会使滴加的碱液增加,最终会导致测定结果偏大,这是由于缓冲液改变了反应体系的酸碱度所引起的误差.
2.4 不同橄榄油浓度对脂肪酶活性的影响
如图4所示,对于菌种D1,D4,L5,A6,脂肪酶的活力随着底物橄榄油浓度的增大会先增大后不变,这是因为在酶浓度不变的情况下,底物浓度对酶活的影响呈现先增加后不变的趋势 .在底物浓度很低时,酶活随底物浓度的增加而增加.当底物浓度升到一定值时,随着底物浓度的升高,酶活不再增加,此时无论底物浓度增加多大,酶活也不再增加,说明酶已被底物所饱和[12].对于菌株B1、M3随着底物浓度的增大,酶活会先增大后减小 .酶活的先增大说明酶还没有被底物所饱和,随着底物浓度的增大酶活会增大,当酶被底物所饱和时,继续增大底物浓度,酶活出现减小,这可能是因为过量的底物导致酶与底物—— 油脂相互作用的表面积受到影响 .由于乳化剂增加了反应体系的粘度,使反应体系的流动性变差,底物、产物和酶的扩散以及相互接触也受到一定的抑制,导致酶活的降低[13].菌种B3,M4出现了酶活随着底物浓度的增加,先减小后增大,这可能是由于在实验过程中几次振荡橄榄油乳化液不均匀使橄榄油微油粒与酶的接触表面积大小不一所导致的[14].

图4 不同浓度的橄榄油对脂肪酶酶活的影响
3 结论
1)菌株基本上都是在40℃时具有最高的酶活,说明此温度是大多数细菌酶促反应的最适温度,故40℃能作为测脂肪酶活性的最适温度.
2)所用的菌株基本上都是在20min时具有最高的酶活,说明在实验所用的范围中,反应时间越长,酶活越高、酶反应越完全,故在设定酶活测定的条件时反应时间应为20min.
3)所用菌株的最优酶活并不表现在某一固定的缓冲液的量,但是每种细菌酶活对缓冲液的量的变化趋势起伏并不大,说明缓冲液的量对于本实验中细菌酶活的影响并不大 .基于成本考虑,最优缓冲液的量应设定为3mL.
4)所用菌株基本上是在30%的乳化液浓度时有最优酶活,又考虑到微乳颗粒大小,反应系统的流动性等因素的影响,最优的乳化液浓度应设定为30%.
脂肪酶活力的检验方法很多,通过试验得到在大多数细菌中适用的较优的酶活测定的反应条件:乳化液浓度控制为30%,加入缓冲液3mL,在40℃下,反应20min.
[1]张树政 .酶制剂工业(下册)[M].北京:科学出版社,1984.655-670.
[2]邬显章 .酶的工业生产技术[M].长春:吉林大学出版社,1988.
[3]Kahraman M V,Bayramoglu G,ayaman-Apohan N K,et al,Food Chemisty,2007,104.1385.
[4]Igor Herńandez,Mertxe de Renobales,Mailo Virto,et al.Assessment of industrial lipases for flavour development in commercial Idiazabal(ewe’s raw milk)cheese[J].Enzyme and Microbial Technology,2005,36:870-879.
[5]Lamsal B P,Faubion J M.Effect of an enzyme preparation on wheat flour and dough color,mixing,and test baking[J].LWT-Food Science and Technology,2009,42:1461-1467.
[6]AI—Bahrani AZ,Ammori B J Clinical laboratory assessment of acute pancreatitis[J].clin Chim Acta,2005,362(1-2):26-48.
[7]Tan Tianwei,Lu Jike,Nie Kaili,et al.Biodiesel production with immobilized lipase:A review[J].Biotechnology Advances,2010,28(5):628-634.

