基于抗CD20单克隆抗体的2种夹心ELISA法的建立
邓承莲,董立厚,邹佳,宋海峰
1.广西医科大学,广西 南宁 530002;2.军事医学科学院 放射与辐射医学研究所,军事医学科学院药代动力学重点实验室,北京 100850
分子靶向治疗是近年来肿瘤治疗领域的研究热点,与传统化疗药物相比,这类药物具有靶向性、非细胞毒性、疗效明显等特点,主要对肿瘤细胞起调节和稳定作用[1-2]。作为治疗B细胞淋巴瘤的靶向药物,抗CD20单克隆抗体在治疗性抗体中占有重要的一席之地,因此,其药代动力学与毒代动力学研究也随之成为一大热点。
自1997年第一个抗CD20单克隆抗体利妥昔单抗(rituximab)获准上市至今,该类药物发展迅速,根据其不同的结构、人源化程度及Fc段修饰等,大致经历了三代研发[3]。已报道的针对这类药物的检测分析方法主要为酶联免疫吸附分析法(ELISA)[4-5],另外也有流式细胞法[6-7]和Gyros法[8]等。本研究中,我们选用重组抗CD20人源化单克隆抗体(rh-anti-CD20zumab)作为目标药物。该抗体是基于利妥昔单抗的结构经人源化改造而成,可通过与B细胞表面的CD20分子结合,经抗体依赖性细胞毒作用(an⁃tibody dependent cellular cytotoxicity,ADCC)和补体依赖性细胞毒作用(complement dependent cyto⁃toxicity,CDC)等途径发挥抗肿瘤作用[9-10]。针对该抗体,我们建立了2种不同的夹心ELISA法用于定量检测生物基质中rh-anti-CD20zumab的浓度,并对其方法学进行较为全面验证,试图为后续的rh-anti-CD20zumab在食蟹猴体内的药代动力学研究提供不同的分析方法。
本研究中采用不同的分析方法进行药代动力学研究,得到的结果可以相互印证,从而可提高分析方法的准确性。同时,我们对2种方法进行了比较,为类似治疗性抗体的临床前药代动力学研究提供了不同的研究路线,不同实验室可根据自身试剂的获取难易程度而选择不同的分析方法。
1 材料与方法
1.1 材料
rh-anti-CD20zumab(批号:20121101,纯度>98%,上海医药集团有限公司);山羊抗人IgG F(ab')2抗体(批号:104172,Jackson ImmunoResearch公司);驴抗人IgG Fc抗体(批号:105065,Jackson Im⁃munoResearch公司);HRP标记的猴血清吸附的山羊抗人IgG多克隆抗体(批号:A80-319P-15,Bethyl公司);小鼠IgG(批号:ab37355,Abcam公司)。
96孔酶标板(Nunc公司);微量加样器(Brand公司);洗板机(Thermo公司,型号为4MK2);酶标仪(Thermo公司,型号为MK3)。
1.2 捕获抗体为山羊抗人IgG F(ab')2抗体的夹心ELISA法
①包被:用山羊抗人IgG F(ab')2抗体包被酶标板,100 μL/孔,4℃静置过夜后用洗板液洗板3次;②封闭:以1%I-Block为封闭液,300 μL/孔封闭反应2.5 h,用洗板液洗板3次;③加样:用100%食蟹猴空白血浆将rh-anti-CD20zumab标准品梯度稀释至10 000~20 ng/mL,另用同样方法单独配制浓度为3750、1500、100 ng/mL的质控样品;用稀释液(PBS缓冲液加0.5%Tween-20和1 mol/L NaCl)对所有血浆样品进行1∶20前处理,每个前处理后的样品以100 μL/孔加入酶标板中,每个样品设2个复孔,室温孵育2.5 h,用洗板液洗板3次;④加酶标二抗:加入25 ng/mL HRP标记的猴血清吸附的山羊抗人IgG抗体,室温孵育55 min,用洗板液洗板6次;⑤显色与测定:加入TMB避光显色15 min,1 mol/L硫酸终止显色,酶标仪比色读取D450nm值。
1.3 捕获抗体为驴抗人IgG Fc抗体的夹心ELISA法
①包被:用驴抗人IgG Fc抗体包被酶标板,100 μL/孔,4℃静置过夜后用洗板液洗板3次;②封闭:以 1%I-Block为封闭液,300 μL/孔,封闭反应3 h,用洗板液洗板3次;③加样:用100%食蟹猴空白血浆将rh-anti-CD20zumab标准品梯度稀释至25 000~20 ng/mL,另用同样方法单独配制浓度为10 000、4000、110 ng/mL的质控样品;用稀释液(同上)对所有血浆样品进行1∶10前处理,每个前处理后的样品以100 μL/孔加入酶标板中,每个样品设2个复孔,室温孵育3 h,用洗板液洗板3次;④加酶标二抗:加入30 ng/mL猴血清吸附HRP标记的山羊抗人IgG抗体,室温孵育55 min,用洗板液洗板6次;⑤显色与测定:加入TMB避光显色15 min,1 mol/L硫酸终止显色,酶标仪比色读取D450nm值。
2 结果
2.1 特异性
考察结构类似物小鼠IgG对2种方法的干扰情况。按照制备标准曲线的方法制成高浓度质控样品和低浓度质控样品,并使其中含有10倍或1倍定量上限(ULOQ)浓度的小鼠IgG。捕获抗体为山羊抗人IgG F(ab')2的夹心ELISA法中,在高、低质控样品中均分别加入50 000和5000 ng/mL的小鼠IgG后,rh-anti-CD20zumab的平均分析回收率(%AR)分别为122.5%和122.1%、107.6%和107.1%。捕获抗体为驴抗人IgG Fc抗体的夹心ELISA法中,在高、低质控样品中均分别加入250 000和25 000 ng/mL的小鼠IgG后,rh-anti-CD20zumab的平均分析回收率分别为114.4%和106.9%、81.5%和81.5%。这表明在猕猴血浆中存在50 000 ng/mL(包被抗体为山羊抗人IgG F(ab')2抗体)和125 000 ng/mL(包被抗体为驴抗人IgG Fc抗体)的小鼠IgG时,均不会影响待测抗体的准确性,但后者优于前者。
2.2 标准曲线和线性范围
用100%食蟹猴血浆配制标准曲线,批间重复5次。标准曲线采用相同浓度下各批回算平均值之间的变异系数(CV)和相对误差(RE)来评价。结果见图1。2种方法的CV分别小于7.3%和11.1%,RE分别为-16.5%~13.2%和-4.4%~3.9%,均满足生物技术药物的药代动力学要求,标准曲线均具有良好的线性和重现性。2种方法的线性范围分别为40~5000和40~12 500 ng/mL,具有相同的灵敏度,但捕获抗体为山羊抗人IgG Fc抗体的夹心ELISA法的线性范围更宽。
2.3 准确度和精密度
不同实验日期进行5批样品验证,结果见表1。捕获抗体为山羊抗人IgG F(ab')2抗体的夹心ELISA法中,各级别验证样品的准确度RE为-10.3%~16.6%,板内和板间精密度CV≤16.2%;捕获抗体为驴抗人IgG Fc抗体的夹心ELISA法中,各级别验证样品的准确度RE为-14.4%~12.9%,板内和板间精密度CV≤19.4%,均符合方法学确证要求,两者相近。
2.4 稀释线性和钩状效应
考察样品稀释对样品浓度检测准确度的影响。捕获抗体为山羊抗人IgG F(ab')2抗体的夹心ELISA法中,根据实验需要分别用100%食蟹猴空白血浆配制浓度分别为250 000、25 000、6000 ng/mL的样品溶液,考察稀释率为1/1000、1/500、1/50、1/5和1/2的稀释效应;捕获抗体为驴抗人IgG Fc抗体的夹心ELISA法中,根据实验需要分别用100%食蟹猴空白血浆配制浓度分别为200 000、20 000、8000 ng/mL的样品溶液,考察稀释率为1/500、1/100、1/50、1/5、1/2的稀释效应。结果见表2。将已知浓度的rh-anti-CD20zumab标准品稀释至不同浓度,2种方法的RE分别小于18.6%和13.3%,均符合方法学确证要求,但后者优于前者。
考察2种方法是否具有钩状效应。捕获抗体为山羊抗人IgG F(ab')2抗体的夹心ELISA法中,考察3 000 000、300 000、30 000、3000、300 ng/mL浓度点,结果表明D450nm值随着样品浓度的增加而增加,在3 000 000~300 ng/mL范围内没有出现钩状效应;捕获抗体为驴抗人IgG Fc抗体的夹心ELISA法中,考察 3 000 000、300 000、30 000、6000、1200 ng/mL浓度点,结果表明D450nm值随着样品浓度的增加而增加,在3 000 000~1200 ng/mL范围内没有出现钩状效应。
3 讨论

图1 2种ELISA法测定的标准曲线(n=5)
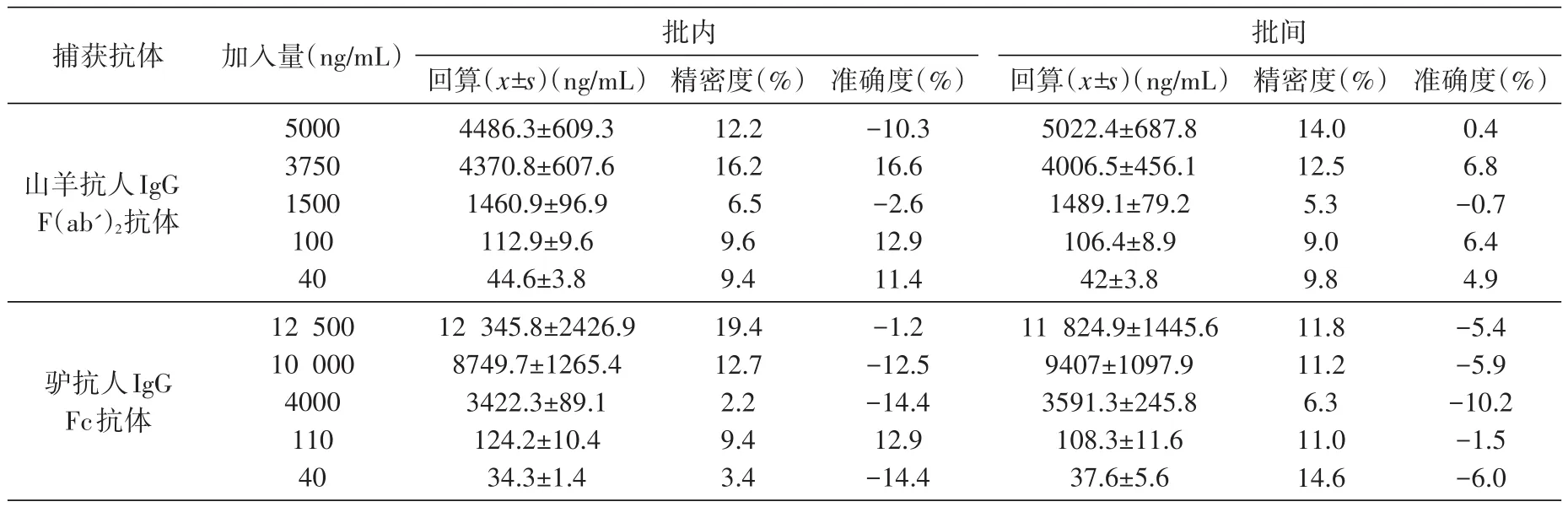
表1 2种ELISA法的精密度和准确度(n=5)
免疫学分析方法包括ELISA、放射免疫测定(RIA)和荧光免疫分析(IFA)等,其中ELISA为公认的较为快捷灵敏的方法[4]。本研究中,我们以重组抗CD20人源化单克隆抗体作为待测物,分别选用抗人IgG F(ab')2抗体和抗人IgG Fc抗体作为捕获抗体,建立了2种灵敏高效的夹心ELISA法,试图为后续rh-anti-CD20zumab在食蟹猴体内的药代动力学研究提供不同的分析方法。其中,捕获抗体为抗人IgG F(ab')2抗体的双抗体夹心ELISA法中,捕获抗体针对的是rh-anti-CD20zumab 的 F(ab')2段;捕获抗体为抗人IgG Fc抗体的双抗体夹心ELISA法中,捕获抗体针对的是rh-anti-CD20zumab的Fc段。结果表明,对于配制在全血浆基质中的药物而言,这2种分析方法的灵敏度、精密度、准确度、特异性、稀释线性等各项验证指标均符合药代动力学研究的要求。虽然两者的灵敏度、精密度和准确度相同或相近,但后者的线性范围更宽,并且稀释线性和特异性更好。整体来说,后者优于前者,2种分析方法均可用于rh-anti-CD20zumab的临床前药代动力学研究,并且也为其他类似抗体的药代动力学研究提供了2条合适的研究路线。
[1]张迪,戈伟.肿瘤分子靶向治疗进展[J].武汉大学学报(医学版),2011,32(5):705-708.
[2]韩慧珍,邹庞,郭宝良.分子靶向治疗药物的研究进展[J].中国普通外科杂志,2010,19(12):1342-1346.
[3]邓承莲,邹佳,宋海峰.抗CD20治疗性单克隆抗体的研究进[J].药学学报,2013,48(10):1515-1520.
[4]Damen C W,Schellens J H,Beijnen J H.Bioanalytical meth⁃od forthe quantification oftherapeutic monoclonalantibod⁃ies and their application in clinical pharmacokinetic studies[J].Hum Antibodies,2009,18(3):47-73.
[5]刘若瑞,陈知航,许先兴,等.重组抗CD20单克隆抗体ELISA检测新方法[J].生物技术通讯,2011,22(2):220-224.
[6]Beum P V,Kennedy A D,TaylorR P.Three new as⁃says for rituximab based on its immunological activity or anti⁃genic properties:analyses of sera and plasmas of RTX-treat⁃ed patients with chronic lymphocytic leukemia and other B cell lymphomas[J].J Immunol Methods,2004,289(1-2):97-109.
[7]董增祥,王清清,陈立慧,等.两种基于RAJI细胞的抗CD20单抗新型定量方法的比较及在药物代谢动力学中的应用[J].分析化学,2009,37(10):1457-1462.
[8]Liu X F,Wang X,Weaver R J,et al.Validation of a gyro⁃lab assay for quantification of rituximab in human serum[J].J Pharmacol Toxicol Methods,2012,65(3):107-114.
[9]Boross P,Leusen J H.Mechanisms of action of CD20 antibod⁃ies[J].Am J Cancer Res,2012,2(6):676-690.
[10]Robak T,Robak E.New anti-CD20 monoclonal antibodies for the treatment of B-cell lymphoid malignancies[J].Biodrugs,2011,25(1):13-25.

