重组人白细胞介素15融合蛋白的表达、纯化及免疫原性检测
李佳林,张存,高源,郝强,王舒宁,张伟,张英起
1.肿瘤生物学国家重点实验室;2.第四军医大学 药学系生物制药学教研室;陕西 西安 710032
白细胞介素15(interleukin-15,IL-15)是一种多功能细胞因子,是1994年Grabstein等从猿猴的肾上皮细胞中发现的,相对分子质量为(14~15)×103[1]。研究发现,IL-15在T细胞、NK细胞、NKT细胞及树突状细胞等免疫细胞的发育、功能维持方面发挥重要作用,被看作是天然免疫与获得性免疫系统之间的纽带之一[2],因此在维持自身免疫系统平衡及治疗肿瘤、微生物感染、自身免疫病等方面备受关注[3-5]。
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的累及外周关节为主的多系统炎症的自身免疫性疾病。大量文献报道,RA患者血清中IL-15水平明显增高,且过量表达的IL-15通过多种途径参与RA的发病机制[6]。首先,IL-15可以通过与多种细胞因子相互作用促进炎症的进展。研究发现,RA中高浓度的IL-15能诱导炎性因子IL-17的过度分泌。IL-15还能一方面直接活化T细胞诱导其合成肿瘤坏死因子α(TNFα),另一方面通过激活NK细胞,通过其与单核细胞的相互作用,促进TNFα的产生[7-9]。另外,IL-15还参与关节骨质的破坏。IL-15可以一方面通过激活促分裂原活化蛋白激酶(MAPK)和NF-κB等信号通路诱导单核细胞分化为破骨细胞,另一方面与其他分子相互作用促进成骨细胞的凋亡;还可通过增加基质金属蛋白酶的分泌,造成骨质损伤[6,10-11]。因此,IL-15已成为RA治疗的重要靶点。我们从主动免疫方向入手,通过融合破伤风类毒素(tetanus toxoid,TT)T辅助细胞表位(830~843,QYIKANSKFIGITE),在体外克隆表达了重组人TTIL-15融合蛋白(以下简称为rtIL-15),并通过免疫小鼠检测其免疫原性,为进一步研究IL-15融合蛋白在治疗RA中的作用打下基础。
1 材料及方法
1.1 材料
BALB/c小鼠(雌性,6~8周龄)购自第四军医大学实验动物中心;大肠杆菌M15、质粒pQE-30均由本教研室保存;限制性内切酶、T4DNA连接酶、DNA marker DL2000均为大连TaKaRa公司产品;异丙基-β-硫代半乳糖苷(IPTG)、琼脂糖、琼脂购自北京鼎国生物技术有限责任公司;重组人IL-15及小鼠抗人IL-15单克隆抗体购自R&D公司;氢氧化铝佐剂购自Brenntag公司。
1.2 pQE-30-TT-IL-15重组表达载体的构建
将GenBank中人IL-15基因序列(342 bp)上游引入BamHⅠ酶切位点和TT 830~843表位,下游引入SalⅠ酶切位点,长度共计399 bp的基因序列交由北京奥科生物技术有限公司合成,克隆入载体pQE-30,转化大肠杆菌M15感受态细胞,挑单克隆培养。经酶切鉴定及上海生工生物技术服务有限公司DNA测序证实,得到重组融合表达载体pQE-30-TT-IL-15,其中pQE-30载体N端融合6个His。
1.3 rtIL-15在大肠杆菌中的表达
将含pQE-30-TT-IL-15重组质粒的工程菌接种于10 mL含氨苄西林的LB培养液中,于37℃培养过夜,次日按1%的比例转种于10 mL含氨苄西林的LB培养液中,于37℃振荡培养至对数生长早期(D600nm约为0.6),加IPTG诱导表达,于37℃振荡培养4 h,离心收集菌体,SDS-PAGE鉴定,并用灰度扫描软件分析目的蛋白占菌体总蛋白的比例。
1.4 rtIL-15融合蛋白的纯化、复性和鉴定
1.4.1 rtIL-15融合蛋白的纯化、复性 将诱导表达的工程菌液于4℃、4000 r/min离心15 min,收集菌体沉淀,超声波裂解,4℃、12 000 r/min离心20 min,分别收集上清液和沉淀进行SDS-PAGE,分析目的蛋白的表达形式。将沉淀用包涵体洗涤液A(2 mol/L尿素,2%Triton X-100)洗涤2次,离心取沉淀,用8 mol/L尿素溶解,离心后取上清进行镍柱(Ni-NTA)亲和层析纯化,分别用10、25 mmol/L咪唑预洗脱之后,用250 mmol/L咪唑再次洗脱,收集目的蛋白进行梯度透析复性(尿素浓度依次为6、4、2、0 mol/L),最后透析至Tris缓冲液中,-20℃保存。
1.4.2 rtIL-15融合蛋白的Weatern印迹 将纯化的rtIL-15行SDS-PADE,随后将其转移到PVDF膜上,以小鼠抗IL-15单抗为一抗、HRP-兔抗小鼠IgG为二抗进行Western印迹。
1.4.3 rtIL-15融合蛋白的HPLC纯度鉴定 取10 μL纯化的蛋白样品(0.5 mg/mL)上样至Beckman HPLC系统,使用7.5 mm×300 mm G2000SW凝胶柱,在280 nm波长下监测出峰情况,通过计算峰面积得出rtIL-15蛋白的纯度。
1.5 rtIL-15疫苗的免疫原性测定
1.5.1 免疫小鼠 将18只BALB/c小鼠随机分为3组,分别为rtIL-15+氢氧化铝佐剂组(蛋白与氢氧化铝按体积比1∶1混合)、rtIL-15组和生理盐水对照组。背部皮下多点注射,每只小鼠每次免疫40 μg rtIL-15/100 μL或100 μL生理盐水(对照组),每组免疫4次,每次间隔2周。第4次免疫后10 d摘眼球采血,收集抗血清进行鉴定。
1.5.2 ELISA测定血清抗体滴度 用商品化的IL-15溶液包被96孔板(每孔100 ng/100 μL),将不同组别的小鼠血清梯度稀释后加入孔中与其结合,再加入HRP标记的二抗(博士德公司),OPD显色,测定D490nm值,每个样品均设3个复孔。
2 结果
2.1 重组表达载体的鉴定
pQE-30-TT-IL-15重组表达载体(图1)构建完成后,用BamHⅠ和SalⅠ双酶切鉴定,琼脂糖凝胶电泳结果显示在390 bp处出现酶切片段,与预期一致(图2)。测序结果也显示序列正确。
2.2 rtIL-15融合蛋白在大肠杆菌中的表达
工程菌经IPTG分别诱导2、3、4 h后进行SDSPAGE,出现一条相对分子质量约14 000的蛋白条带,与预期结果一致,说明rtIL-15在大肠杆菌中得到表达,并且诱导4 h后的表达量最高(图3)。灰度扫描分析,融合蛋白约占菌体总蛋白的20%。收集菌体进行超声波裂解,发现目的蛋白主要以不溶性包涵体的形式存在,细菌裂解液上清中(可溶性表达部分)只有少量目的蛋白(图3)。
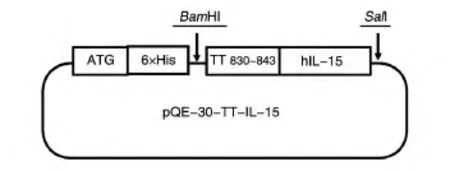
图1 pQE-30-TT-IL-15重组载体结构示意图
2.3 rtIL-15融合蛋白的纯化、复性和鉴定
用洗涤液A洗涤包涵体2次,离心取沉淀,用8 mol/L尿素溶解,离心后取上清进行镍柱纯化,收集目的蛋白洗脱峰(图4)。将所得蛋白溶液进行梯度透析复性,最后溶于Tris溶液。将纯化复性后的目的蛋白进行Western印迹,结果显示目的蛋白与抗IL-15单抗有特异性结合(图5)。经HPLC测定,目的蛋白纯度达到95%以上(图6)。
2.4 rtIL-15融合蛋白疫苗免疫原性检测
为了验证rtIL-15的免疫原性,也同时验证氢氧化铝免疫佐剂的作用,分别用rtIL-15+佐剂、rtIL-15和生理盐水免疫BALB/c小鼠,免疫4次后取小鼠血清,用ELISA检测抗体滴度,结果如图7所示。抗血清中的多抗与IL-15有较好的结合活性;rtIL-15+佐剂组和rtIL-15组产生的抗IL-15抗体效价分别为1∶100 000和1∶1000。该结果说明rtIL-15融合蛋白疫苗确实具有免疫原性,并且氢氧化铝佐剂确实具有增强免疫效果的作用。
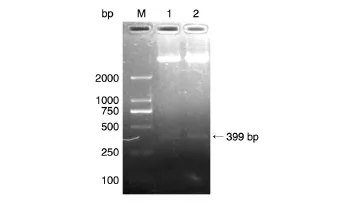
图2 重组表达质粒pQE-30-TT-IL-15的酶切鉴定
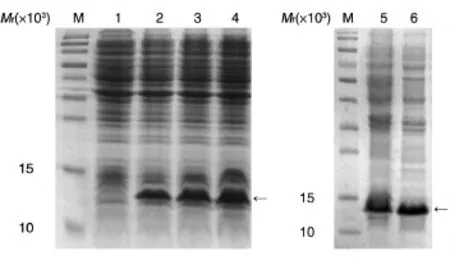
图3 重组菌的诱导表达(左)及超声波裂解(右)的SDS-PADE分析
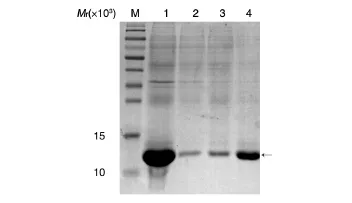
图4 目的蛋白亲和层析纯化的SDA-PADE
3 讨论

图5 纯化的目的蛋白的Western印迹
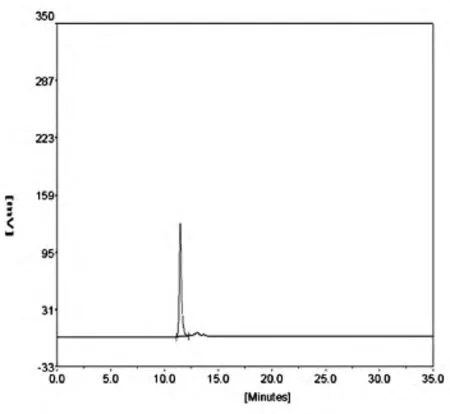
图6 纯化的目的蛋白的HPLC分析
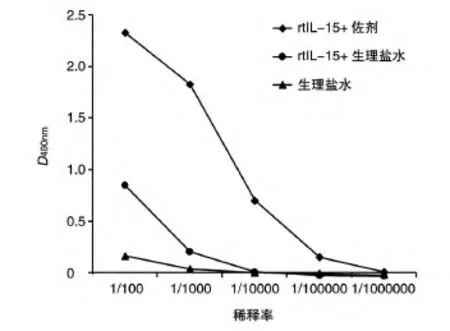
图7 ELISA检测rtIL-15的免疫原性
IL-15作为一种重要的前炎性细胞因子,具有促进炎症发展、刺激淋巴细胞滑膜细胞、促进骨质破坏等作用,与RA有密切关系,是近年来的研究热点。针对IL-15的单克隆抗体(AMG714)、IL-15受体γc亚单元的单抗及与IL-15受体特异性结合的IL-15融合蛋白(IL-15-Fcγ2a)都处于临床研究中[12-13]。但是,这些免疫治疗方法具有用药量大、病人经济负担重的缺陷。我们从激发患者自身免疫反应入手,拟发展一种具有治疗作用的IL-15疫苗,可以降低用药量,从而减轻病人身体和经济负担。但IL-15是一种自身蛋白,正常情况下机体对其存在免疫耐受。我们采取了融合外源性通用T辅助细胞表位的方法突破机体的免疫耐受,这种策略已成功地应用于TNFα、HER2、B7-H1等多种自体疫苗的研究中,并取得了不错的效果[14-16]。
我们将人IL-15基因克隆到带有His标签的原核表达载体pQE-30上,在大肠杆菌中诱导表达了重组人IL-15融合蛋白,但表达形式为包涵体沉淀,为蛋白纯化增加了难度。为了达到更好的镍柱亲和层析效果,我们尝试了不同的包涵体洗涤策略,分别在缓冲液加入不同浓度的尿素、盐酸胍、β-巯基乙醇、Triton X-100、脱氧胆酸钠进行摸索,最后发现含2 mol/L尿素、2%Triton X-100的洗涤液可以在不损失目的蛋白的情况下最大程度地去除杂蛋白。在8 mol/L尿素的强变性条件下,目的蛋白沉淀的二级结构充分打开,His标签得以完全暴露,经过一次亲和层析就能达到95%纯度的纯化效果。最后,经过缓慢的梯度透析,获得了可溶性的目的蛋白纯品。纯化后的rtIL-15融合蛋白疫苗在氢氧化铝佐剂存在的条件下免疫小鼠,诱导出高滴度的IL-15特异性抗体,说明rtIL-15融合蛋白疫苗具有很好的免疫原性。在后续研究中,我们将进一步系统检测rtIL-15疫苗在RA动物模型中的治疗效果及免疫机制,为其真正应用于临床打下基础。
[1]Grabstein K H,Eisenman J,Shanebeck K,et al.Cloning of a T cell growth factor that interacts with the beta chain of the interleukin-2 receptor[J].Science,1994,264(5161):965-968.
[2]Cui G,Hara T,Simmons S,et al.Characterization of the IL-15 niche in primary and secondary lymphoid organs in vivo[J].Proc Natl Acad Sci USA,2014,111(5):1915-1920.
[3]Maeurer M J,Trinder P,Hommel G,et al.Interleukin-7 or interleukin-15 enhances survival of Mycobacterium tuberculo⁃sis-infected mice[J].Infect Immun,2000,68(5):2962-2970.
[4]Forcina G,D'Ettorre G,Mastroianni C M,et al.Interleukin-15 modulates interferon-gamma and beta-chemokine produc⁃tion in patients with HIV infection:implications for immunebased therapy[J].Cytokine,2004,25(6):283-290.
[5]Waldmann T A.The biology of IL-15:implications for can⁃cer therapy and the treatment of autoimmune disorders[J].J Investig Dermatol Symp Proc,2013,16(1):S28-30.
[6]Park M K,Her Y M,Cho M L,et al.IL-15 promotes osteo⁃clastogenesis via the PLD pathway in rheumatoid arthritis[J].Immunol Lett,2011,139(1-2):42-51.
[7]Petrovic-Rackov L,Pejnovic N.Clinical significance of IL-18,IL-15,IL-12 and TNF-alpha measurement in rheumatoid arthritis[J].Clin Rheumatol,2006;25(4):448-452.
[8]Chao C C,Chen S J,Adamopoulos I E,et al.Anti-IL-17A therapy protects against bone erosion in experimental models of rheumatoid arthritis[J].Autoimmunity,2011,44(3):243-252.
[9]Dalbeth N,Gundle R,Davies R J,er al.CD56bright NK cells are enriched at inflammatory sites and can engage with monocytes in a reciprocal program of activation[J].J Immu⁃nol,2004,173(10):6418-6426.
[10]Bulfone-Paus S,Bulanova E,Pohl T,et al.Death deflected:IL-15 inhibits TNF-alpha-mediated apoptosis in fibroblasts by TRAF2 recruitment to the IL-15Ralpha chain[J].FASEB J,1999,13(12):1575-1585.
[11]Miranda-Carus M E,Benito-Miguel M,Balsa A,et al.Periph⁃eral blood T lymphocytes from patients with early rheumatoid arthritis express RANKL and interleukin-15 on the cell sur⁃face and promote osteoclastogenesis in autologous monocytes[J].Arthritis Rheum,2006,54(4):1151-1164.
[12]Itano A A,Sims M J,Siu G.Mechanistic medicine:novel strategies for clinical trials[J].Autoimmunity,2010,43(7):560-71.
[13]Baslund B,Tvede N,Danneskiold-Samsoe B,et al.Targeting interleukin-15 in patients with rheumatoid arthritis:a proofof-concept study[J].Arthritis Rheum,2005,52(9):2686-2692.
[14]Dalum I,Butler D M,Jensen M R,et al.Therapeutic antibod⁃ies elicited by immunization against TNF-alpha[J].Nat Bio⁃technol,1999,17(7):666-669.
[15]Renard V,Sonderbye L,Ebbehoj K,et al.HER-2 DNA and protein vaccines containing potent Th cell epitopes induce dis⁃tinct protective and therapeutic antitumor responses in HER-2 transgenic mice[J].J Immunol,2003,171(3):1588-1595.
[16]Zhang C,Wang W,Qin X,et al.B7-H1 protein vaccine in⁃duces protective and therapeutic antitumor responses in SP2/0 myeloma-bearing mice[J].Oncol Rep,2013,30(5):2442-2448.

