中国南海石头鱼毒素NeoVTX的分离纯化、基因克隆及表达
张龙霄,刘珠果,郑兴,戴秋云
1.南华大学 药物药理研究所,湖南 衡阳 421001;2.军事医学科学院 生物工程研究所,北京 100071
石头鱼(Synanceia)属于辐鳍鱼纲(Actinoptery⁃gii)鲉形目(Scorpaeniformes)毒鲉科(Synanceiidae),生活在印度洋和太平洋的热带及亚热带浅水区域,是世界上毒性最强的鱼之一。其毒性装置包括13根背鳍棘、2根腹鳍棘、3根臀鳍棘,以及附着在背鳍棘上并分布于背鳍棘两侧的毒囊。当石头鱼受到攻击时,毒棘会刺入猎物体内,毒液从毒囊里挤出,沿着背鳍棘上的沟槽或沟管注入猎物体内,引起一系列中毒症状,如剧痛、水肿、肌肉麻痹、恶心、呕吐、腹泻、出汗、多涎(唾液分泌过多)、心律不齐、低血压、呼吸窘迫和惊厥等[1-3]。常见的石头鱼有玫瑰毒鲉(S.verrucosa)、粗毒鲉(S.horrida)和S.trachynis(目前尚无中文名称)等,中国海域的石头鱼为玫瑰毒鲉,主要分布于南海海域。
在石头鱼中发现的第一种毒素为Stonustoxin(SNTX),来自粗毒鲉,由α、β亚基组成,分别含有703与700个氨基酸残基,等电点为6.9,晶体结构呈四角形[4]。该毒素具有多种生物活性,包括抑制神经肌肉接头功能、增强血管通透性、强烈的溶血作用、促进血小板凝集、引发水肿等,对小鼠的半数致死量(LD50)为 17 ng/g(静脉注射)[5]。在S.trachynis中发现的Trachynilysin(TYL,目前还未测出全部序列),具有溶血活性、致死性及增加血管通透性的作用[6]。在玫瑰毒鲉中发现了Verrucotoxin(VTX)和Neover⁃rucotoxin(NeoVTX)。VTX为高分子量糖蛋白,由2个α(相对分子质量83×103)和2个β(相对分子质量78×103)亚基组成。β亚基与SNTX的β亚基具有相同的N端,且具有96%的序列同源性。VTX对小鼠的LD50为40 ng/g(静脉注射),还能裂解兔红细胞和降低大鼠动脉血压[7-8]。NeoVTX由α、β亚基组成,分别含有703与700个氨基酸残基,与SNTX的α、β亚基分别具有高达87%和95%的同源性。NeoVTX的β亚基与VTX的β亚基的同源性为90%。NeoVTX也具有溶血活性和致死性,对小鼠的LD50为47 ng/g(静脉注射)[9]。国内对石头鱼的研究极少,仅停留于病例报告。有关石头鱼毒素的表达目前仅有1篇报道。Farid等扩增出SNTX的α、β亚基的cDNA并连接到载体,分别导入大肠杆菌PR700进行表达,重组α、β亚基均能与天然SNTX的抗体结合[10]。
为研究石头鱼粗毒液毒性成分并阐明其基因序列,我们分离鉴定了中国南海石头鱼粗毒液蛋白质,钓取玫瑰毒鲉毒素NeoVTX的α和β亚基的cDNA序列,构建了稳定表达α亚基的大肠杆菌菌株。
1 材料和方法
1.1 材料
玫瑰毒鲉来自中国南海海域;大肠杆菌DH5α购自天根生化公司;大肠杆菌Rosetta感受态细胞购自北京全式金公司;pET-22b(+)载体购自Novagen公司;pMD18-T载体购自TaKaRa公司。其他主要试剂及来源:蛋白酶抑制剂Complete Ultra Tablet(罗氏诊断公司);TRIzol(Invitrogen公司);3'RACE及5'RACE试剂盒(TaKaRa公司);Cre重组酶(近岸蛋白质公司);氨苄西林(Amresco公司);氯霉素(Merck公司);酵母提取物、蛋白胨(Oxoid公司);DNA凝胶回收试剂盒、2×Ex Taq Master Mix和广谱彩虹预染Marker(康为世纪公司);DNA Marker(天根生化公司);His标签蛋白纯化树脂(Ni-NTA Res⁃in)(海基生物公司);BCA Protein Assay Kit(Thermo公司)。引物合成与基因测序由奥科鼎盛公司完成。
1.2 石头鱼粗毒液的提取
沿着石头鱼背鳍棘剪开皮肤和肌肉,将背鳍棘从脊柱上剪断,小心剥离毒棘末端的肌肉,使毒囊暴露,用注射器抽取毒囊中的粗毒液,加入Complete Ultra Tablet,-70℃保存备用。
1.3 石头鱼粗毒液的分离及鉴定
将粗毒液梯度稀释至1/8、1/16、1/32、1/64、1/128并进行SDS-PAGE,将主要条带切割,行液相色谱-质谱分析(LC-MS)。为明确粗毒液中的天然蛋白质,将粗毒液稀释至1/64,并进行天然凝胶电泳。
将粗毒液溶解于0.01 mol/L的PBS(pH7.0),4℃、12 000 r/min离心10 min,取上清液进行分离[TSK Gel G2000 SWxl凝胶柱,流动相为0.5 mol/L NaCl-0.01mol/L PBS(pH7.0),流速0.5 mL/min],收集组分并做SDS-PAGE。
1.4 毒腺组织RNA的提取
刮下毒棘上的毒腺组织,液氮冷冻后捣碎,用TRIzol试剂提取石头鱼毒腺组织RNA。
1.5 NeoVTX α和β亚基cDNA的克隆
根据文献[9]设计引物,按照试剂盒说明书,以毒腺RNA为模板进行3'RACE(α亚基扩增条件:94℃5 min,以94℃ 30 s、55℃ 30 s、72℃ 2.5 min循环35次,72℃ 5 min;β亚基扩增条件延伸时间为3.5 min,其余条件同α亚基)和5'RACE(α亚基扩增条件:94℃ 5 min,以 94℃ 30 s、55℃ 30 s、72℃ 1.5 min循环35次,72℃ 5 min;β亚基扩增条件延伸时间为25 s,其余条件同α亚基)。反应结束后将目的片端连接pMD18-T载体,挑选PCR鉴定为阳性的克隆进行测序,分别获得石头鱼α和β亚基的3'及5'端序列。根据得到的序列,分别设计扩增α和β亚基全长cDNA的引物CA-F1(5'GGACGACTCACACAAC TCAG3')、CA-R1(5'GGAGTCTTGGCATCAGTAAC 3')、CB-F1(5'AGACTCCTACACAACTCAGC3')和CB-R1(5'TAAGATACGTCCATGTACTGC3')。 CAF1和CA-R1用于扩增α亚基,CB-F1和CB-R1用于扩增β亚基(扩增条件均为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 2.5 min,循环35次;72℃ 5 min)。得到完整的α和β亚基cDNA后连接pMD18-T载体进行测序,最终获得α和β亚基cDNA序列。
1.6 α和β亚基cDNA序列的优化
α亚基13、332、534、557位,β亚基13、24、284位均存在CGA密码子,而大肠杆菌对CGA的识别率很低,故须对α、β亚基cDNA序列进行优化。根据CGA的位置,采用重新合成基因及PCR修正等方法,拼接得到了适于大肠杆菌表达的α和β亚基cDNA序列。
1.7 重组表达质粒pET-22b(+)-NeoVTXα及pET-22b(+)-NeoVTXβ的构建
为了将α和β的cDNA连入pET-22b表达载体,设计重组引物α-F(5'AAGAAGGAGATATACATAT GTCTTCAGATATCATGGTA3')、α-R(5'GGTGGTG GTGGTGCTCGAGAAGTAATCTGACAGTTCC3'),以优化的α和β亚基cDNA为模板进行扩增(扩增条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 2.5 min,循环35次;72℃ 5 min),得到用于重组的α和β亚基,按照Cre重组酶说明书,将用于重组的α和β亚基连入pET-22b表达载体,测序表明表达载体构建成功。
1.8 α、β亚基表达菌株的构建
将鉴定无误的重组表达质粒pET-22b(+)-NeoVTXα、pET-22b(+)-NeoVTXβ转化感受态大肠杆菌Rosetta,用含Amp和Cam的LB平板筛选,37℃过夜培养,挑取单菌落增菌后进行测序。
1.9 工程菌的诱导表达及检测
将工程菌接种于含Amp和Cam的LB液体培养基中,37℃振荡培养至D600nm约为0.6,加入诱导剂IPTG(同时设置不加诱导剂及使用空质粒转染宿主细胞的对照组),30℃连续培养5 h,收集菌体进行SDS-PAGE。将剩余的重组菌冰浴超声波裂解(400 W,超声 3 s,间隔 5 s,总时间为 10 min),5000 r/min离心20 min,收集上清液和沉淀(包涵体)进行SDS-PAGE,鉴定蛋白质的表达方式。
1.10 α亚基的大量表达和亲和层析纯化
将测序正确的表达pET-22b(+)-NeoVTXα的单菌落接种于10 mL培养基,过夜培养后,按菌液∶培养基为1∶100的比例接种到1 L培养基中,按照上述方法收集菌体,超声波裂解(400 W,超声3 s,间隔5 s,总时间为40 min),5000 r/min离心20 min,收集沉淀,用UNTA-0溶液溶解,0.45 μm滤膜过滤除去杂质,用带有组氨酸标签的镍-琼脂糖柱亲和层析纯化。NeoVTX α蛋白平衡液中的咪唑浓度为20 mmol/L,洗脱液中的咪唑浓度为500 mmol/L。SDSPAGE检测蛋白质纯度,并用BCA Protein Assay Kit测定蛋白质浓度。
2 结果
2.1 粗毒液的分离鉴定
粗毒液的SDS-PAGE、天然凝胶电泳及凝胶过滤HPLC见图1~3。粗毒液稀释至1/16后上样,得到6条蛋白质条带(标记为A、B、C、D、E、F),经质谱鉴定,确定 A 为 NeoVTX β,B 为 NeoVTX α(分别有99、69个肽段与β、α亚基序列匹配,基本覆盖了整个亚基序列),C、D、E、F为4个未知的蛋白质,其中,D、F与NeoVTX β有最高的匹配度(分别有41、19个肽段属于β),C与β微管蛋白、E与3-磷酸甘油醛脱氢酶的匹配度最高(分别有38、11个肽段属于β微管蛋白、3-磷酸甘油醛脱氢酶)。粗毒液天然凝胶图(图2)中,G为完整的NeoVTX,H为NeoVTX解离的亚基。凝胶过滤HPLC(图3)与电泳图类似,NeoVTX在上清液中含量最高,其他组分丰度较低。
2.2 α、β亚基cDNA序列的克隆
经过3'RACE、5'RACE和全cDNA序列的扩增,得到了α和β亚基cDNA全序列。将cDNA序列连入pMD18-T载体,测序并翻译,得到如下蛋白质序列。
α亚基序列:
MSSDIMVMPALGRPFTLGMLYDTRREKLIPGFSLFGDETLQQYQ SSNTQRSSEFKIVASDSTEPKSSAMDIEASLGVSFLGGLVEVGG SAKYLNNTKKYQNQSRVTLKYKATTIYKQFTAPPGTVKVQETVI TQRGLATHVVTGILYGANAFFVFDSDKVEDTNLQDIQGKMEAVI KKIPTTSIEGSASVQLTDEEKSLASNLSCKFHGDFLLESLPTTF EDAVTTYQTLPTLLGEDGASAVPMKVWLVPLKKFFSKAKLLTQE ITVSKVRRIHTTLEELYKLKRRANEAMDDKLVQQIPLIHDKISN FHQIFQDYMLTVQKKIAEKLPLVRAGTESEQSLQKIIDDRAKSP FSNENVSTRLEVIEREIAVLKSCAGMVEGTQAKFVSNQTELDRE VLAEDVKHALCFVFTSVERNDPYLKVLSDYLEPPDSKDGKEAVP STEDKWCFSTRVVLKMKQRAQTFCDHVNDFEKSRNVGFFVTALE NGKFQGASIYHYKEGSLATQDFTFPRMPFVQGYKKRSDLLWYAC DLTFDRNTINIWVSLSDNDTFAASEHGKRQNYPKHPERFLCYNQ VLCNEGLTGKHYWEVEWNGYVDVGVAYISISRKEDNWVSAIGHN TCSWVFSSIPRAGYVERYNQRQYYVTVPTPGFKQLGVFLNWPDG SLSFYAVSSDEVHHLHTFKTKFTEPVYPAFCLGYRFDHGTVRLL
β亚基序列:
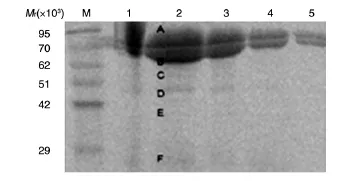
图1 粗毒液的SDS-PAGE
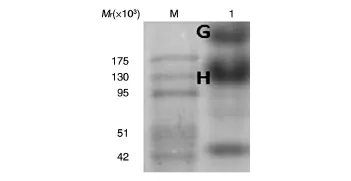
图2 粗毒液的天然凝胶电泳
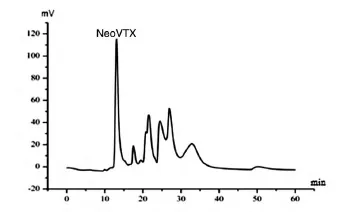
图3 粗毒液的凝胶过滤分离
MPSDILVVAALGRPFTLGMLYDARNDKLIPGFTLWEDEVIEEST VENSQPSSAFEIIASDSIDDKSSLMDIEASLKASFLGGLVEVGG SAKYLNNQKKFKNQSRVTLQYKATTNFKQLMTNLGTKHVEYTEL FENIQATHVVIGILYGANAFFVFDSNKVDSTNVQEIQGQMEAVI KKIPSVEISGKASVQLTSEETDITNSFSCEFHGDFFLTSNPTTF EDAVKTYQQLPQMMGKDNAVPMTVWLVPMVNFYSEAPQLMADSS TPILRKVRNTLEAIVQVQMRCNDALDDPTVNLFTEVQRKLSDFQ IICDDHMSKLQATIAKKLFAIRSGDEDESALVNLFEENLQSPFN IESLNMWMEFEEREINVLKSCMDILTKAKPKVIFNQGVFFKELY DSKVKHGLCYVFTNVTKNDDFLTVLNDFLDSPQSRPKKLRPSPK DYWYSYDDIPEMMREKAHLFRNLAKEMNNRCVHFFVTAINNPKQ EGAGIHYYRESIQIIHEFTKPHMPDVETIKDRRELQWYDCELTL DTETAHQVLTLSEGNKKAVSGSTKSPADHFEKFSHFQQVMCTKG LSGRHYWELEWSGHVSAGVTYKGISRKTSTPDSSLGKNQKSWVF EYTKKSGYQQIHNGKNARVTVSSIGFKQLGVYLDWPAGTLSFYM VNKAWVTHLHTFHTKFYEAVYPAFLIGDAQQKVNGQIKLL
将2个亚基的序列与文献[9]中α、β的序列进行BLAST比对,同源性均高达99%。
2.3 工程菌测序
对α、β亚基cDNA序列进行优化后设计重组引物,扩增得到可以使用Cre重组酶进行重组连接的cDNA序列,分别连入pET-22b(+)载体,测序,得到重组表达载体 pET-22b(+)-NeoVTXα、pET-22b(+)-NeoVTXβ,分别转化大肠杆菌Rosetta后,挑取菌落进行测序,结果均正确,表明得到含有目的基因的工程菌。
2.4 工程菌表达蛋白质的鉴定
将pET-22b(+)-NeoVTXα工程菌用IPTG诱导后,收集菌体并裂解,收集上清液与沉淀进行SDSPAGE(对照组也依此进行)。工程菌诱导后,较诱导前有明显增加的蛋白条带,相对分子质量约75×103,为构建的工程菌诱导表达后的外源蛋白。重组α亚基几乎都分布于超声波裂解后的菌体沉淀中,以包涵体的形式存在,上清液中含量很少(图4)。β亚基较诱导前无明显增加。
2.5 α亚基的表达及纯化
经1 L发酵体系培养,收集菌体,超声波裂解、离心并溶解沉淀,Ni-NTA纯化带6×His标签的α亚基,得到纯度大于95%的重组蛋白0.45 mg(图5)。
3 讨论
我们除了对石头鱼粗毒液中丰度高的NeoVTX进行研究外,对丰度较低的蛋白质也进行了探讨。经过质谱测序,推测上述D、F为分子较小的毒素或NeoVTX β的降解片段,C、E为β微管蛋白的结构蛋白、3-磷酸甘油醛脱氢酶。值得注意的是,有些分子较小的蛋白质或多肽也具有毒性,如在奥氏江魟(Potamotrygon orbignyi)中发现的 Orpotrin 和 Por⁃flan。Orpotrin仅有9个氨基酸残基,仍然具有强烈的收缩血管的作用;Porflan含有18个氨基酸残基,可与细胞膜磷脂相互作用,与江魟毒素的诱导过敏反应有紧密关系[11-12]。D和F是否在石头鱼毒性中扮演重要的角色有待进一步研究。
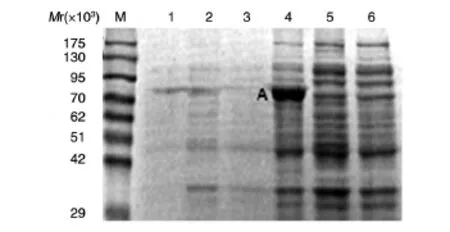
图4 α亚基的表达鉴定
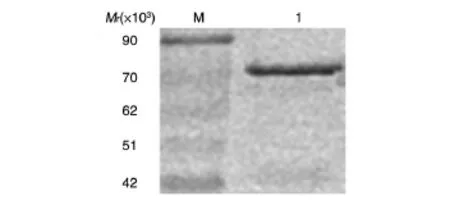
图5 纯化的α亚基的凝胶电泳
本研究中的南海石头鱼NeoVTX的α、β亚基与在日本冲绳海域捕捞的石头鱼NeoVTX的α、β亚基的同源性均为99%,说明两者的亲缘性很高。
经密码子优化后,α亚基在pET-22b(+)载体中可有效表达,β亚基经密码子优化后表达仍较困难,后改用pET-24a(+)和pET-28a(+)载体表达,表达量仍较低,目前正在尝试其他表达体系。
总之,我们获得了中国南海石头鱼粗毒液中的毒性蛋白质NeoVTX,克隆了其cDNA序列,构建了稳定表达NeoVTX α亚基的大肠杆菌菌株,为制备中国石头鱼抗毒素奠定了基础。
[1]Warrell D A.Venomous bites,stings,and poisoning[J].Infect Dis Clin N Am,2012,26:207-223.
[2]Khoo H E.Bioactive proteins from stonefish venom[J].Clin Exp Pharmacol Physiol,2002,29:802-806.
[3]Kiriake A,Suzuki Y,Nagashima Y,et al.Proteinaceous tox⁃ins from three species of scorpaeniform fish(lionfish Pterois lu⁃nulata,devil stinger Inimicus japonicus and waspfish Hypo⁃dytes rubripinnis):close similarity in properties and primary structures to stonefish toxins[J].Toxicon,2013,70:184-193.
[4]Yew W S,Kolatkar P R,Kuhn P,et al.Crystallization and preliminary crystallographic study of stonustoxin,a protein le⁃thal factor isolated from the stonefish(Synanceja horrida)venom[J].J Struct Biol,1999,128:216-218.
[5]Low K S,Gwee M C,Yuen R,et al.Stonustoxin:a highly po⁃tent endothelium-dependent vasorelaxant in the rat[J].Toxi⁃con,1993,31:1471-1478.
[6]Kreger A S.Detection of a cytolytic toxin in the venom of the stonefish(Synanceia trachynis)[J].Toxicon,1991,29:733-743.
[7]Yazawa K,Wang J W,Hao L Y,et al.Verrucotoxin,a stone⁃fish venom,modulates calcium channel activity in guinea-pig ventricular myocytes[J].Br J Pharmacol,2007,151:1198-1203.
[8]Garnier P,Goudey-Perriere F,Breton P,et al.Enzymatic properties of the stonefish(Synanceia verrucosa Bloch and Sch⁃neider,1801)venom and purification of a lethal,hypotensive and cytolytic factor[J].Toxicon,1995,33(2):143-155.
[9]Ueda A,Suzuki M,Honma T,et al.Purification,properties and cDNA cloning of neoverrucotoxin(neoVTX),a hemolytic le⁃thal factor from the stonefish Synanceia verrucosa venom[J].Biochim Biophys Acta,2006,1760:1713-1722.
[10]Ghadessy F J,Chen D,Kini R M,et al.Stonustoxin is a nov⁃el lethal factor from stonefish(Synanceja horrida)venom,cD⁃NA cloning and characterization[J].J Biol Chem,1996,271(41):25575-25581.
[11]Conceição K,Konno K,Melo R L,et al.Orpotrin:a novel va⁃soconstrictor peptide from the venom of the Brazilian stingray Potamotrygon gr.orbignyi[J].Peptides,2006,27:3039-3046.
[12]Conceição K,Santos J M,Bruni F M,et al.Characterization ofa new bioactive peptide from Potamotrygon gr.orbignyi freshwater stingray venom[J].Peptides,2009,30:2191-2199.

