人角质细胞生长因子2在不同原核表达系统中的表达差异
孙卫国,张灵霞,熊志红,刘艳华,程小星
解放军第309医院 结核病研究所,全军结核病防治重点实验室,北京 100091
角质细胞生长因子2(keratinocyte growth factor-2,KGF-2)亦称成纤维细胞生长因子10(fibroblast growth factors-10,FGF-10),是由208个氨基酸残基组成的单链多肽,相对分子质量约24×103[1]。KGF-2是脊椎动物胚胎发育过程中的必需调节因子[2],具有广泛的生物学功能,在多种因素如溃疡、急慢性炎症、烧伤因素等引起的组织器官损伤的修复过程中发挥重要作用[3]。目前利用基因工程技术表达的重组人KGF-2(rhKGF-2)可能存在的问题是表达量较低及表达不稳定,尤其是在中试过程中,pBV220-rh⁃KGF-2出现不表达现象。我们构建了pBV220-rh⁃KGF-2、pET-24b-rhKGF-2和pQE31-rhKGF-2表达载体,分别转化对应的表达宿主菌,比较了同一hKGF-2基因在不同原核表达系统中的表达情况,筛选出稳定高效的表达菌株,为探索KGF-2的最佳表达体系,进一步进行大规模生产提供依据。
1 材料与方法
1.1 材料
喉癌Hep-2细胞株,大肠杆菌JM109、M15、BL21(DE3),表达载体pBV220、pET-24b、pQE31均系本室保存;限制性内切酶EcoRⅠ、BamHⅠ、NdeⅠ,T4DNA连接酶购自Promage公司、Taq DNA聚合酶和dNTP购自TaKaRa公司;人胎肝cDNA文库购自Clontech公司;SP Sepharose Fastflow购自Pharmacia公司;MTT购自Sigma公司;rhKGF-2由本室纯化冰干保存;其他生化试剂均为国产分析纯产品。
1.2 引物设计
根据hKGF-2基因编码序列及各限制性酶切位点序列特性,设计并合成特异性引物,并在各引物的两端引入限制性内切酶位点,在反向引物中将原终止密码子TAG改为大肠杆菌偏性的TAA。针对载体pBV220的正向引物为5′-CGGAATTCATGCAAG CCCTTGGTCAGGACAT-3′(下划线为EcoRⅠ位点),反向引物为5′-CGGGATCCTTATGAGTGTACCACC AT-3′(下划线为BamHⅠ位点);针对载体pQE31的正向引物为5′-CGGAATTCATGCAAGCCCTTGGTC AGGACAT-3′(下划线为EcoRⅠ位点),反向引物为5′-CCCAAGCTTTTATGAGTGTACCACCAT-3′(下划线为HindⅢ位点);针对载体pET-24b的正向引物为5′-GGGAATTCCATATGCAAGCCCTTGGTCAGGAC AT-3′(下划线为NdeⅠ位点),反向引物为5′-CCG CTCGAGTTATGAGTGTACCACCAT-3′(下 划 线 为XhoⅠ位点)。
1.3 重组hKGF-2表达载体的构建
以人胎肝cDNA文库为模板,用正、反向引物通过常规PCR方法扩增得到hKGF-2编码核酸序列。先后以各限制性内切酶对扩增纯化的PCR产物进行双酶切后与经同样双酶切的表达质粒进行连接反应,连接产物转化各载体对应的宿主感受态大肠杆菌JM109、M15或BL21(DE3)细胞,筛选阳性克隆进行测序。
1.4 重组hKGF-2的表达和纯化
取测序正确的阳性克隆菌落接种于抗生素抗性的LB培养基中,于37℃振摇培养,当菌液D600nm值达0.4时,把pBV220-rhKGF-2表达宿主菌JM109立即移至42℃进行热诱导5 h;在pET-24b-rhKGF-2和pQE31-rhKGF-2的宿主菌M15和BL21(DE3)中加入IPTG,于37℃诱导7 h;4℃离心收集各载体的表达菌体,将菌体溶于1×PBS(20 mmol/L,pH7.4,含2 mmol/L EDTA)缓冲液中,超声波破碎后进行14%的SDS-PAGE,分析目的蛋白的表达量和表达形式。分别取表达上清,于4℃层析柜中过SP Sepha⁃rose Fastflow阳离子交换柱,用梯度NaCl溶液洗脱,收集穿过峰和各洗脱峰蛋白,行14%的SDS-PAGE分析。取纯化的重组蛋白经水透析后冰干保存。
1.5 重组hKGF-2的抗原性和生物学活性检测
取纯化的rhKGF-2行14%的SDS-PAGE,湿转移至硝酸纤维素膜上,以5%的脱脂奶粉在37℃封闭1 h。抗原抗体反应中的第一抗体为兔抗hKGF-2抗体,第二抗体为羊抗兔IgG-HRP,ECL暗室自动曝光显影验证各蛋白的抗原性。取冰干保存的rh⁃KGF-2,用PBS稀释至1 mg/mL母液备用;用RPMI 1640培养基培养喉癌细胞株Hep-2,取对数生长期的细胞接种于96孔细胞培养板中,2×104/孔,24 h后更换无血清的RPMI1640,加入以无菌PBS缓冲液配制的不同浓度的rhKGF-2,37℃、5%CO2培养箱中培养48 h,对照组以等体积的PBS缓冲液补齐,每组5个复孔,MTT法检测各孔的D570nm值。
2 结果
2.1 pBV220-rhKGF-2、pET-24b-rhKGF-2 和pQE31-rhKGF-2载体的构建
以人胎肝cDNA文库为模板,通过常规PCR方法扩增得到成熟hKGF-2核酸序列。10 g/L琼脂糖凝胶电泳显示,在约500 bp处有明显的条带(图1)。以限制性内切酶对扩增纯化的PCR产物进行双酶切后,与经同样双酶切的质粒pBV220、pET-24b和pQE31分别进行连接反应,连接产物转化各载体对应的表达感受态大肠杆菌,分别筛选阳性克隆进行测序,测序结果与预期序列完全一致。
2.2 rhKGF的表达和纯化
取测序正确的阳性克隆菌落接种含抗生素的LB培养基,于37℃振荡培养,当菌液D600nm达0.4时,分别如上所述于42℃热诱导5 h或于37℃ IPTG诱导7 h。14%SDS-PAGE结果显示(图2),在目的相对分子质量约21×103处,pBV220-rhKGF-2与pET-24b-rhKGF-2表达系统有明显的重组蛋白hKGF-2表达,其中pBV220-rhKGF-2的表达量占总蛋白的10%,而pET-24b-rhKGF-2占总蛋白的25%,明显优于前者,重组蛋白均主要以可溶形式存在于超声波破菌后的上清内。pQE31-rhKGF-2经诱导后几乎没有目的蛋白表达。
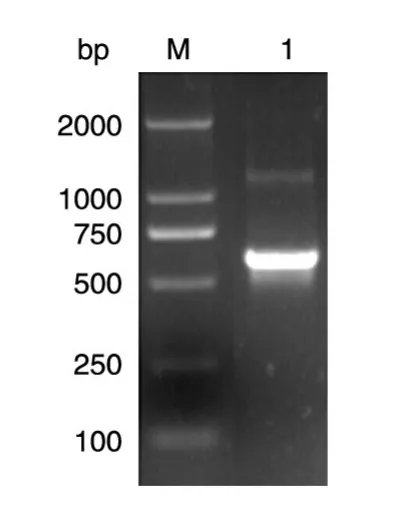
图1 hKGF-2核酸序列的PCR扩增
取表达上清,分别在4℃层析柜中过SP Sepha⁃rose Fastflow阳离子交换柱,梯度NaCl溶液洗脱,收集穿过峰和各洗脱峰蛋白,进行14%的SDS-PAGE,发现rhKGF-2在NaCl浓度为0.9 mol/L时被洗脱。取纯化的目的蛋白进行14%的SDS-PAGE,考马斯亮蓝染色(图3)和薄层扫描分析表明其纯度在95%以上。取纯化的重组蛋白,经水透析后冰干保存。
2.3 rhKGF-2的抗原性和生物学活性检测
取冰干保存的rhKGF-2,经SDS-PAGE后转移至硝酸纤维素膜上,用脱脂奶粉封闭后进行一抗、二抗孵育,曝光显影。Western印迹结果(图4)显示,纯化后的重组蛋白均能与KGF-2抗体结合,反应条带单一并与预期相对分子质量一致,表明纯化的重组蛋白具有较好的抗原活性。
用MTT法检测rhKGF-2对喉癌Hep-2细胞生长的影响。结果(图5)显示,rhKGF-2在100 ng/mL的浓度下就能显著促进Hep-2细胞增殖,pET-24brhKGF-2与pBV220-rhKGF-2表达的重组蛋白在100~1000 ng/mL浓度范围内对Hep-2细胞的促增殖作用一致,两者在统计学上无差异,且都显示出明显的浓度依赖特性。
3 讨论
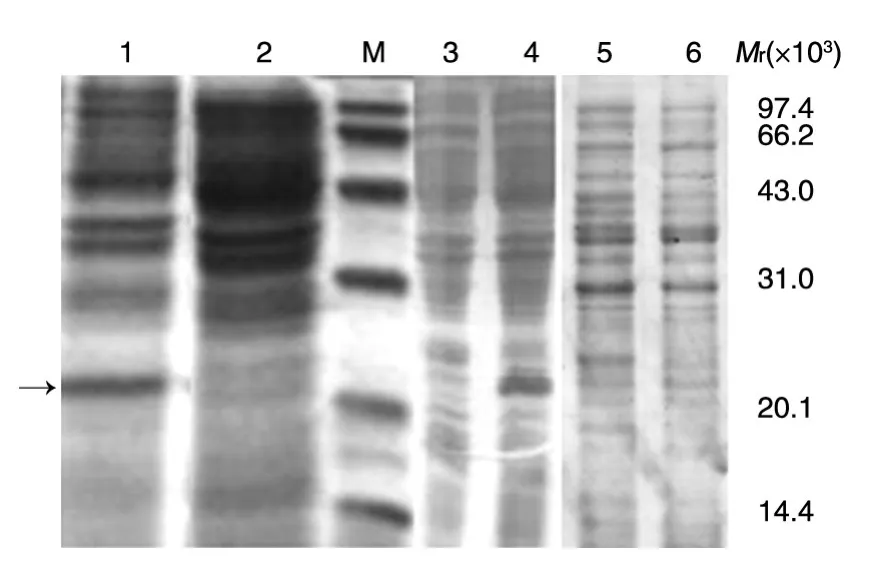
图2 rhKGF-2原核表达产物的SDS-PAGE分析
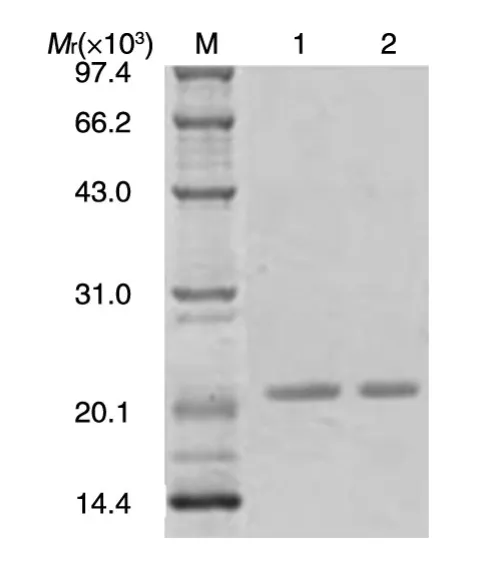
图3 rhKGF-2经SP纯化的SDS-PAGE分析
KGF-2是具有多种功能的细胞生长因子,它可以加速外伤性创口的愈合,修复各种皮肤损伤且几乎不形成明显瘢痕[4]。此外,还参与和调控胚胎组织和器官的形成与分化,在胚胎发育过程中起重要的调节作用[5]。利用基因工程技术获得rhKGF-2具有广泛的市场前景,但如何得到稳定表达且表达量高的菌株,是进行中试规模化生产的前提。我们通过构 建 pBV220-rhKGF-2、pET-24b-rhKGF-2和pQE31-rhKGF-2表达载体,比较了hKGF-2基因在不同原核表达系统中的表达量与表达稳定性之间的差异,以期获得稳定和高表达的菌株。实验结果表明,pBV220-rhKGF-2的表达量占总蛋白的10%,而pET-24b-rhKGF-2的表达量占总蛋白的25%,同时发现pET-24b-rhKGF-2的表达稳定性明显强于pBV220-rhKGF-2载体系统,两者表达生成的重组蛋白都主要以可溶形式存在。pQE31-rhKGF-2经诱导后几乎没有目的蛋白表达。pBV220表达载体为热诱导机制,菌体的密度和温度不易控制,可能会在大规模发酵过程中出现表达不稳定现象;pQE31载体采用T5启动子,其对不同基因的表达效果差异明显,对某一类蛋白不能生成重组蛋白;pET系列载体采用T7启动子,该载体系统是在大肠杆菌中克隆和表达重组蛋白的最强大系统,同时在规模生成过程中也易于控制,表达稳定,表达量明显优于pBV220表达系统,这与某些实验结果[6]有所出入。我们还发现,利用不同的原核系统生成的重组蛋白在抗原性和生物活性方面没有明显差异。综上,针对不同的重组蛋白,不同的表达载体和宿主菌及不同的诱导条件有明显差异的表达效率和稳定性。
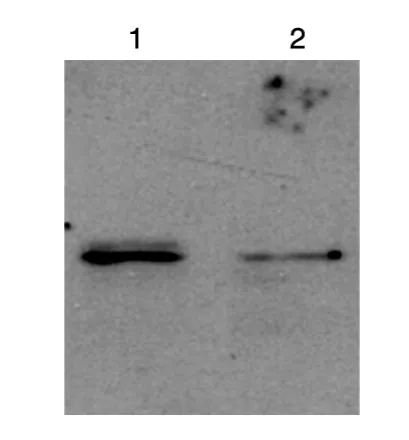
图4 纯化的rhKGF-2的Western印迹
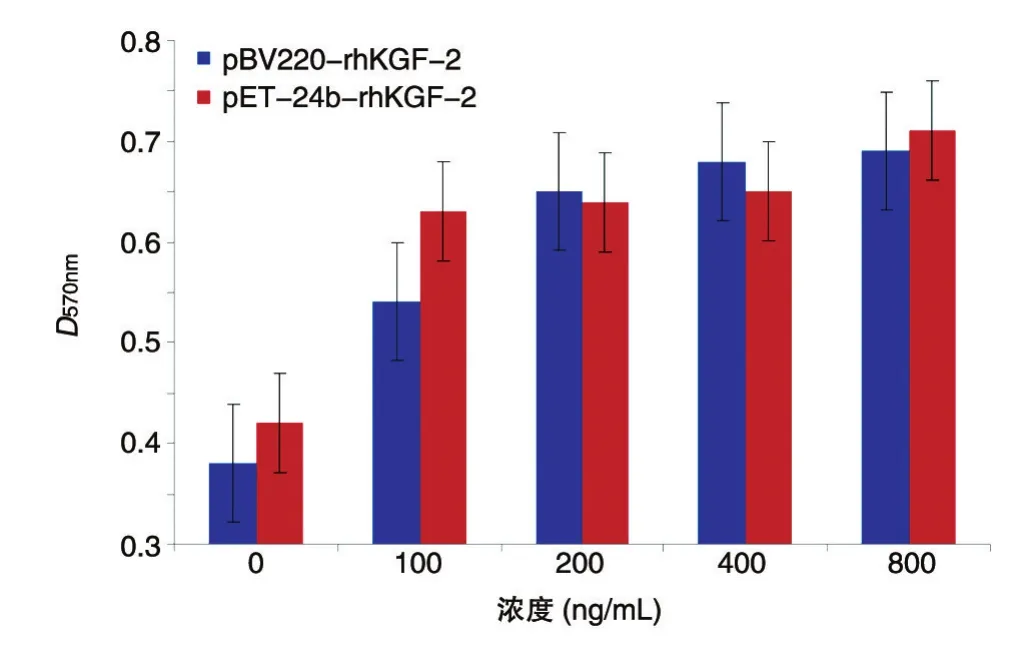
图5 rhKGF-2对Hep-2细胞的促增殖作用
[1]Emoto H,Tagashira S,Mattei M G,et al.Structure and ex⁃pression of human fibroblast growth factor-10[J].J Biol Chem,1997,272(37):23191-23194.
[2]Benjam J T,Smith R J,Halloran B A,et al.FGF-10 is de⁃creased in bronchopulmonary dysplasia and suppressed by Toll-like receptor activation[J].Am J Physiol Lung Cell Mol Physiol,2007,292(2):550-558.
[3]Warburton D,Perin L,Defilippo R,et al.Stem progenitor cells in Lung development,injury repair,and regeneration[J].Proc Am Thorac Soc,2008,5(6):703-706.
[4]Beer H D,Bittner M,Niklaus G,et al.The fibroblast growth factor binding protein is a novel interaction partner of FGF-7,FGF-10 and FGF-22 and regulates FGF activity:implications for epithelial repair[J].Oncogene,2005,24(34):5269-5277.
[5]Patel V N,Likar K M,Zismar-Rozen S,et al.Specific hepa⁃ran sulfate structures modulate FGF-10 mediated submandibu⁃lar gland epithelial morphogenesis and differentiation[J].J Bi⁃ol Chem,2008,283(14):9308-9317.
[6]游力,余德荣,许晓群,等.hKGF-2在不同原核载体中的构建、表达和纯化分析[J].山东大学学报,2008,46(12):1115-1119.

