小鼠CDC26基因短发夹RNA重组腺病毒载体的构建与表达分析
程然然,闫永红,弓蒙蒙,曹培丽,贺福初,,王晓晖
1.北京工业大学 生命科学与生物工程学院,北京 100124;2.军事医学科学院 放射与辐射医学研究所,北京蛋白质组研究中心 蛋白质组学国家重点实验室,北京 102206
细胞分裂周期蛋白26(cell division cycle 26,CDC26)是细胞周期后期促进复合物(cell cycle anaphase-promotingcomplex,APC)家 族 成 员 。CDC26基因是编码泛素连接酶的基因之一,通过编码细胞中泛素连接酶来调控细胞周期蛋白的合成与分解,以实现细胞周期性的分裂与增殖分化[1-2]。CDC26和APC6连接后,可以对细胞周期蛋白的降解产生作用[3]。
目前对CDC26基因的研究报道不多,大多都是对CDC25和CDC42基因所控制的其蛋白家族的研究[4-6]。RNA干扰(RNA interfering,RNAi)是近年发展迅速的一项生物技术,已成为基因功能研究和基因治疗的强有力工具[7]。我们以短发夹RNA(short hair RNA,shRNA)腺病毒为介导,构建靶向干扰CDC26基因的表达载体,为CDC26基因功能的研究提供相关技术手段和积累资料。
1 材料与方法
1.1 材料
人293A细胞株、HeLa细胞株、小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)、大肠杆菌Top10菌株、穿梭载体pENTRY-EF1a-EGFP-Mir30、腺病毒载体pAd/pl-DEST均来自北京蛋白质组研究中心分子遗传学实验室;DNA限制性内切酶、T4DNA连接酶购自NEB公司;Gateway体外重组系统、PEI转染试剂、TRIzol购自Invitrogen公司;DNA快速纯化回收试剂盒、质粒提取试剂盒购自Promega公司;其他常规试剂均为进口或国产分析纯级产品。
1.2 穿梭载体pENTRY-CDC26-shRNA的构建和鉴定
参考小鼠CDC基因(GenBank:NM_139291.3)设计CDC26基因的靶向shRNA序列(TGCTGTTGACA GTGAGCGCAGCTCAAGCTCGACGACATTGTAGTGAAGCCACAGA TGTACAATGTCGTCGAGCTTGAGCTTTGCCTACTGCCTCGGA)及对照组shRNA序列(为GFP的靶向序列,命名为S000)(TGCTGTTGACAGTGAGCGAAACGTCTATATCATGGCCG ACTAGTGAAGCCACAGATGTAGTCGGCCATGATATAGACGTTGT GCCTACTGCCTCGGA)。
本研究避开了传统的PCR扩增靶向shRNA序列,而是依据DNA双链互补性质将目的序列分割合成,而后以退火连接的方式构建其载体。CDC26序列拆分如下:
A:tcgagaaggtatattgctgttgacagtgagcgCAGCTCAAGCTCGACG ACATTG;B:ttcactaCAATGTCGTCGAGCTTGAGCTGcgctcactgtca acagcaatataccttc;C:tagtgaagccacagatgtaCAATGTCGTCGA GCTTGAGCTTtgcctactgcctcgg;D:aattccgaggcagtaggcaAAG CTCAAGCTCGACGACATTGtacatctgtggc。
S000对照组以同样的方法拆分,由华大基因有限公司(北京)合成。A和B退火,C和D退火,退火产物直接暴露有XhoⅠ和EcoRⅠ酶切位点,无须再次酶切。将2段退火产物与pENTRY-EF1a-EGFPMir30(XhoⅠ和EcoRⅠ酶切回收)载体用T4DNA连接酶连接,转化大肠杆菌TOP10感受态细胞,卡那霉素(Kan)抗性选择阳性克隆,提质粒,送华大基因有限公司进行测序鉴定。
1.3 重组腺病毒载体pAd-CDC26-shRNA的构建
将测序鉴定正确的pENTRY-CDC26-shRNA载体用Gateway体外重组系统重组到pAd/pl-DEST。Gateway反应体系(10 μL)包括6 μL TE(pH8.0)、1 μL pENTRY-CDC26-shRNA(100 ng)、1 μL pAd-DEST(150 ng)、2 μL LRⅡ重组酶。室温反应1 h,转化大肠杆菌TOP10感受态细胞,氨苄西林(Amp)抗性选择阳性克隆,提取质粒用EcoRⅠ酶切鉴定。
1.4 重组腺病毒的包装与扩增
将正确的重组子用PacⅠ酶切线性化,乙醇沉淀法回收,用PEI转染293A细胞,24 h后观察GFP的表达,培养7~10 d后在显微镜下观察细胞空斑病变,当细胞中出现病变且视野中局部或全部为绿色荧光时,表明重组腺病毒在293A细胞中包装成功。当部分细胞开始变圆并脱落时,收集细胞及其培养液,于-80℃与37℃反复冻融3次裂解细胞以释放病毒颗粒,4000 r/min离心10 min,取上清于-80℃保存,将回收到的病毒原液感染新的293A细胞,扩增病毒,回收备用。
1.5 病毒滴度的测定
准备生长良好的HeLa细胞,消化计数稀释至1×105/mL,加入6孔板,1 mL/孔;将3个稀释度(10-2、10-3、10-4)的病毒加入6孔板,24 h后观察病毒感染细胞的荧光数量[8],利用流式细胞仪检测病毒滴度。
1.6 CDC26 shRNA重组腺病毒在细胞内的表达及干扰效果鉴定
基础细胞培养液加10%胎牛血清(FBS)培养MEF,其密度达90%时用已知滴度的病毒液感染细胞,24 h后观察GFP的表达情况,以确定重组腺病毒是否感染MEF。收集感染的实验组细胞与对照组(S000)细胞,TRIzol法提取总RNA,并反转录形成cDNA。采用实时荧光定量PCR(qPCR)检测CDC26基因mRNA的表达情况[9-10]。以β-actin为内参,用NCBI Primer Blast设计各组的定量检测引物CDC26-F(5'-TGCAGAGGCCTGAAAAGAGATTT-3')、CDC26-R(5'-ACTCCTCAATGTCGTCGAGC-3')、 β-ac⁃tin-F(5'-AACAGTCCGCCTAGAAGCAC-3')和 β-actin-R(5'-CGTTGACATCCGTAAAGACC-3')。用 2-ΔΔCt法进行相对定量分析,检测CDC26基因mRNA的表达情况。
2 结果
2.1 穿梭质粒pENTRY-CDC26-shRNA的克隆
将克隆好的CDC26与对照组S000入门质粒进行测序鉴定,证实所设计的shRNA序列已正确插入pENTRY-EF1α-EGFP-Mir30载体。
2.2 重组腺病毒载体pAd-CDC26-shRNA的构建
pAd-CDC26-shRNA载体经EcoRⅠ酶切,结果与理论预期相符(图1),表明成功构建了腺病毒重组载体pAd-CDC26-shRNA。
2.3 重组腺病毒的包装
带有GFP标记的线性化pAd-CDC26-shRNA及对照组pAd-S000-shRNA载体转染293A细胞8 d后,在显微镜下观察到细胞病变,且GFP充满视野中的绝大多数细胞,表明腺病毒包装成功(图2)。
2.4 病毒滴度测定结果
用流式细胞仪检测3个浓度梯度的细胞荧光产生情况,结果见图3,阴性对照组无荧光产生,其余3组(10-2、10-3、10-4)都产生了不同层次的荧光数目。假定每一个细胞内只有一个病毒进入,则根据公式及10-2管的病毒感染率可计算出病毒初液的滴度(UT/mL)=0.835×1.18×106×100/0.9=1.09×1010。
2.5 CDC26 shRNA重组腺病毒在细胞内的表达及干扰效果
用已知滴度的病毒感染3代以内的MEF,24 h后在荧光显微镜下观察,可见视野中有大量绿色荧光(图4),说明重组腺病毒成功感染了MEF。收集各组细胞进行实时荧光定量PCR检测,结果表明荧光定量PCR引物具有很好的溶解曲线(图5),表明PCR引物特异性良好。被感染了病毒的细胞其相应的基因扩增率仅为26.85%,可计算出设计和构建的shRNA对细胞中CDC26基因的抑制率为73.14%(图6),表明成功构建了具有较高敲低效果的shRNA腺病毒载体。
2.6 CDC26 shRNA重组腺病毒在小鼠肝脏内的干扰效果研究
用已知病毒滴度的腺病毒,尾静脉注射6~8周雄性C57/BL6小鼠,1010/只,对照组和实验组各5只,注射1周后测量小鼠空腹血糖。结果发现,与对照小鼠相比,注射CDC26 shRNA的小鼠的血糖值明显降低(图7),表明CDC26在小鼠体内血糖的维持中起重要作用,同时暗示了CDC26在糖代谢过程中的重要作用。
3 讨论
CDC26是APC家族中的一员,由位于小鼠4号染色体上的CDC26基因编码,对调控细胞周期具有重要作用。目前有关APC家族的研究主要集中在CDC25和CDC42上[11],对CDC26的研究报道较少。

图1 pAd-CDC26-shRNA重组质粒的酶切鉴定

图2 重组腺病毒包装过程中的细胞病变效应及GFP表达(×40)

图3 流式细胞术检测pAd-CDC26-shRNA重组腺病毒滴度

图4 重组腺病毒感染MEF(×40)

图5 实时荧光PCR引物特异性的溶解曲线

图6 构建的shRNA敲低CDC26 mRNA的RT-qPCR检测结果
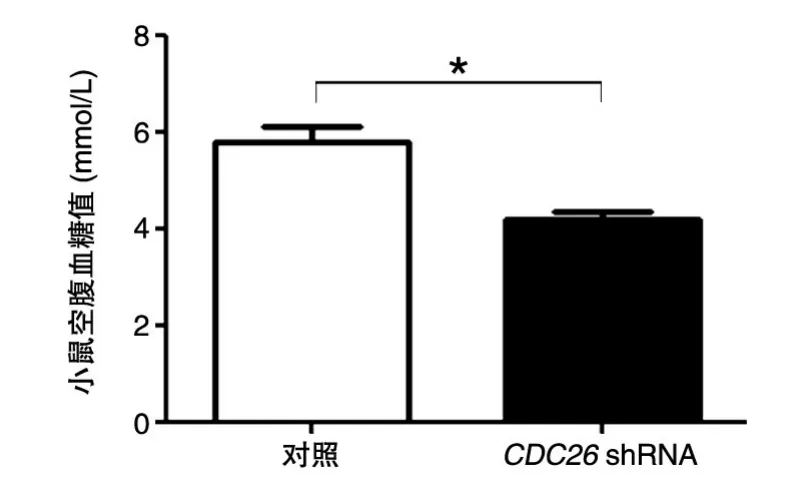
图7 病毒注射7 d后C57/BL6小鼠的空腹血糖值
为了进一步研究CDC26在细胞中可能发挥的作用,我们设计了CDC26基因的shRNA。鉴于腺病毒具有感染效率高、宿主广泛、容易制备表达、不整合入染色体、表达效率高等优点,我们选择构建CDC26基因的shRNA腺病毒载体。通过限制性内切酶分析及碱基序列测定,证明构建了重组腺病毒载体pAd-CDC26-shRNA。我们在293A细胞中包装了重组腺病毒。RT-qPCR检测结果显示,感染pAd-CDC26-shRNA腺病毒的MEF中CDC26基因的mRNA表达明显减少,证明靶向shRNA表达成功。我们还发现CDC26敲低后小鼠的血糖值会明显降低。以上结果为下一步机制研究奠定了基础。
[1]杨娜,侯巧明.泛素连接酶的结构与功能研究进展[J].生物化学与生物物理进展,2008,35(1):14-20.
[2]罗兰.5种细胞周期调控基因在小鼠生殖细胞发育过程中的表达研究[J].云南大学学报,2002,24(2):125-129.
[3]Wang Jing,Dye B T,Rajashankar K R,et al.Insights into anaphase promoting complex TPR subdomain assembly from a CDC26-APC6 structure[J].Nat Struct Mol Biol,2009,16(9):987-989.
[4]胡国栋.利用Cre/loxp技术构建血管内敲除cdc42基因杂合子小鼠[J].实用医学杂志,2010,24(26):4483-4486.
[5]Yuan H,Zhang H,Wu X,et al.Hepatocyte-specific deletion of Cdc42 results in delayed liver regeneration after partial hepatectomy in mice[J].Hepatology,2009,49(1):240-249.
[6]张阳,张杰,于爱鸣,等.蛋白激酶A/Cdc25B通路在小鼠卵母细胞G2期阻滞中作用的研究[J].生殖与避孕,2005,4(25):195-200.
[7]赵鸿梅,腾秋艳,张哲,等.小鼠Cdc25B融合蛋白构建和表达[J].中国公共卫生,2007,8(23):976-977.
[8]白鹏,吕愈敏,顾芳.细菌16S rDNA荧光定量PCR法分析溃疡性结肠炎患者肠道菌群变化[J].胃肠病学和肝病学杂志,2008,17(7):566-571.
[9]贾岩峰,崔云峰,李东华.小鼠SCP2基因shRNA重组腺病毒载体的构建与鉴定[J].中华肝胆外科杂志,2012,18(2):145-149.
[10]杨波,徐志飞,沈宏亮.腺病毒重组绿色荧光蛋白转染兔脂肪干细胞的体外研究[J].中国美容整形外科杂志,2012,23(1):60-64.
[11]刘扬,银凤霞,白春玲,等.Cdc42蛋白在牛卵母细胞中的表达分布及对其成熟的影响[J].中国农业科学,2014,47(3):574-585.

