siRNA沉默SIRT1基因对宫颈癌细胞HeLa增殖和凋亡的影响
吴 琦,于 红,张文卿
(青岛大学医学院医学微生物学教研室,山东 青岛 266071)
沉默信息调节因子2相关酶1(silent mating type information regulation 2 homolog 1,SIRT1)是依赖烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的去乙酰化酶类,SIRT1通过对多种组蛋白及非组蛋白底物的去乙酰化作用,调节基因转录表达和染色质重塑,进而参与代谢、细胞分化、衰老、凋亡及肿瘤发展等生理及病理生理过程[1]。研究表明SIRT1与肿瘤的发生发展及耐药密切相关,有望成为肿瘤表观遗传学治疗的良好靶标[2]。RNA 干扰(RNA interference,RNAi)是双链RNA介导的转录后基因沉默,导入细胞后双链RNA可特异性地识别并结合与其序列互补的核酸片段,进而降解内源性的mRNA,形成特定基因的表达沉默[3-4]。RNA干扰具有高特异性和高效性的特点,已成为研究基因功能、信号传导通路、肿瘤治疗的重要工具之一。本研究化学合成靶向 SIRT1的 siRNA(small interference RNA,siRNA)并转染宫颈癌细胞株 HeLa,观察 siRNA SIRT1对HeLa细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料
人宫颈癌细胞株HeLa由本实验室保存。靶向SIRT1的siRNA(5'-ACUUUGCUGUAACCCUGUAdTdT-3')及无义序列siRNA委托Life technology公司合成;Lipofectamine RNAiMAX转染试剂购自Life technology公司。hGAPDH、SIRT1基因引物由Life technology公司合成。细胞增殖及细胞毒性检测试剂盒(Cell Counting Kit-8,CCK-8)购自武汉博士德生物工程有限公司;P53一抗、P21一抗、Survivin一抗为北京博奥森生物技术有限公司产品;β-actin一抗、辣根过氧化物酶标记的二抗为北京中杉生物技术有限公司产品;SIRT1一抗购自Abcam公司。HRP增强型化学发光底物SuperSignal West Pico购自Thermo Scientific公司。
1.2 方法
1.2.1 siRNA SIRT1转染条件的优化 分别用终浓度为15、30及45 nmol/L的siRNA SIRT1转染30% ~50%汇合的HeLa细胞,同时设阴性对照组(转染通用无义序列siRNA)及正常细胞对照组,于转染后72 h倒置相差显微镜下观察细胞形态,收集细胞,提取细胞总RNA进行RT-PCR检测。
1.2.2 RT-PCR检测SIRT1 mRNA 于转染后72 h收集各组细胞,Trizol法提取细胞总RNA,应用RT-PCR检测SIRT1 mRNA表达水平。SIRT1 PCR反应条件:预变性94℃、10 min,变性 94℃、1 min,退火47 ℃、1 min,延伸72 ℃、1 min,30 个循环后,延伸72℃、10 min。内参照hGAPDH PCR反应条件:预变性94℃、10 min,变性94℃、30 s,退火55 ℃、30 s,延伸72 ℃、1 min,30个循环后,延伸72℃、10 min。扩增产物行1.5%琼脂糖凝胶电泳。凝胶成像系统对目的条带进行扫描,Image J软件进行灰度分析,计算SIRT1灰度值与hGAPDH灰度值之比,即SIRT1 mRNA的相对表达量。每组实验重复3次。SIRT1及hGAPDH引物序列见表1。

表1 PCR引物序列Table 1 Sequence of PCR primers
1.2.3 Western blot检测 SIRT1 及凋亡相关蛋白转染72 h后收集各组细胞并加入WIP组织细胞裂解液提取细胞蛋白,BCA法检测蛋白浓度,常规进行Western blot检测,一抗稀释比例为1∶(300~3000),二抗稀释比例为1∶5000,化学发光法显色。Image J软件进行灰度分析,将目的基因与内参β-actin条带的灰度值比值作为目的基因的相对表达量。每组实验重复3次。
1.2.4 CCK-8法检测细胞增殖 HeLa细胞接种于96孔板,每孔3×103个细胞,倒置相差显微镜观察细胞至30% ~50%汇合,以终浓度30 nmol siRNA SIRT1转染HeLa细胞。转染后72 h,每孔加10 μL CCK-8溶液,继续孵育2 h,酶标仪测450 nm处吸光度值。细胞增殖抑制率(%)=(正常组A值-实验组A值)/正常组A值×100%。
1.2.5 Hoechst33258核染色 取 siRNA转染后72 h的HeLa细胞,常规进行Hoechst33258染色,荧光显微镜下观察细胞形态。
1.2.6 Annexin-Ⅴ检测细胞凋亡 收集转染后72 h各组细胞,调整细胞密度至(2~5)×105/mL,于Ep管中依次加入100 μL单细胞悬液及100 μL Guava Nexin Reagent(含有 Annexin V-PE和7-ADD的缓冲液)混匀避光,室温孵育20 min,流式细胞仪上样分析细胞凋亡率。
1.2.7 统计学分析 采用 SPSS 13.0统计软件进行统计学处理,实验数据以均数±标准差(¯χ±s)表示,采用单因素方差分析 RT-PCR、Western blot结果,以检验水准 α =0.05,P <0.05 为差异有统计学意义。
2 结果与分析
2.1 siRNA SIRT1转染条件的优化
倒置相差显微镜观察结果显示,与正常HeLa细胞组比较,不同剂量 siRNA SIRT1(15、30、45 nmol/L)转染细胞72 h后,均可见大量脱落变圆的细胞。RT-PCR结果显示,与正常HeLa细胞组相比,各转染组细胞中SIRT1 mRNA的表达水平均明显下降,其中以30 nmol/L的siRNA作用最为明显,因此,后续实验选用30 nmol/L作为siRNA的转染浓度(图1)。
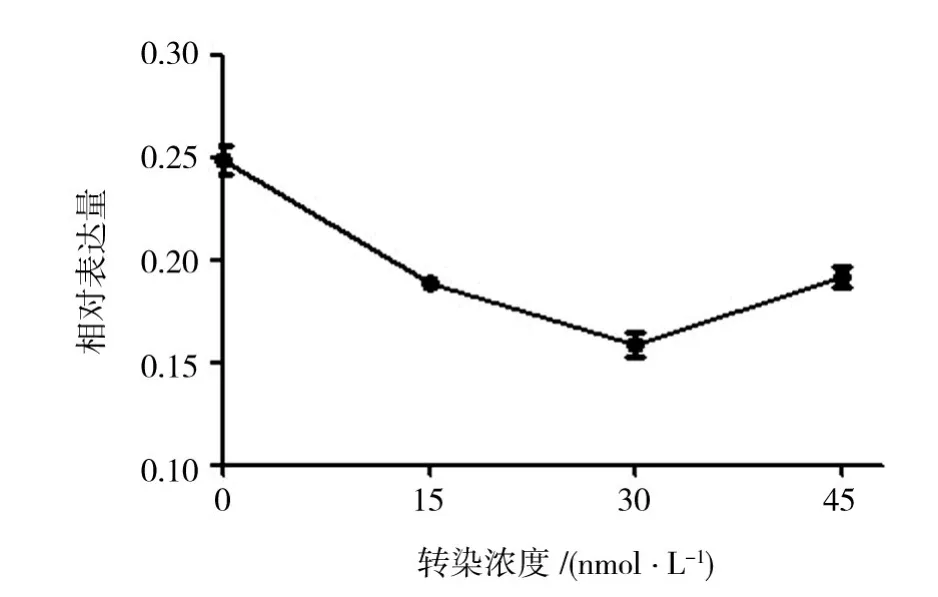
图1 不同剂量siRNA SIRT1对HeLa细胞SIRT1 mRNA的影响Fig.1 Effect of various concentration of siRNA on SIRT1 mRNA expression
2.2 RT-PCR检测结果
RT-PCR检测结果表明,与正常HeLa细胞组相比,siRNA SIRT1转染组细胞中SIRT1 mRNA水平明显下降,差异有显著性(图2,P <0.05),而阴性siRNA转染组、转染试剂对照组细胞SIRT1 mRNA水平无显著性差异(P>0.05)。
2.3 Western blot检测结果
Western blot检测结果表明,与正常组相比,siRNA SIRT1转染组细胞SIRT1、Survivin蛋白表达水平明显下调(P<0.01),P53、P21蛋白表达水平明显上调(P<0.01);阴性 siRNA转染组SIRT1、P53、P21、Survivin 蛋白表达水平的变化无显著性(P>0.05);转染试剂对照组SIRT1、P21蛋白表达水平的变化无显著性(P>0.05),但Survivin蛋白相对表达量降低(P<0.05,图3)。

图2 RNA干扰对SIRT1 mRNA的表达影响Fig.2 Effect of RNA interference on the expression of SIRT1 mRNA
2.4 细胞增殖检测结果
CCK-8结果显示,siRNA SIRT1转染HeLa细胞72 h后,对HeLa细胞的增殖有明显的抑制作用,siRNA SIRT1转染组抑制率为39%,明显高于其他3组(图4),表明siRNA SIRT1可抑制HeLa细胞增殖。
2.5 Hoechst33258 核染色
荧光显微镜下显示,正常对照组、阴性siRNA转染组及转染试剂对照组细胞的细胞核呈均匀淡蓝色,而siRNA SIRT1转染组细胞出现凋亡形态学改变,细胞核染色质高度浓缩,可观察到亮蓝色细胞核(图5)。
2.6 AnnexinⅤ-PE检测细胞凋亡
结果显示,正常组凋亡率为3%,阴性siRNA转染组凋亡率为3.9%,转染试剂对照组凋亡率为3.3%,siRNA SIRT1转染组凋亡率为15.9%。siRNA SIRT1转染组细胞凋亡率明显高于其他3组,表明siRNA SIRT1可诱导HeLa细胞凋亡(P<0.05,图 6)。
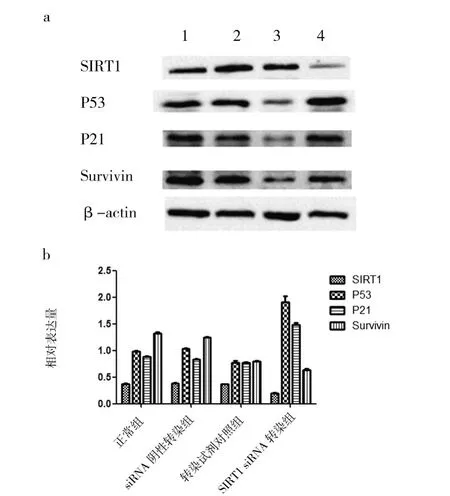
图3 RNA干扰对SIRT1及凋亡相关蛋白表达的影响Fig.3 Effect of RNA interference on the expression of SIRT1 and apoptosis related protein
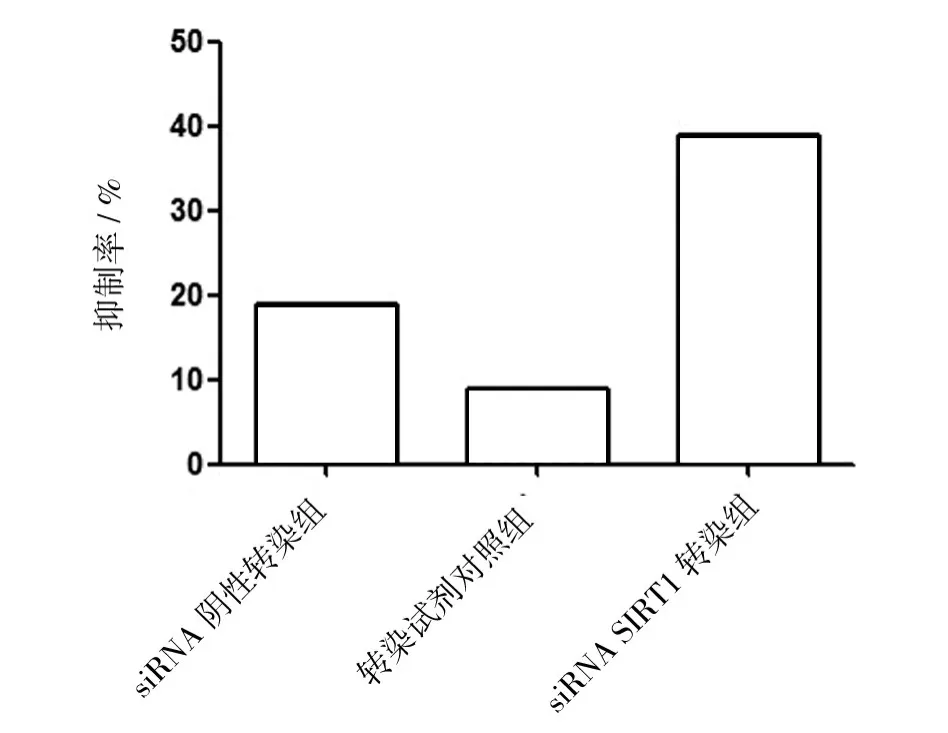
图4 RNA干扰对HeLa细胞增殖的影响Fig.4 Effect of RNA interference on HeLa cell proliferation

图5 HeLa细胞的Hoechst33258染色(200×)Fig.5 Hoechst33258 stain of HeLa cells(200 × )
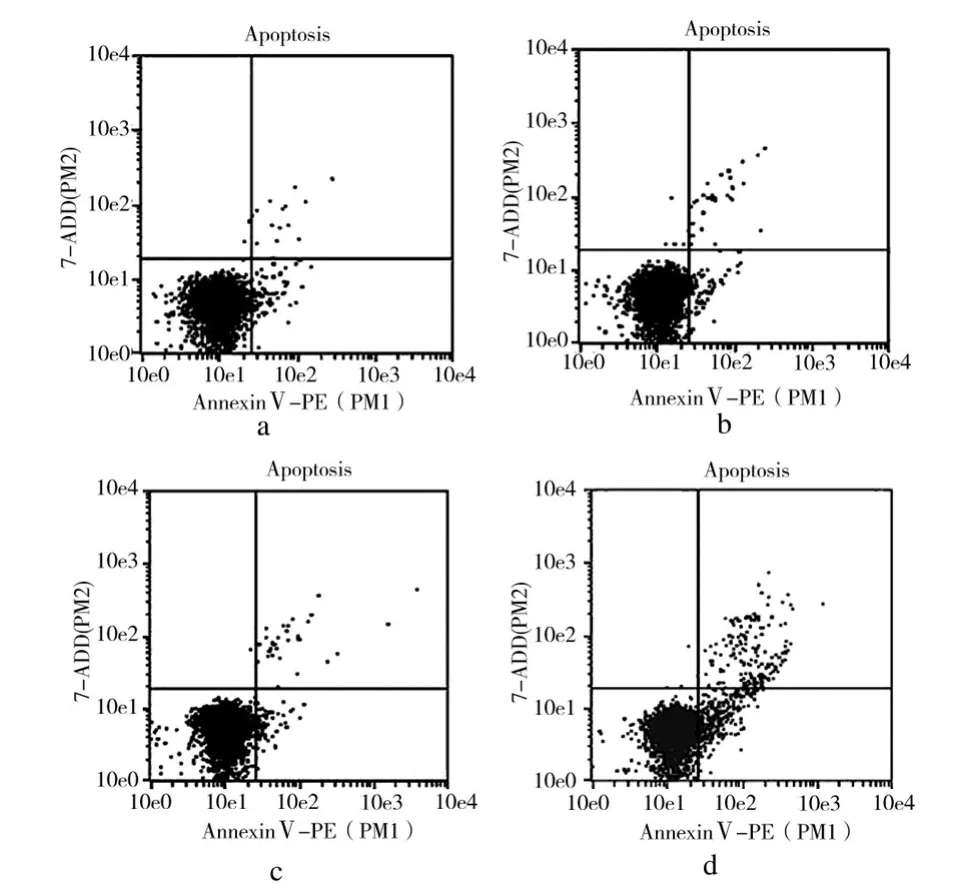
图6 AnnexinⅤ-PE检测HeLa细胞凋亡Fig.6 AnnexinⅤ-PE analysis of apoptosis in HeLa cells
3 讨论
乙酰化/去乙酰化是一种重要的组蛋白修饰方式,由组蛋白乙酰化酶(histone acetylase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)催化完成[5]。SIRT1属于Ⅲ类组蛋白去乙酰化酶家族成员,SIRT1不仅去乙酰化修饰多种组蛋白,还可以去乙酰化作用多种非组蛋白,包括转录因子P53,叉头蛋白盒转录因子 FOXO,核因子-κB(nuclear factor κB,NF-κB)等,进而影响与肿瘤细胞增殖及凋亡密切相关的多种蛋白活性[6]。研究表明SIRT1在肿瘤中呈异质性表达,随肿瘤类型的不同 SIRT1的表达水平不一致[6-7],因此,将SIRT1归为癌基因还是抑癌基因仍存在争议。大多数文献报道SIRT1在贲门癌、急性髓性白血病、人前列腺癌、原发性结肠癌、乳腺癌等肿瘤组织中持续高表达,且具有钝化抑癌基因和DNA损伤修复蛋白的作用,被认为是肿瘤促进因子[1,6-7]。但也有研究报道在某些特定的情况下,SIRT1起到抑癌因子的作用,Firestein等研究证实,将SIRT1转入APCmin/+小鼠结肠癌中,SIRT1可抑制肿瘤的形成和生长[8]。进一步研究证明,SIRT1通过去乙酰化作用抑制癌基因β-catenin、NF-κB的转录和癌蛋白活性,从而起到肿瘤抑制因子的作用。
目前关于SIRT1与宫颈癌的相关性研究鲜见文献报道。有学者报道沉默宫颈癌细胞株SiHa中HPV E7蛋白,可下调SIRT1蛋白的表达;在原代人角质形成细胞中过表达HPV E7蛋白,可上调SIRT1蛋白及其磷酸化的表达,提示SIRT1可能参与了HPV致宫颈癌发生发展的过程[9],但SIRT1在宫颈癌中的作用及详尽机制尚不清楚。
本实验参照文献[10]设计针对SIRT1基因的siRNA,转染HeLa细胞,结果表明siRNA SIRT1能明显下调SIRT1的表达,抑制HeLa细胞增殖并诱导细胞凋亡。在此基础上,本研究进一步检测了凋亡相关蛋白P53、P21及Survivin的表达,结果表明P53、P21表达上调,Survivin表达下调,提示siRNA SIRT1诱导的细胞凋亡与P53通路密切相关。P53为肿瘤抑制因子,在DNA损伤、紫外线、化学药物刺激、异常细胞生长时可在细胞核内聚集,通过调控P21、Bax、Survivin等下游蛋白的活性,抑制细胞分裂和促进细胞凋亡[11-12]。其中P21蛋白不仅能够与cyclin/cdk形成复合物使细胞周期停滞在G1期,而且还可以通过C端与增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)相互作用,阻断PCNA活化DNA聚合酶的活性从而抑制DNA的合成,使细胞周期停滞[13];而Survivin为凋亡抑制蛋白家族成员,可直接或通过P21间接作用于Caspase和周期蛋白激酶,阻断凋亡信号转导通路,抑制各种刺激诱导的细胞凋亡过程,P53通过对Survivin启动子的调控,发挥其负向调节作用[14]。因此,推测沉默SIRT1基因诱导的HeLa细胞凋亡与P53、P21及Survivin通路关系密切,但是由于SIRT1作用底物较多,底物间相互作用机制复杂,siRNA SIRT1诱导的细胞凋亡的详尽机制尚有待进一步探索。
[1]Brooks CL,Gu W.How does SIRT1 affect metabolism,senescence and cancer?[J].Nat Rev Cancer,2009,9(2):123-128.
[2]曹琼,黄朝凤,金戈.SIRTl表达与结肠癌细胞多药耐药性的关系[J].中国老年学杂志,2012,32(2):339-340.
[3]Pauley KM,Cha S.RNAi Therapeutics in Autoimmune Disease[J].Pharmaceuticals,2013,6(3):287-294.
[4]范守城,张云茹.RNAi技术研究进展及其在医学中的应用前景[J].微生物学杂志,2009,29(4):93-98.
[5]Kouzarides T.Chromatin modifications and their function[J].Cell,2007,128(4):693-705.
[6]Deng CX.SIRT1,is it a tumor promoter or tumor suppressor[J].Int J Biol Sci,2009,5(2):147-152.
[7]Li K,Luo J.The role of SIRT1 in tumorigenesis[J].N Am J Med Sci,2011,4(2):104-106.
[8]Firestein R,Blander G,Michan S,et al.The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth[J].Plos one,2008,3(4):e2020.
[9]Allison SJ,Jiang M,Milner J.Oncogenic viral protein HPV E7 up-regulates the SIRT1 longevity protein in human cervical cancer cells[J].Aging,2009,1(3):316-327.
[10]Ford J,Jiang M,Milner JO.Cancer-specific functions of SIRT1 enable human epithelial cancer cell growth and survival[J].Cancer Res,2005,65(22):10457-10463.
[11]Han MK,Song EK,Guo Y,et al.SIRT1 regulates apoptosis and Nanog expression in mouse embryonic stem cells by controlling p53 subcellular localization[J].Cell Stem Cell,2008,2(3):241-251.
[12]Geng Y,Walls KC,Ghosh AP,et al.Cytoplasmic p53 and activated Bax regulate p53-dependent,transcription-independent neural precursor cell apoptosis[J].J Histochem Cytochem,2010,58(3):265-275.
[13]Gillis LD,Leidal AM,Hill R,et al.p21Cip1/WAF1 mediates cyclin B1 degradation in response to DNA damage[J].Cell Cycle,2009,8(2):253-256.
[14]Guha M,Altieri DC.Survivin as a global target of intrinsic tumor suppression networks[J].Cell Cycle,2009,8(17):2708-2710.

