具有海带褐藻胶降解能力的刺参有益菌筛选及降解条件优化
王熙涛, 徐永平, 金礼吉, 李淑英, 尤建嵩, 汪 将, 李建光, 张美霞, 宋亚雄
(1.大连理工大学动物生物技术与营养研究室,辽宁大连 116024;2.大连赛姆生物工程技术有限公司,辽宁大连 116620;3.动物性食品安全保障技术工程研究中心,辽宁大连 116024)
鼠尾藻、马尾藻、海带等海藻是刺参饲料中最常见的饲料原料,其中鼠尾藻被认为是刺参的最佳优质饵料,但是随着鼠尾藻资源的大量开采,现已面临供不应求,价格居高不下的困境。而海带由于其成本低廉、产量高、营养丰富等优点也经常用作刺参饲料原料(尚德荣等,2011)。但是由于海带细胞壁褐藻胶含量较高限制了其作为刺参优质饵料的使用。刺参体内褐藻酸酶活性处于很低的水平,因此对海带等富含褐藻胶的大型藻类消化能力较弱,大多数饲料成分不能被充分消化,这不仅造成饲料的浪费,而且水体里含有大量黏性较高的褐藻胶等残饵,如果处理不当也会导致刺参养殖环境的恶化(郭娜等,2011;唐黎等,2007)。
针对以上问题,本研究筛选出一株能高效降解海带中褐藻胶且对刺参无潜在危害的有益菌,并探讨了其降解海带褐藻胶的最佳发酵条件,以期能有效降解海带饲料中刺参难以消化的褐藻胶成分,从而显著提高刺参对海带的消化率、利用率;并为进一步生产刺参微生物脱胶海带发酵饲料提供初步理论基础。
1 材料与方法
1.1 试验动物 健康刺参,购自广鹿岛某海参养殖场,体重5~10 g不等,沙滤海水中暂养2周,不投喂食物,水质因子为溶氧≥6 mg/L,温度控制在(18±1)℃,盐度为 28‰ ~ 30‰,pH 为 8.0±0.4,每天更换1/3总体积的水以保证水质,并吸底排污一次至刺参不再排便为止。
1.2 试验方法
1.2.1 菌种筛选培养基及降解褐藻胶的发酵液组成 褐藻酸钠固体选择性培养基(%,m/V):褐藻酸钠 0.5 g, 硫酸铵 0.5 g,NaCl 3.0 g,K2HPO40.2 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.001 g, 琼脂1.5 g,蒸馏水 100 mL,pH 7.5;褐藻酸钠液体选择性培养基(%,m/V):褐藻酸钠 0.5 g,硫酸铵 0.5 g,NaCl 3.0 g,K2HPO40.2 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.001 g,蒸馏水 100 mL,pH 7.5;降解褐藻胶的发酵液组成:200 mL摇瓶中含有海带粉20 g,K2HPO40.2 g,MgSO4·7H2O 0.1 g,FeSO4·7H2O 0.001 g,另补充一定浓度褐藻酸钠、氮源、氯化钠;种子培养基各成分同褐藻酸钠液体选择性培养基。
1.2.2 菌种的分离筛选 采用以褐藻酸钠为唯一碳源的选择性培养基进行筛选,经菌种活化、平皿粗筛、摇瓶复筛、挑取平皿中长势良好的单菌落、驯化及菌保等步骤,获得能降解褐藻胶的菌株W16。
1.2.3 菌株对刺参的安全性试验 菌种接种于2216E液体培养基中,置28℃、130 r/min下培养12 h后,离心菌液,倒去上清,用灭菌海水重悬制成菌悬液,调整浓度到5×109cfu/mL。取健康刺参40只,分为两组,分别为菌悬液组和灭菌海水对照组。每只刺参一次腹腔注射100 μL菌液,连续注射3 d,对照组每个刺参注射100 μL无菌海水,每日观察两次,记录各组刺参生存状态,发病率。15 d后,统计结果。
1.2.4 菌株的鉴定
1.2.4.1 16S rDNA基因的PCR扩增 按照标准方法 (Wilson,1997)提取菌株 W16的基因组DNA。使用 Smart Taq Pre-Mix试剂盒扩增16S rDNA,PCR扩增通用引物 (Martin和 Collen,1998):27F (5'AGAGTTTGATCCTGGCTCAG3');1429R(5'GGTTACCTTGTTACGACTT3')。
PCR 反应体系(50 μL):DNA 2 μL,正向引物27F(10 pmol/μL)1 μL,反向引物 1492R(10 pmol/μL)1 μL,rTaq DNA 聚合酶 (包含 PCR 反应缓冲液,dNTP 混合物)25 μL,ddH2O 21 μL。
PCR反应条件:94℃预变性5 min;94℃变性30 s,55℃复性 30 s, 共 35个循环;72℃延伸 90 s,72℃延伸 10 min;4℃保存。
1.2.4.2 16SrDNA基因测序及菌种鉴定 所得PCR结果寄送大连万泽贸易有限公司测序。测序结果使用NCBI的Blast软件与GenBank数据库中的已知种类的微生物的16S rDNA基因序列进行比对,得到相似度,并绘制系统发育树。
1.2.5 海带褐藻胶相对降解量的测定 海带褐藻胶相对降解量采用紫外吸收法测定,褐藻胶降解产物褐藻寡糖在235 nm处有特征光吸收值。此处的光吸收值的大小可作为褐藻胶相对降解程度的评判(Baron 等,1994)。
1.2.6 生物量的测定 取菌悬液200 μL,于600 nm处测定吸光值,以未加菌液的发酵液作空白对照。发酵液中有海带粉时,用滤纸过滤除去海带粉末,再按1.2.5中的方法测吸光值。
1.2.7 海带褐藻胶降解条件优化 海带褐藻胶降解能力和生物量测定方法如上所述,每组试验重复两次,每次试验三组平行,每一步优化结果都用于后续试验。
1.2.7.1 发酵时间对菌株生长和褐藻胶降解量的影响 每隔24 h取一次样品,研究不同发酵时间 :24、48、72、96、120、144 h对发酵培养菌株W16生长和褐藻胶降解程度的影响。
1.2.7.2 发酵温度对菌株生长和褐藻胶降解量的影响 在以上条件的基础上,分别在15、20、25、30、35℃下对菌株W16进行摇瓶发酵培养,研究不同温度对菌株生长和褐藻胶降解程度的影响。
1.2.7.3 诱导物褐藻酸钠添加量对菌株生长和产酶的影响 以褐藻酸钠作为产褐藻胶裂解酶的诱导物,在发酵培养基中添加不同含量的褐藻酸钠(m/V):0.05%、0.1%、0.15%、0.2%、0.25%、0.3%,分别对菌株W16进行发酵培养,测定生物量和褐藻胶降解量。
1.2.7.4 补充氮源对菌株生长和褐藻胶降解程度的影响 分别以 0.3%(NH4)2SO4、0.3%牛肉膏、0.3%NH4Cl、0.3%蛋白胨、0.3%尿素(m/V)为补充氮源加入发酵液中,研究不同补充氮源对菌株生长和褐藻胶降解量的影响。
1.2.7.5 氯化钠浓度对菌株生长和产酶的影响配制含不同浓度 NaCl(1%、1.5%、2%、2.5%、3%和3.5%)的液体发酵培养基,分别对菌株W16进行发酵培养,研究不同NaCl浓度对菌株生长和褐藻胶降解量的影响。
1.2.7.6 起始pH对菌株生长和产酶的影响 分别调节发酵培养基初始 pH 为 6.5、7.0、7.5、8.0、8.5,对菌株W16进行发酵培养,研究不同pH对菌株生长和褐藻胶降解量的影响。
1.2.7.7 装液量对菌株生长和产酶的影响 选择料液比为1∶30,在200 mL三角瓶中,分别装入20、40、60、80、100、120 mL 的发酵培养基,灭菌后分别按1%体积加入种子液,研究不同装液量对菌株生长和褐藻胶降解量的影响。
1.2.7.8 正交试验设计 对上述单因素试验中的7个因素进行考察,选取其中对菌株W16生长和褐藻胶降解量影响较大的4个因素设计正交试验,综合考察各因素对菌株生长和褐藻胶降解量的影响,每个因素选取3个水平。
2 结果与讨论
2.1 菌株W16对刺参安全性试验结果 5×109cfu/mL菌悬液连续给刺参腹腔注射3 d,经过15 d观察后,试验组刺参和空白对照组刺参均在养殖箱中贴壁生长,状态良好,未出现腐皮、溃烂或摇头等不良反应,表明高浓度W16对刺参的生长无任何致病作用。
2.2 16S rDNA分析结果 对菌株W16的16S rDNA基因序列测定结果表明,该菌的16S基因组大小为1421 Da。根据 BLAST软件在线分析,与该序列相似度大于 95%的序列均来自Bacillus属细菌,该序列与Bacillus flexus strain NM25序列的相似度最高,最大匹配度达到100%。因此,该菌株被鉴定为Bacillus flexus。Bacillus属系统进化树见图1。Bacillus flexus菌种特征为:杆状,G+,形成卵圆形内生芽孢,好氧。可耐1%~10%NaCl浓度。葡萄糖、半乳糖、蔗糖产酸;乳糖、阿拉伯糖、甘露醇、麦芽糖、棉子糖、海藻糖不产酸。接触酶、氧化酶阳性。

图1 根据16S rDNA基因序列构建的W16与其亲源关系较近的Bacillus代表菌株的系统进化树
本试验筛选得到一株芽孢杆菌,能降解海带中褐藻胶且对刺参无致病性,16S rDNA鉴定及系统发育树的构建表明,该菌株与芽孢杆菌Bacillus flexus有较高的同源性。虽然在养殖过程中,很多类型的芽孢杆菌都可作为益生菌加入到饲料中使用,但是从实际生产的安全性考虑,本试验考察了该菌株对刺参是否具有潜在致病性,结果表明在浓度达到109cfu/mL时,该菌株仍然对刺参无任何致病性,因此可作为刺参的有益菌使用。
2.3 发酵液组成和发酵条件对试验菌株生长和降解褐藻胶能力的影响
2.3.1 发酵时间对菌株生长和降解褐藻胶能力的影响 由图2可见,在发酵的最初48 h,菌体生长快,生物量达到最大,但是相对褐藻胶降解量保持较低水平,并缓慢上升。这可能是因为W16不是专一性降解褐藻胶的菌种,在发酵过程中,菌株W16优先利用了发酵液中其他营养成分,生长旺盛后再逐步利用海带中褐藻胶,至96 h褐藻胶降解量达到最大值;当继续培养时,菌体逐渐进入衰亡期,相对褐藻胶降解量逐渐下降。因此后续试验选取96 h作为发酵培养时间。
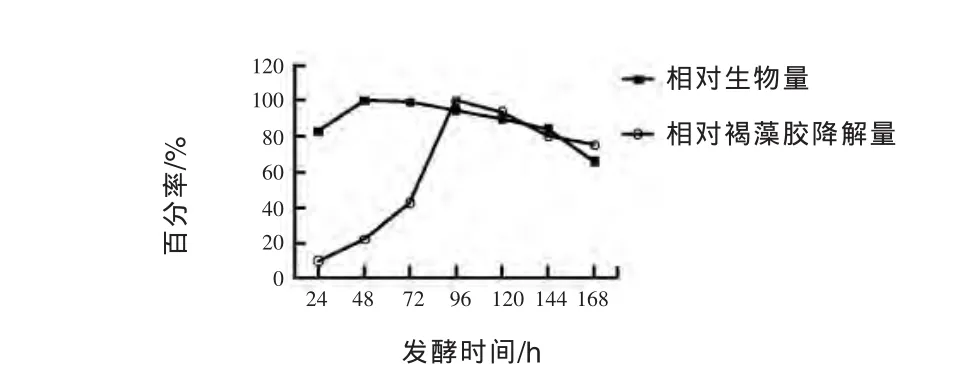
图2 发酵时间对W16菌株生长及褐藻胶降解量的影响
2.3.2 发酵温度对菌株生长和褐藻胶降解量的影响 由图3可见,菌体生长对试验温度相对不敏感,在试验温度范围内,菌种均生长良好,在25℃时生物量达到最大值。试验菌株降解褐藻胶的能力与发酵培养温度密切相关,在10℃时,菌株降解褐藻胶能力最低,随着温度的升高,菌株降解褐藻胶能力也随着增大。当超过30℃时菌株降解褐藻胶能力又再度下降,因此在30℃时菌株降解褐藻胶能力最强。因此选定培养温度为30℃做后续发酵试验。
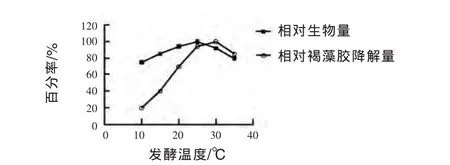
图3 发酵温度对菌株生长和褐藻胶降解量的影响
2.3.3 褐藻酸钠添加量对菌株生长和褐藻胶降解量的影响 本试验选择褐藻酸钠作为诱导剂,考察其添加量对菌株生长和褐藻胶降解量的影响。由图4可见,随着褐藻酸钠添加量的增加,菌种生物量变化相对不显著,但是褐藻胶降解量不断增大,当褐藻酸钠浓度达到0.15%时,菌株降解褐藻胶能力最强,随着褐藻酸钠添加量继续增加,菌种降解褐藻胶能力未明显增强,而是趋于稳定。因此,选定褐藻酸钠浓度为0.15%做后续发酵试验。

图4 褐藻酸钠添加量对菌株生长和褐藻胶降解量的影响
2.3.4 补充氮源对菌株生长和褐藻胶降解量的影响
2.3.4.1 不同氮源种类对试验菌株生长和褐藻胶降解量的影响 由图5可见,添加不同氮源均能促进W16菌株生长,但促进程度不同。有机氮源添加组的生物量均高于无机氮源添加组,可能是因为有机氮源中营养物质丰富,更有利于菌株生长,但是无机氮源组的褐藻胶降解量却高于有机氮源组,综合考虑生物量和褐藻胶降解量,选取二者都相对较高的硫酸铵做后续试验。
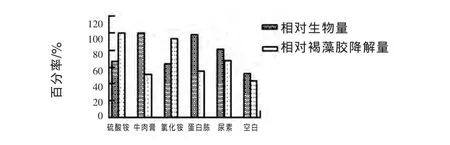
图5 不同氮源对菌株生长和褐藻胶降解量的影响
2.3.4.2 硫酸铵浓度对菌株生长和褐藻胶降解量的影响 由图6可见,随着硫酸铵浓度的增加,试验菌株的生长量和降解褐藻胶的能力表现出先上升后下降的趋势,在氮源浓度为0.3%时,测得的生物量和褐藻胶降解量均最高,故选定补充氮源硫酸铵浓度为0.3%做后续试验。
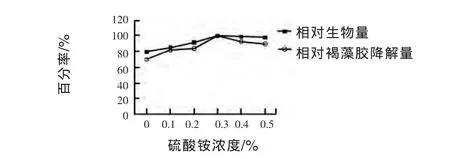
图6 硫酸铵浓度对菌株生长和相对褐藻胶降解量的影响
2.3.5 氯化钠浓度对菌株生长和褐藻胶降解量的影响 由图7可见,当氯化钠浓度在1.5%~3.5%,对菌株生物量影响不大,符合海洋细菌的嗜盐特点。但是,氯化钠浓度对菌株降解褐藻胶能力的影响较大,这与文献报道的褐藻胶裂解酶需要Na+、K+的激活相符(Ma 等,2008)。 随着 NaCl浓度增加,菌株W16产酶能力不断提高,当浓度大于2.5%后变化幅度趋于缓慢,故选择2.5%NaCl浓度发酵培养菌株W16。
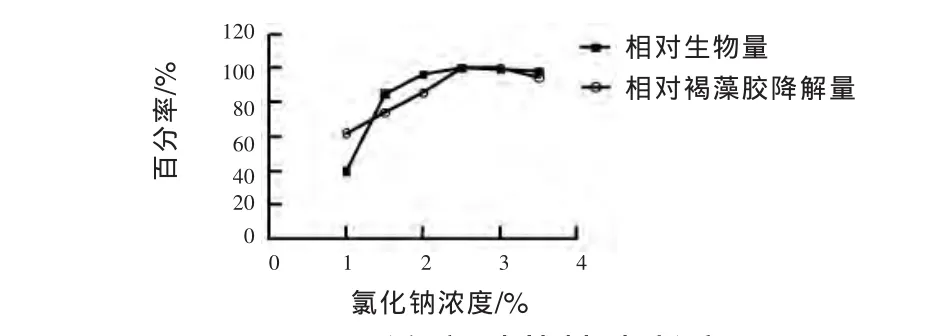
图7 NaCl浓度对菌株生长和褐藻胶降解量的影响
2.3.6 起始pH对菌株生长和褐藻胶降解量的影响 由图8可见,发酵培养液中起始pH对试验菌株生物量和降解褐藻胶能力均有一定影响,综合考虑,选取生物量和褐藻胶降解量均较高的pH=7的中性环境作为后续发酵培养条件。
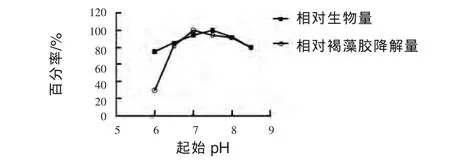
图8 起始pH对菌株生长和褐藻胶降解量影响
2.3.7 装液量对菌株生长和褐藻胶降解量的影响 由图9可见,装液量的大小主要影响发酵过程中的通气及溶氧情况,溶氧水平低,即装液量太大,不利于菌株生长和产酶。当装液量为50 mL时,生物量和褐藻胶降解量均达到最大值,因此选取40 mL装液量最为适宜。
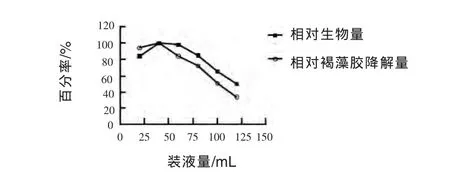
图9 装液量对菌株生长和褐藻胶降解量的影响
2.3.8 正交试验优化发酵条件 采用正交试验对培养条件进行优化。综合考虑选取对褐藻胶降解能力有较大影响的4个因素,即:发酵时间、发酵起始pH、发酵温度和褐藻酸钠浓度,按照四因素三水平L9(34)安排正交试验。发酵时间为A1=72 h,A2=96 h,A3=120 h;发酵起始 pH 为 B1=6.5,B2=7,B3=7.5;发酵培养温度为 C1=25℃,C2=30 ℃,C3=35℃;发酵培养基中褐藻酸钠浓度(m/V)为D1=0.1%,D2=0.15%,D3=0.2%。其他条件为氯化钠浓度2.5%,硫酸铵浓度0.3%,装液量40 mL(料液比=1∶30),160 r/min 振荡培养。
由表1可见,最佳褐藻胶降解条件为:A2B3C2D3。由极差分析可以看出,4个因素对菌株W16生长和产酶的影响由大到小次序为:A(发酵时间)>D(褐藻酸钠浓度)>B(发酵起始 pH)>C(发酵温度)。因此,A为影响菌株生长和褐藻胶降解能力的最主要因素,其次为诱导物褐藻酸钠浓度。菌株W16降解褐藻胶的最佳条件为:发酵时间96 h、发酵起始pH 7.5、发酵温度30℃、褐藻酸钠浓度0.2%。经正交试验优化后,其发酵液中褐藻胶相对降解量即OD235为0.531,比优化之前的OD235提升了3.29倍。
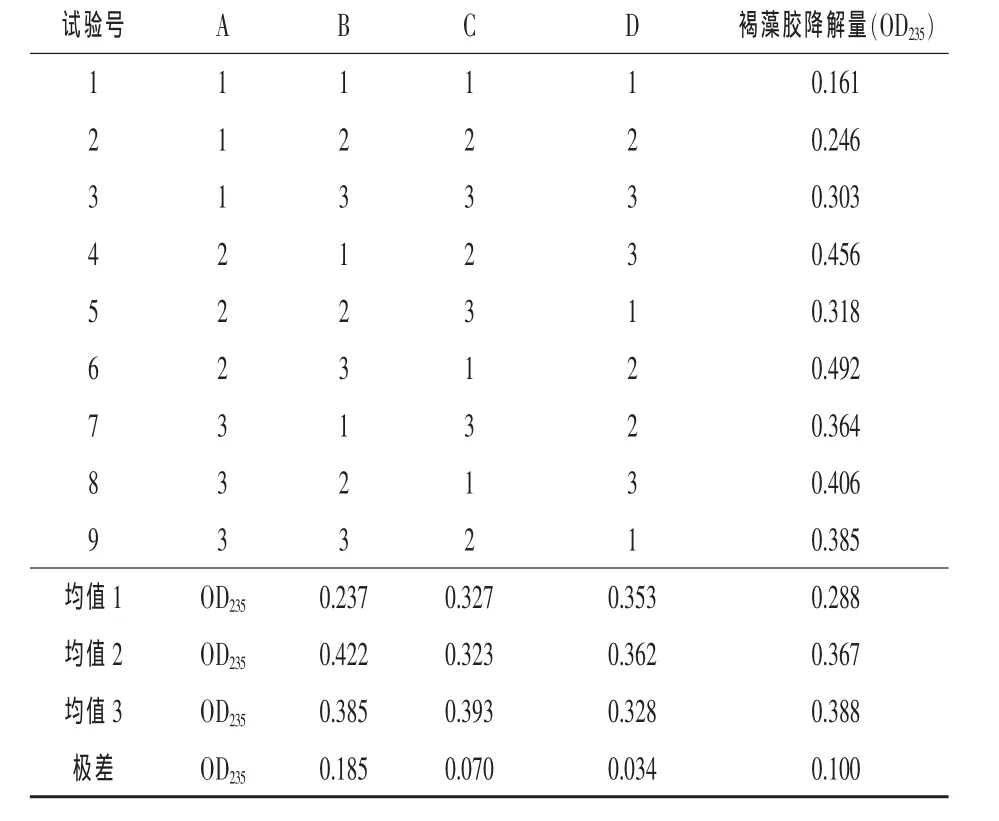
表1 正交试验结果
3 结论
本研究采用以褐藻酸钠为唯一碳源的选择性培养基,从海泥中筛选出一株能降解海带褐藻胶的菌株W16,经16SrDNA鉴定,该菌株与芽孢杆菌Bacillus flexus有较高的同源性。经安全性试验证明,此菌株浓度达到109cfu/mL时对刺参无致病性,可用其降解刺参海带饲料中的高黏度且不宜被刺参消化的褐藻胶。
为使菌株W16降解海带饲料中褐藻胶的能力达到最大,进行了发酵条件优化,在单因素试验基础上选取对褐藻胶降解量影响较大的4个因素进行了正交试验,得到菌株W16降解褐藻胶的最佳条件为:发酵时间96 h、发酵起始pH 7.5、发酵温度30℃、褐藻酸钠浓度0.2%,另添加0.3%的无机氮源硫酸铵、2.5%的氯化钠,装液量40 mL(200 mL摇瓶,20 g海带粉体系),摇床转速160 r/min,按1%(V/V)接种量接种。经正交试验优化后,其发酵液中褐藻胶相对降解量比优化之前提高了3.29倍。
[1]郭娜,董双林,刘慧.几种饲料原料对刺参幼参生长和体成分的影响[J].渔业科学进展,2011,32(1):123 ~ 128.
[2]尚德荣,宁劲松,赵艳芳,等.海带中褐藻胶含量测定方法的建立[J].食品科技,2011,36(8):252 ~ 254.
[3]唐黎,王吉桥,许重,等.不同发育期的幼体和不同规格刺参消化道中四种消化酶的活性[J].水产科学,2007,26(5):275 ~ 277.
[4]Baron A J,Wong T Y,Hicks S J,et al.Alginate lyase from Klebsiella pneumonia,subsp.aerogenes:gene cloning,sequence analysis and high-level production in Escherichia coli[J].Gene,1994,143:61 ~ 66.
[5]Ma LY,Chi Z M,Li J,et al.Overexpression of alginatelyase of Pseudoalt eromonas elyakovii in Escherichia coli,puri-fication,and characterization of the recombinant alginate lyase[J].World J Microbiol Biotechnol,2008,24:89 ~96.
[6]Martin F,Collen M.Bias in template-to-product ratios in multi-template PCR[J].Appl Microbiol Biotechnol,1998,64(10):3724 ~ 3730.
[7]Wilson K.Preparation of genomic DNA from bacteria[A].Current Protocols in Molecular Biology[C].1997.241~245.■

