AgY分子筛对燃料油中噻吩及苯并噻吩的吸附性能
张志刚,张振科,范俊刚,兰海叶,李文秀
(沈阳化工大学 辽宁省化工分离技术重点实验室,辽宁 沈阳110142)
采用传统的加氢脱硫技术虽然可以有效地脱除燃料油中的噻吩、苯并噻吩、二苯并噻吩及其烷基化衍生物,但同时会使油品的辛烷值大幅度下降。选择性吸附脱硫技术因具有净化度高、能耗低、易于操作、不改变油品性能等诸多优点,已成为一项备受关注的脱硫技术[1]。近年来,研究较多的汽油脱硫吸附剂主要有分子筛、金属氧化物、活性炭等。其中,Y型分子筛具有较好的选择性吸附脱硫效果,且经金属离子改性后能提高其脱硫性能及选择性。
目前,已有关于一些污染物在不同吸附剂上的吸附平衡和动力学研究报道。例如,改性玉米芯吸附溶液中U(VI)的动力学和热力学[2];不同酚类化合物在粉煤灰上的吸附动力学模型[3];间甲酚在活化的水稻壳上的吸附平衡、动力学和热力学[4]。然而,硫化物在AgY分子筛上的吸附平衡、动力学和数学模拟研究甚少。笔者采用固相离子交换法制备了AgY分子筛吸附剂,并对其从模拟油中脱除噻吩和苯并噻吩的吸附平衡和动力学进行研究,以期促进燃料油分子筛吸附法深度脱硫技术的发展。
1 实验方法
1.1 原料
NH4Y分子筛,天津南开大学催化剂厂产品;硝酸银,分析纯,上海三爱思试剂有限公司产品;噻吩、苯并噻吩、正庚烷,分析纯,国药集团化学试剂有限公司产品。
1.2 吸附剂的制备
取10g NH4Y分子筛置于真空管式炉中,在空气气氛下以3℃/min升温至500℃并保持5h,然后冷却至室温,得到HY分子筛。将硝酸银与HY分子筛按0.3质量比混合,充分研磨混匀后,置于真空管式炉中,在N2保护下以2℃/min升温至600℃并保持6h,然后冷却至室温,即得理论金属交换量为51%的AgY分子筛吸附剂。
1.3 吸附剂的表征
采用布鲁克公司D8ADVANCE型X射线衍射仪分析吸附剂的晶相结构,CuKα射线,2θ扫描范围为3°~50°。采用彼奥德科技有限公司SSA-4300型孔隙比表面分析仪测定吸附剂的比表面积及孔体积。
1.4 吸附平衡和动力学实验
在平衡吸附之前先进行动力学实验,以确定达到吸附平衡时所需的时间。准确量取10mL硫质量分数为298μg/g的噻吩-正庚烷溶液和297μg/g的苯并噻吩-正庚烷溶液于一系列样品瓶中,分别加入不同质量(0.02~0.15g)的吸附剂,密封,置于快速混匀器上,25℃下充分混匀12h,以确保达到吸附平衡。用安捷伦科技有限公司7890A型气相色谱仪(PFPD检测器)测定达到平衡时硫化物的质量浓度,按式(1)计算平衡吸附硫容qe。
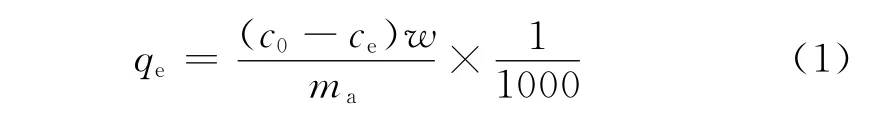
为了研究吸附时间对吸附的影响,根据吸附等温线确定剂/油比,然后将一定质量的吸附剂加入到10mL模拟汽油中,密封后保持25℃下快速混匀。每隔一段时间,从系统中取样分析测定,确定噻吩类化合物浓度与时间的函数关系。单位质量吸附剂在某一时刻t的吸附量qt按式(2)计算。
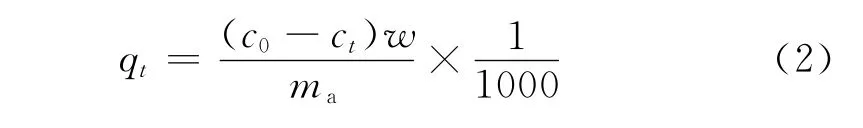
2 结果与讨论
2.1 AgY分子筛吸附剂的表征结果
2.1.1 XRD分析
图1为HY和AgY分子筛的XRD谱。由图1可知,HY分子筛具有典型的八面沸石晶体结构。经固相离子交换后,得到的AgY分子筛的代表八面沸石晶体结构的主要特征衍射峰的位置未变,但其强度有所减弱,前者表明负载Ag后Y分子筛保留了原有的晶体结构,后者主要是由于进入分子筛笼中与H+交换的Ag对X射线的吸收系数较高所致[5]。
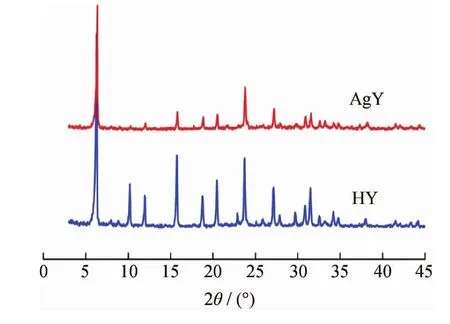
图1 HY和AgY的XRD谱Fig.1 XRD patterns of HY and AgY
2.1.2 BET分析
图2为HY和AgY分子筛的N2吸附-脱附等温线,由其计算得到的HY和AgY分子筛的比表面积及孔体积列于表1。由图2可知,AgY分子筛的N2吸附-脱附等温线为IV型等温线,在p/p0>0.4时,吸附-脱附等温线出现了滞后环,表明有间隙孔存在,吸附容量显著减小。由表1可知,与HY分子筛相比,AgY分子筛的比表面积、孔体积和孔径均有所减小。这可能是Ag+进入分子筛笼内使其孔局部堵塞所致,也可能是在热处理Ag+交换的分子筛过程中,Ag+在分子筛骨架内可以很容易地被还原成Ag0,后者聚集在孔道内,从而减小了分子筛有效笼自由空间[6]。
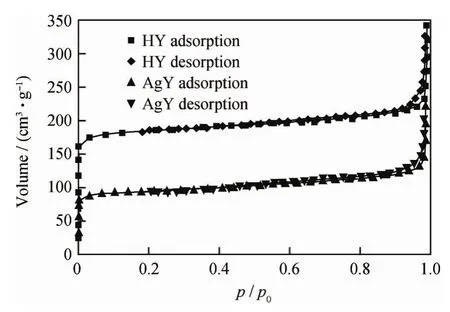
图2 HY和AgY的N2吸附-脱附等温线Fig.2 N2adsorption-desorption isotherms of HY and AgY

表1 HY和AgY的比表面积及孔体积Table 1 Specific surface areas and pore volumes of HY and AgY
2.2 HY和AgY的吸附脱硫性能
以10mL模拟油加0.1g吸附剂的比例,将模拟油与吸附剂混合,进行吸附脱硫实验,考察HY和AgY分子筛对噻吩(T)及苯并噻吩(BT)的吸附脱硫效果,脱硫率η按式(3)计算。

HY分子筛对T及BT的脱硫率分别为38.3%和42.1%,AgY分子筛对T及BT的脱硫率分别为83.3%和91.6%,说明负载Ag+之后,分子筛的吸附脱硫效果明显增强。结合表1可以得出,AgY分子筛吸附性能增强与其孔结构无关,而与其负载的Ag+有关。
2.3 吸附时间对AgY吸附脱硫性能的影响
AgY分子筛吸附模拟油中T和BT时,模拟油硫质量分数随吸附时间的变化如图3所示。由图3可知,AgY分子筛对T的吸附速率较快,吸附1h后模拟油硫质量分数降至15.95μg/g,6h达到吸附平衡;AgY分子筛对BT的吸附速率较慢,吸附2h后模拟油硫质量分数降至29.67μg/g,10h后达到吸附平衡。根据分子模型得到T和BT的分子尺寸分别为0.55nm×0.41nm×0.20nm和0.78nm×0.59nm×0.20nm[7],制备的 AgY 分子筛的平均孔半径为0.85nm。可见BT的分子尺寸比T大,其通过分子筛微孔时所受空间位阻效应影响较大,因此BT达到吸附平衡时间较长。
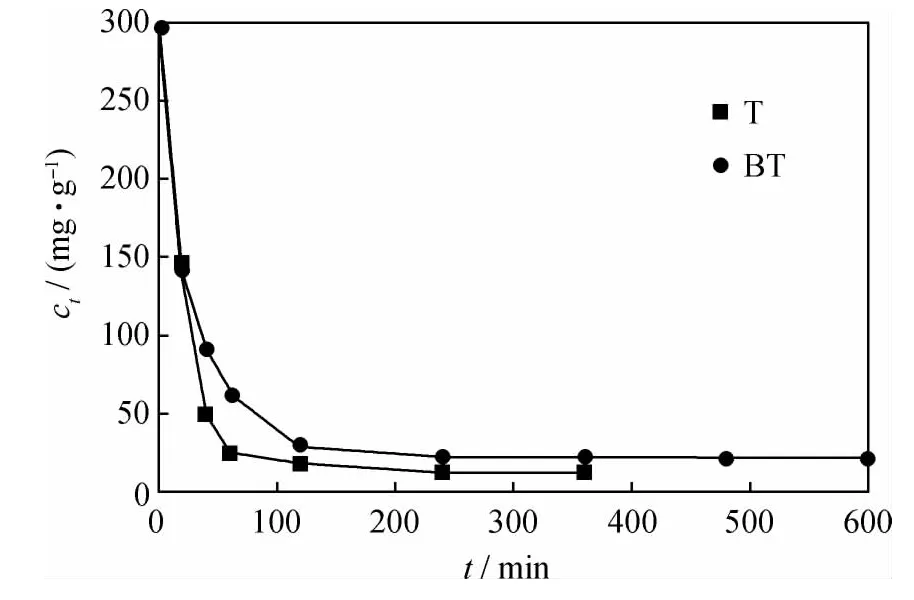
图3 AgY吸附T和BT时模拟油硫质量分数(ct)随时间(t)的变化Fig.3 ctvs t during AgY adsorbing T and BT from model fuel
2.4 采用吸附模型拟合AgY分子筛吸附T和BT的吸附等温线
分别采用Freundlich、Langmuir和Toth吸附模型拟合AgY分子筛吸附T和BT的吸附等温线。3个吸附模型的表达式分别如式(4)、(5)和(6)所示[8-9]。
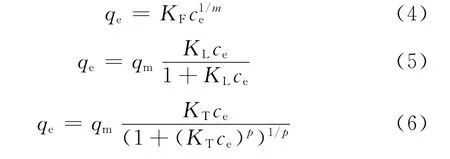
当p=1时,Toth模型与Langmuir模型相同。
图4为3种吸附模型对AgY分子筛对T和BT吸附的拟合曲线,拟合的参数值列于表2。由图4和表2可知,T和BT在AgY分子筛上的吸附等温线符合Toth和Langmuir模型。因此,可推测T和BT分子是呈单分子层被吸附在分子筛表面的吸附活性位上,而且T和BT分子与分子筛表面有很强的相互作用,而溶剂正庚烷没有强烈的竞争吸附能力,符合微孔吸附剂对有机物的吸附作用机制。由表2还可知,AgY分子筛吸附BT的KL值(0.1035)大于吸附 T的KL值(0.0402),说明其对BT的吸附能力强于对T的吸附能力。
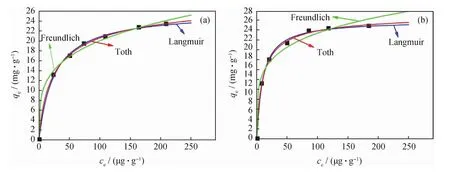
图4 3种吸附模型拟合的AgY吸附T和BT的吸附等温线Fig.4 Adsorption isotherms of T and BT on AgY simulated by three adsorption models
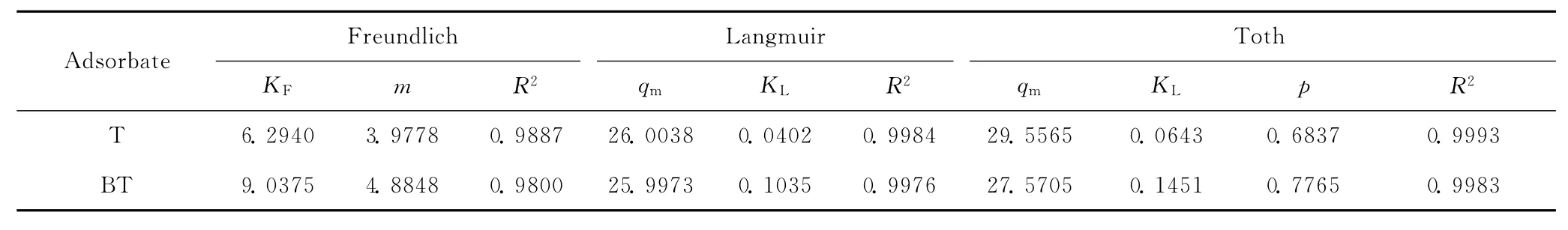
表2 3种吸附模型拟合AgY吸附T和BT的参数值Table 2 Parameters of T and BT adsorption on AgY simulated by three adsorption models
2.5 AgY分子筛对T和BT的吸附动力学
采用准n阶(PNO)和修正的准n阶(MPNO)动力学方程来描述固-液静态吸附的动力学行为。
PNO动力学模型作为一种分析吸附动力学的经验模型[10],其表达式为式(7)。根据初始条件t=0时qt=0,积分整理得到非线性方程式(8)。
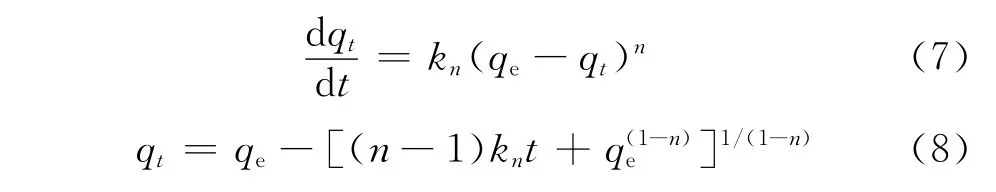
MPNO 动 力学方程[11]如式 (9)、(10)所 示。式(9)、(10)中的k'可由式(11)计算。根据初始条件t=0时qt=0,积分整理得到关于qt随吸附时间t变化的非线性方程式(12)、(13)。

用式(8)和式(13)对AgY吸附模拟油中T和BT的实验数据进行拟合,所得参数值和拟合度列于表3,拟合曲线示于图5。
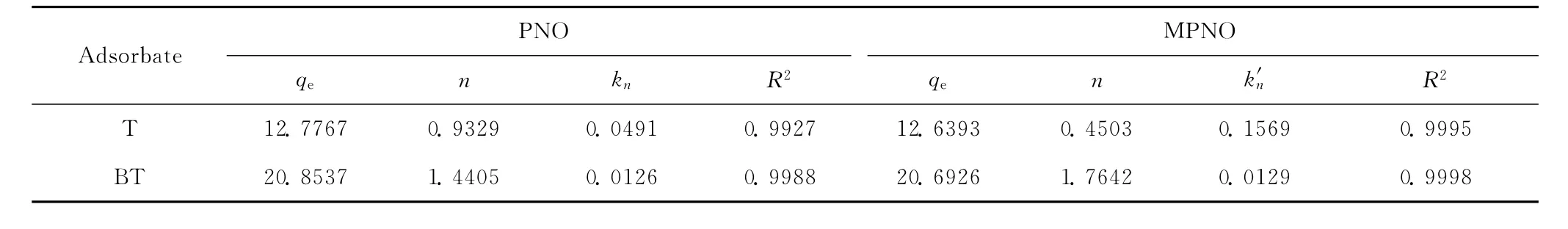
表3 PNO和MPNO模型对AgY吸附T和BT实验数据拟合得到的动力学参数值Table 3 Parameters for adsorption kinetics of T and BT on AgY simulated by PNO and MPNO models

图5 3种动力学模型拟合的AgY吸附T和BT的动力学曲线Fig.5 Adsorption kinetics curves of T and BT on AgY simulated by three adsorption modles
拟合度是用来验证上述2个动力学方程的准确性和有效性。从表3可以看出,修正的准n阶动力学模型和准n阶动力学模型均能很好地描述AgY分子筛对T和BT的吸附行为。
2.6 AgY分子筛吸附T和BT的质量传递分析
吸附质在吸附剂颗粒内的扩散是一个不稳定的质量传递过程,可以用固相扩散偏微分方程来描述。根据质量守恒和线性推动力(LDF)模型[12]建立吸附模型,用于研究AgY分子筛对T和BT的吸附性能。溶液中溶质浓度可由式(14)表达,颗粒质量守恒公式如式(15)所示,当初始条件为t=0,q=0时,式(15)变化为式(16)。溶液中溶质的浓度与固体颗粒内溶质的浓度之间的平衡关系如式(17)所示,其由Langmuir等温方程表达式(5)变形得到。
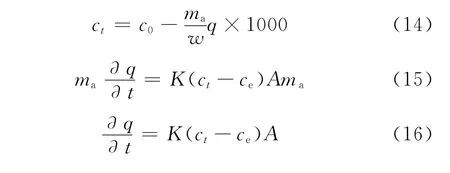

将式(14)和式(17)代入式(16),用 MATLAB软件对实验值进行拟合,得到AgY分子筛对T和BT吸附的最佳质量传递系数K分别为1.0269×10-7m/s和1.4021×10-7m/s。由此可见,T和BT从溶液中传递到吸附剂外表面是一个非常快速的过程(K>10-8m/s),且BT的传递速率快于T。
2.7 AgY分子筛吸附T和BT的颗粒内扩散分析
在吸附过程中,吸附行为有时表现为颗粒内扩散模型。Annadurai[13]等研究了染料在脱乙酰壳多糖上吸附的颗粒内扩散模型。Sarkar[14]等研究表明,颗粒内扩散动力学模型能够很好地描述苯酚类化合物在粉煤灰上的吸附行为。颗粒内扩散模型[15]如式(18)所示。
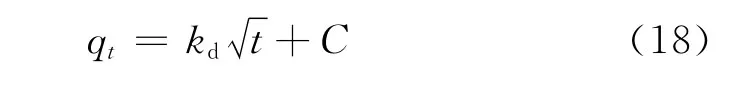
根据实验数据,以qt对t0.5作图,得到T和BT在AgY分子筛颗粒内扩散的动力学曲线,如图6所示。图6中,直线部分的斜率kd为吸附速率参数,表示吸附的快慢;截距C为边界层厚度,截距越大则边界层影响越大。表4给出了AgY分子筛吸附T和BT的颗粒内扩散相关参数。由图6可见,T和BT的动力学曲线各分为初始段和最后的直线段两部分。整个吸附过程既包括边界层扩散又包括颗粒内扩散。初始段为边界层扩散,直线部分表明这一阶段的吸附过程受颗粒内扩散支配。T和BT在吸附过程的初始阶段扩散迅速,随着颗粒内扩散的进行,其扩散速率逐渐变得缓慢直至达到平衡。另外,在颗粒内扩散阶段,T的扩散斜率kd大于BT的kd,表明在此阶段T的扩散速率快于BT,即颗粒内扩散对BT的影响较大。
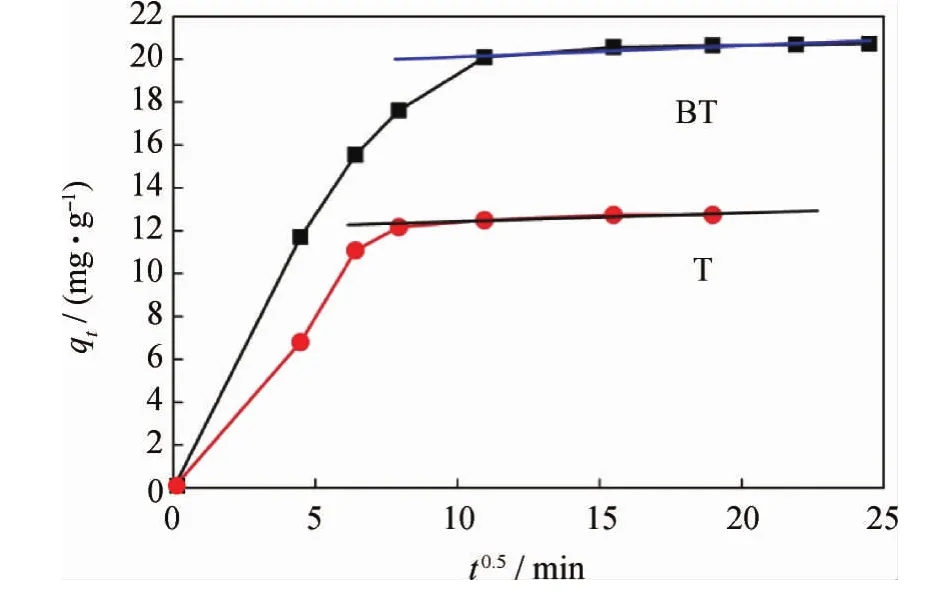
图6 AgY分子筛吸附T和BT的颗粒内扩散动力学曲线Fig.6 Intra-particle diffusion kinetic curves of T and BT adsorption onto AgY

表4 AgY分子筛吸附T和BT的颗粒内扩散参数Table 4 The intra-particle diffusion parameters of T and BT onto AgY
3 结 论
(1)采用固相离子交换法在N2气氛下制备的AgY分子筛结构完整,能有效地脱除模拟油中的噻吩(T)和苯并噻吩(BT)。Langmuir、Toth吸附模型和修正的准n阶(MPNO)动力学方程能很好地描述常温(25℃)下AgY分子筛对燃料油中T及BT的吸附行为,且AgY分子筛对BT的吸附能力强于对T的吸附。
(2)T和BT从溶液中传递到AgY分子筛外表面是一个非常快速的过程,BT的外表面传递速率快于T。
(3)T和BT在吸附过程的初始阶段扩散迅速,随着颗粒内扩散的进行,其扩散速率变得缓慢直至达到平衡;颗粒内扩散对BT的影响较大。
符号说明:
A——固体颗粒的比表面积,m2/g;
C——内扩散截距,mg/g;
c0——模拟油初始硫质量分数,μg/g;
ce——吸附平衡时模拟油硫质量分数,μg/g;
ct——吸附t时刻模拟油中硫的质量分数,μg/g;
K——质量传递系数,m/s;
KF——Freundlich吸附常数,(mg/g)·(g/μg)(1/m);
KL——Langmuir吸附常数,g/μg;
KT——Toth吸附常数,g/μg;
kd——颗粒内扩散系数,mg/(g·min0.5);
kn——准n阶速率常数,(1/min)·(mg/g)1-n;
k′n——修正的准n阶速率常数,(1/min)·(mg/g)1-n;
m——Freundlich常数;
ma——吸附剂的质量,g;
n——速率方程的阶;
p——Toth常数;
q——吸附剂的吸附硫容,mg/g;
qe——单位质量吸附剂的平衡吸附硫容,mg/g;
qm——单分子的理论饱和吸附量,mg/g;
qt——单位质量吸附剂在t时刻的吸附量,mg/g;
R2——拟合度
t——吸附时间,min;
w——模拟油的质量,g;
η——脱硫率,%。
[1]FALLAH R N,AZIZIAN S.Removal of thiophenic compounds from liquid fuel by different modified activated carbon cloths[J].Fuel Processing Technology,2012,93(1):45-52.
[2]李小燕,花明,刘义保,等.改性玉米芯吸附溶液中U(Ⅵ)的动力学和热力学[J].化工学报,2012,63(12):4068-4074.(LI Xiaoyan,HUA Ming,LIU Yibao,et al.Kinetics and thermodynamics of U(VI)adsorption from aqueous solution by modified corncob[J].Journal of Chemical Industry and Engineering,2012,63(12):4068-4074.)
[3]SARKAR M,ACHARYA P K,BHATTACHARYA B.Modeling the adsorption kinetics of some priority organic pollutants in water from diffusion and activation energy parameters[J].Journal of Colloid Interface Science,2003,266(1):28-32.
[4]KENNEDY L J,VIJAYA J J,SEKARAN G,et al.Equilibrium,kinetic and thermodynamic studies on the adsorption ofm-cesol onto micro-and mesoporous carbon[J].Journal of Hazard Materials,2007,149(1):134-143.
[5]MOHAMED M M,EISSA N A.Characterization of intra zeolitic Fe3+prepared by chemical vapor deposition of[(C5H5)Fe(CO)2]2inside NaY and FSM-16zeolites and their catalytic activities towards phenol hydroxylation[J].Materials Research Bulletin,2003,38(15):1993-2007.
[6]TAKAHASHI A,YANG R T.Cu(I)-Y zeolite as a superior adsorbent for diene/olefin separation [J].Langmuir,2001,17(26):8405-8413.
[7]XUE M,CHITRAKAR R,SAKANE K,et al.Selective adsorption of thiophene and 1-benzothiophene on metal-ion-exchanged zeolites in organic medium[J].Journal of Colloid and Interface Science,2005,285(2):487-492.
[8]DONAT R,AYTAS S.Adsorption and thermodynamic behavior of uranium(VI)on Ul va sp-Na bentonite composite adsorbent[J].Journal of Radio Analytical and Nuclear Chemistry,2005,265(1):107-114.
[9]DO D D.Adsorption Analysis:Equilibria and Kinetics[M].London:Imperial College Press,1998:2.
[10]OZER A,HAZARD J.Removal of Pb(II)ions fromaqueous solutions by sulphuric acid-treated wheat bran[J].Journal of Hazardous Materials,2007,141(3):753-761.
[11]AZIZIAN S,FALLAH R N.A new empirical rate equation for adsorption kinetics at solid/solution interface[J].Applied Surface Science,2010,256(17):5153-5156.
[12]SIRCAR S,HUFTON J R.Why does the linear driving force model for adsorption kinetics work [J].Adsorption,2000,6(2):137-147.
[13]ANNADURAI G,LING L Y,LEE J F.Adsorption of reactive dye from an aqueous solution by chitosan:Isotherm,kinetic and thermodynamic analysis[J].Journal of Hazardous Materials,2008,152(1):337-346.
[14]SARKAR M,ACHARYA P K,BHATTACHARYA B.Modeling the adsorption kinetics of some priority organic pollutants in water from diffusion and activation energy parameters[J].Journal of Colloid and Interface Science,2003,266(1):28-32.
[15]HUANG Y,MA X Y,LIANG G Z,et al.Adsorption behavior of Cr(VI)on organic-modified rectorite[J].Chemical Engineering Journal,2008,138 (1-3):187-193.

