脾切除术后抗病毒治疗对肝硬化患者肝脏储备及再出血风险的影响
纪光晰,郭永红,2,陈 琳,张 颖,何 瑜,马 力,王 宇,马志远,成 程,贾战生
1.第四军医大学唐都医院全军感染病诊疗中心,陕西 西安 710038;2.西安交通大学第二附属医院传染科;3.第四军医大学唐都医院质量管理科
肝硬化是一种常见的慢性肝病,也是一种多发病,可由一种或多种原因引起肝脏损伤,使肝脏呈进行性、弥漫性、纤维性病变[1]。肝硬化早期无明显可检测的症状,后期则出现一系列不同程度的门静脉高压和肝功能障碍,多有出血倾向,上消化道大出血、颅内出血等是其重要的致死原因[2]。截至目前,肝硬化仍无特效治疗方法,因此,对肝硬化进行早期诊断、积极控制病因是改善肝功能及控制并发症的重要手段。肝脏功能下降、脾脏功能亢进以及免疫复合物的相互作用,导致凝血因子及血小板生成量减少,功能减弱,常伴有一系列的凝血功能障碍和出血倾向,对患者的生命安全造成极大的危害。目前,脾切除术是改善脾亢功能最直接和最有效的方法,但术后是否能长期保持较好状态,还应考虑是否行抗病毒治疗。因此,本文着重对肝硬化脾切除患者进行5年随访,观察肝硬化患者脾切除术后行抗病毒治疗对患者凝血指标、肝脏储备功能及门脉高压的动态临床影响。
1 资料与方法
1.1 一般资料 选取2000年1月-2012年5月第四军医大学附属医院和西安交通大学附属医院收治的丙型肝炎肝硬化伴脾功能亢进并行脾切除术治疗的患者共97例作为研究对象,通过回顾性方法将患者行脾切除术后是否进行抗病毒治疗分为治疗组(抗病毒组)和对照组(未抗病毒组),从中选取具有60个月以上完整病例资料的患者进入研究队列,共75例(A组:治疗组42例,B组:对照组33例)。两组患者在年龄、性别以及文化程度上的差异均不具有统计学意义(见表1)。其诊断均符合2004年丙型肝炎防治指南。排除标准为:① 急性丙型肝炎患者;② 合并甲、乙、丁、戊型肝炎病毒、EB病毒、巨细胞病毒感染及中毒、酒精、遗传性、自身免疫性肝病患者;③ 伴随有其他严重疾病者,如伴有肾、脑、心、肺及糖尿病等疾病的患者;④有心理障碍或者精神疾病者。
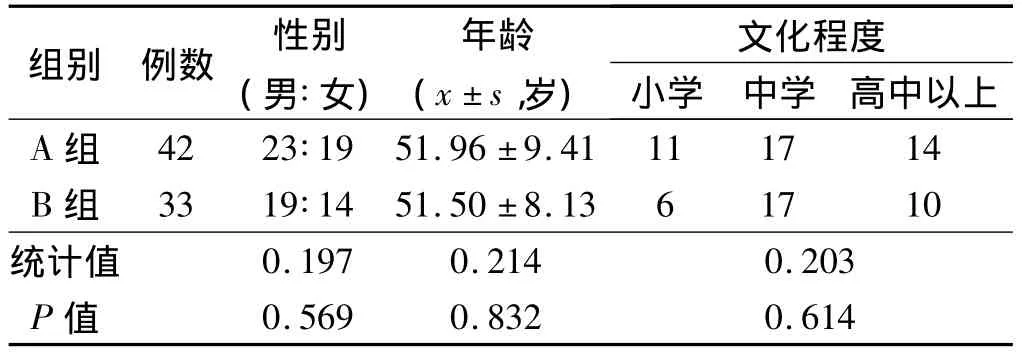
表1 患者临床基线资料情况对比Tab1 Comparison of baseline data between two groups
1.2 方法 分别于术前3 d、干扰素(INF)治疗前1 d、术后6个月、12个月、36个月、60个月对治疗组和对照组患者进行定期生化检验以及资料收集,主要对患者凝血系列:APTT、PT、PTA、Fib,肝脏功能:ALB、A/G,血小板活动计数(PLT)及门静脉宽度等指标进行检测,整理数据、统计分析。治疗组42例患者自愿进行抗病毒治疗,使用聚乙二醇干扰素α-2a(购自瑞士罗氏制药公司)180 μg皮下注射,1次/周,联合利巴韦林胶囊(购自浙江诚意药业有限公司)口服,800~1200 mg/d,治疗48~72周;对照组33例患者未进行任何抗病毒治疗(主要是由于患者经济限制,拒绝抗病毒治疗)。
1.3 统计学处理 采用SPSS 13.0和Graphpad Prism 5统计软件进行数据分析处理,计量资料以表示,采用单因素方差分析进行组间比较。P<0.05为差异有统计学意义(“*”表示P<0.05;“**”表示P介于0.001~0.01之间;“***”表示 P <0.001)。
2 结果
2.1 术后抗病毒治疗对患者凝血指标的影响 对治疗组和对照组的各项凝血指标进行数据整理,分析结果如图1所示:PT在治疗组术后呈下降趋势,至术后60个月较INF治疗前显著降低(P<0.01),并与对照组差异最早出现在术后36个月,且差异趋势随时间延长逐渐增大。APTT在治疗组术后即刻显著下降并较术前差异具有统计学意义(P<0.05),且就此状态可保持至术后60个月,而对照组自术后6个月逐渐上升,至术后60个月两者比较差异有统计学意义(P<0.05),这正与对照组在Fib中呈递减趋势的变化恰恰相反(同样具有统计学意义,P<0.05)。PTA在两组中短期内均无变化,但至术后60个月治疗组较对照组上升显著,且差异有统计学意义(P<0.01)。
2.2 术后抗病毒治疗对肝脏储备功能的影响 分析两组患者肝脏储备功能相关指标,结果如图2所示:两组患者ALB和A/G在术后均呈降低趋势,ALB的降低在术后6个月与60个月比较中治疗组不及对照组显著(P <0.05、P <0.001);A/G 比值在INF治疗前较术前略有升高(但差异无统计学意义),但术后两组均呈下降趋势,且基线长期保持在1.0左右,直至对照组60个月时低于 1.0,且差异有统计学意义(P<0.001)。
2.3 术后抗病毒治疗对PLT以及门静脉宽度的影响分析两组患者术后PLT计数及门静脉宽度值变化,结果如图3所示:PLT在术后较术前即刻升高且差异有统计学意义(P<0.001),而随后呈现下降趋势,与术前比较两组出现差异(P<0.05)的时间点治疗组(36个月)晚于对照组(12个月)。两组患者门静脉宽度值术后较术前均有显著下降,且差异均有统计学意义(P<0.05);最大差异出现在治疗组术后12个月(P<0.001),而治疗组和对照组差异终止分别为术后36个月(P <0.05)和术后12个月(P <0.05)。
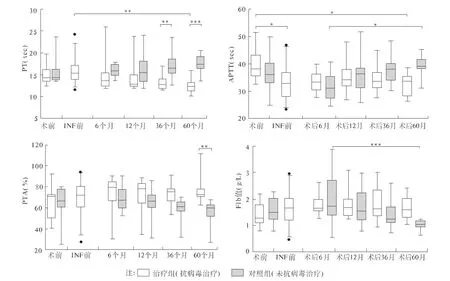
图1 术后抗病毒治疗对患者凝血指标的影响Fig1 Blood coagulation indexes of patients postoperative antiviral treatment
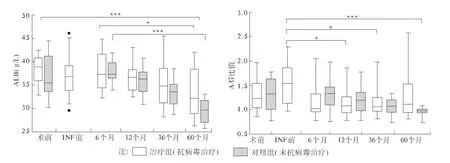
图2 术后抗病毒治疗对患者肝脏功能的影响Fig2 Liver function of patients postoperative antiviral treatment
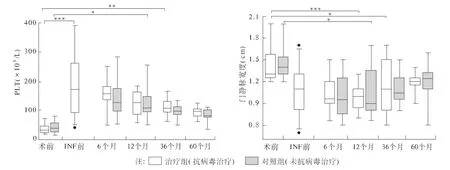
图3 术后抗病毒治疗对PLT形成以及门静脉宽度的影响Fig3 PLT formation and the width of the portal vein postoperative antiviral treatment
2.4 术后抗病毒治疗对脾切除术前、后再出血风险的影响 选取术前经胃镜检查明确诊断“食管-胃底静脉曲张Ⅱ度以上”患者为观察对象,其中治疗组22例、对照组 18例,术前出血分别是治疗组 6例(27.27%,6/22)、对照组 4 例(22.22%,4/18)。术后比较示:对照组患者术后再出血在12~36个月时段增幅较高,较同期治疗组达 15.15%[对照组 6例(33.33%,6/18)、治疗组4 例(18.18%,4/22)],较同组<12个月时段达24.24%[<12个月2例(9.09%,2/22)、12~36个月6例(33.33%,6/18)]。但在 >36个月时段再出血次数及比例两组相比差异最显著,达20.71%[治疗组 4例(18.18%,4/22)、对照组 7 例(38.89%,7/18)]。
3 讨论
肝硬化在我国呈逐年上升趋势,其重要的并发症脾功能亢进严重影响患者的身心健康且已被广泛认同[3-4]。脾脏通过复杂的免疫调节机制促进肝硬化形成,血小板源性生长因子(platelet derived growth factor,PDGF)的升高和血小板数量的减少与肝纤维化的进程密切相关[5-6]。门静脉系统阻力和侧枝分流的增加促进了脾功能亢进的发生[7],可是目前对病理性脾脏组织是否仍需保留尚无定论,Guralnik等[8]报道称给予部分脾切除术或脾动脉栓塞术易出现脾组织再生而复发脾亢。还有报道称[9]脾切除后虽可使血小板数目明显升高,但对凝血功能无明显改善,肝硬化患者依然存在与肝功能损害程度相关的出血倾向。因此,基于以上因素,本文旨在从临床角度探讨通过脾切除术改善脾功能亢进状态后,再经抗病毒治疗能否持续改善肝脏功能损害、延缓低凝状态发生、降低门静脉压力、减少再出血的发生。
3.1 凝血指标变化 Youssef等[10]认为肝硬化患者导致的凝血和抗凝机制紊乱与再出血发生有关。PT、APTT和PTA分别反映外、内源性凝血系统因子的合成情况和凝血酶原活动度,本文结果显示PT、APTT和PTA在术后60个月时治疗组较对照组仍持续保持较好状态(PT、APTT治疗组低于对照组而PTA与之相反),并分别具有统计学意义(P <0.01、P <0.05、P <0.01),Fib术后6个月时两组均为最高点,随后对照组呈递减趋势,至术后60个月时出现显著差异(P<0.05),考虑短时间内升高与手术损伤脏器有关。以上均说明脾切除术后抗病毒治疗在改善肝脏功能的同时也延缓了低凝状态的发展,这些结果与Panasiuk等[11]和 Ushitora 等[12]的研究相一致,并观察期较之延长,他们认为当肝脏受损时,凝血因子合成减少或质量下降,PT与肝细胞的受损程度呈正相关;而脾切除后肝脏功能和凝血状态的改善更使丙型肝炎患者有效的INF治疗得以成功方便地实施。
3.2 肝脏储备功能变化 肝硬化代偿期和失代偿期患者5年生存率差别巨大,分别为84%和14%[13]。Ballmer等[14]和 Kubo等[15]认为肝硬化程度的加重与肝脏ALB的合成率下降有关,同时病毒复制也是肝硬化恶化及死亡的主要原因,并与病毒载量的高低呈正比。本文两组患者ALB、PLT水平在术后60个月时均较术前显著降低(P<0.001),考虑与术前短期给予营养补充及疾病自身发展有关。A/G比值示术后两组均呈下降趋势,且基线均在1.0左右,直至对照组60个月时低于1.0,出现倒置。这与张字、Imura、Elsebae、Morinaga等[16-19]的研究相符,他们认为脾切除后短期内对肝脏储备功能和营养代谢及肝纤维化均会有所改善。再结合治疗组的抗病毒治疗应答率:EVR 73.81%(31/42)、ETVR 90.48%(38/42)、SVR 64.29%(27/42)。本文表明切除肝硬化状态下免疫功能已严重受损的脾脏,可以解除其对外周淋巴组织的抑制,但不会引起患者免疫功能明显变化;且至少1~3年内可以减缓肝硬化的发展,改善患者的营养状况,使ALB、血小板恢复,为进一步抗病毒治疗及抗纤维化治疗提供了可能。也为病原学治疗提供了一定的理论基础,说明在肝硬化脾切除阶段也不应忽视对肝炎病毒的治疗[14]。
3.3 再出血风险变化 已有报道,门脉高压引发的上消化道出血是肝硬化早期死亡的独立危险因素[20]。脾切除术既可改善脾亢还可减少20%~40%的门脉供血,平均压力下降 0.68 kPa[21-22],且门静脉和脾静脉直径越宽,对术后门静脉系统血液动力学的影响越大[23-24]。本文研究发现术后门脉宽度值较术前均有显著下降(P<0.001~0.05)。治疗组术后12个月较术前降低差异最大(P<0.001),且差异可保持至术后36个月(P<0.05),但对照组差异止于术后12个月(P<0.05)。再出血次数对照组术后12~36个月较治疗组增幅显著,达15.15%,并仍呈增大趋势(术后>36个月两组差异最显著,达20.71%)。以上结果说明脾切除术可显著降低门脉宽度,但维持时间尚短,多为12个月,若术后给予抗病毒治疗不仅能显著延缓再次门脉扩张的时间,还可降低再出血风险。
综上所述,越来越多的证据表明脾亢、肝硬化、门静脉高压症互为因果,不单纯是肝硬化的继发病变。本文通过对丙型肝炎肝硬化脾切除后抗病毒治疗的5年动态观察,发现行脾切除术可以改善肝储备功能,缓解肝硬化进展,增强肝细胞再生能力,但良好效果保持短暂。若能术后持续抗病毒治疗对肝硬化患者肝脏储备功能、凝血因子的稳定/保护及降低再出血风险意义更大。
[1]Lee CM,Leung TK,Wang HJ,et al.Evaluation of the effect of partial splenic embolization on platelet values for liver cirrhosis patients with thrombocytopenia [J].World J Gastroenterol,2007,13(4):619-622.
[2]Bao M,Li XS.Platelet parameters of patients with liver cirrhosis and blood coagulation factor test results analysis[J].Journal of Shandong Medicine,2009,49(25):46-47.鲍淼,李孝生.肝硬化患者血小板相关参数和凝血因子检测结果分析[J].山东医药,2009,49(25):46-47.
[3]He XH,Li WT,Peng WJ,et al.Total embolization of the main splenic artery as a supplemental treatment modality for hypersplenism[J].World J Gastroenterol,2011,17(24):2953-2957.
[4]Abdella HM,Abd-EI-Moez AT,Abu El-Maaty ME,et al.Role of partial splenic arterial embolization for hypersplenism in patients with liver cirrhosis and thrombocytopenia[J].Indian J Gastroenterol,2010,29(2):59-61.
[5]Zeng H,Nie WP,Liu HN.Effects of splencectomy on the expression of PDGF-B in the live and the serum level of PDGF-BB of the rats with hepatic fibrosis[J].Chin J Hepatobiliary Surg,2011,17(4):305-308.曾虎,聂晚频,刘海宁.脾切除对肝纤维化大鼠肝脏PDGF-B表达及血清PDGF-BB水平的影响[J].中华肝胆外科杂志,2011,17(4):305-308.
[6]Kodama T,Takehara T,Hikita H,et al.Thrombocytopenia exacerbates cholestasis-induced liver fibrosis in mice[J].Gastroenterology,2010,138(7):2487-2498.
[7]Zhu JH,Wang YD,Ye ZY,et al.Laparoscopic versus open splenectomy for hypersplenism secondary to liver cirrhosis[J].Surg Laparosc Endosc Percutan Tech,2009,19(3):258-262.
[8]Guralnik V,Schäffler A,Schölmerich J,et al.Partial splenic artery embolization for the treatment of a patient with hypersplenism due to liver cirrhosis [J].Dtsch Med Wochenschr,2008,133(38):1893-1896.
[9]Fu YY.Splenectomy effect on cirrhosis of the liver spleen function hyperfunction of coagulation function[J].Academic Journal of Guangzhou Medical College,2005,33(4):37-38.付颖瑜.脾切除对肝硬化脾功能亢进凝血功能的影响[J].广州医学院学报,2005,33(4):37-38.
[10]Youssef WI,Salazar F,Dasarathy S,et al.Role of fresh frozen plesma infusion in correction of coagulopathy of chronic liver disease:a dual phase study [J].Am J Gastroenterol,2003,98(6):1391-1394.
[11]Panasiuk A,Prokopowicz D,Zak J,et al.Activation of blood platelets in chronic hepatitis and liver cirrhosis P-selectin expression on blood platelets and secretory activity of beta-thromboglobulin and platelet factor-4 [J].Hepatogastroenterology,2001,48(39):818-822.
[12]Ushitora Y,Tashiro H,Takahashi S,et al.Splenectomy in chronichepatic disorders:portal vein thrombosis and improvement of liver function[J].Dig Surg,2011,28(1):9-14.
[13]Zhang SC,Tu CT.Decompensation period of the processing of hepatitis b cirrhosis patients[J].Chinese Hepatology,2003,8(3):49-50.张顺财,涂传涛.失代偿HBV肝硬化病人的处理[J].肝脏,2003,8(3):49-50.
[14]Ballmer PE,Reichen J,McNurlan MA,et al.Albumin but not fibrinogen synthesis correlates with galactose elimination capacity in patients with cirhosis of the liver[J].Hepatology,1996,24(1):53-59.
[15]Kubo S,Hirohashi K,Tanaka H,et al.Effect of viral status on recurrence after liver resection for patients with hepatitis B virus-related hepatocellular carcinoma[J].Cancer,2000,88(5):1016-1024.
[16]Zhang Z,Wen TF,Chen ZY,et al.Splenectomy cardiac blood vessels from off the changes of postoperative liver hemodynamics and reserve function[J].Chinese Journal of General Surgery,2009,24(6):470-472.张字,文天夫,陈哲宇,等.脾切除贲门血管离断术后肝脏血流动力学和储备功能的变化[J].中华普通外科杂志,2009,24(6):470-472.
[17]Imura S,Shimada M,Utsunomiya T,et al.Impact of splenectomy in patients with liver cirrhosis:results from 18 patients in a single center experience[J].Hepatol Res,2010,4(9):894-900.
[18]Elsebae MM,Abu-Zekri NB.A study of the effect of splenectomy on hepatic functional reserve and structural damage in patients with chronic hepatitis C virus infection by non-invasive serum markers.A prospective study[J].Int J Surg,2008,6(5):362-366.
[19]Morinaga A,Ogata T,Kage M,et al.Comparison of liver regeneration after a splenectomy and splenic artery ligation in a dimethylnitrosamine-induced cirrhotic rat model[J].HPB(Oxford),2010,12(1):22-30.
[20]McCormick PA,O'Keefe C.Improving prognosis following a first variceal haemorrhage over four decades [J].Gut,2001,49(5):682-685.
[21]Zhang Y,Wen T,Yan L,et al.The changes of hepatic hemodynamics and functional hepatic reserve after splenectomy with periesophagogastric devascularization [J].Hepatogastroenterology,2009,56(91-92):835-839.
[22]Eyraud D,Granger B,Ionescu C,et al.Thrombocytopenia,splenomegaly,and portal blood flow in patients who have undergone liver transplantation for cirrhosis [J].Liver Transpl,2012,18(3):340-346.
[23]Fujita F,Lyass S,Otsuka K,et al.Portal vein thrombosis following splenectomy:indentification of risk factors[J].Am Surg,2003,69(11):951-956.
[24]Alper E,Buyrac Z,Baydar B,et al.Evaluation of flow and structure abnormalities of splanchnic system veins in cirrhotic patients without portal hypertension [J].Minerva Gastroenterol Dietol,2011,57(2):123-127.

