大鼠胃黏膜SS、EGF、PGE2含量在模拟+Gz值暴露下的变化及机制
范 勤,陈 英,杜 斌,唐合兰,杨春敏
中国人民解放军空军总医院1.麻醉科;2.干部病房消化科,北京 100142
在战斗机飞行员飞行过程中,不同加速度(+Gz)值暴露诱发应激性胃黏膜损伤的机理尚未完全清楚,但应激性胃黏膜损伤的发病机制,涉及机体神经内分泌失调、胃黏膜屏障保护功能消弱及胃黏膜损伤因素加强等方面,是多因素综合作用的结果[1]。胃黏膜的保护机制是指胃黏膜抵御各种有害因子损害的物理和生化机制。这些具有保护作用的因素主要有黏膜屏障、黏液-碳酸氢盐屏障、黏膜血流量、细胞更新率、前列腺素E2(PGE2)、表皮生长因子(EGF)、生长抑素(SS)等[2-3],胃黏膜保护是一个抗损伤和修复的过程,多种物质均参与其中,王玮等[3]将这些因素概括为,受到刺激的胃黏膜可启动某些内在的防御机制,增强其对各种损害因素作用的抵抗力,即产生细胞保护作用。吴战军等[4]报道不同+Gz值暴露可引起胃肠黏膜组织SS含量显著升高;胃黏膜在应激状态下可以引起胃黏膜或黏膜细胞的损伤,给予EGF、PGE2不但能防止胃黏膜损伤,还可促进损伤的修复[5]。故推测,胃黏膜保护因子EGF、PGE2、SS是否参与+Gz值暴露对胃黏膜应激反应的损伤过程,是加重胃黏膜应激损伤反应还是抑制胃黏膜损伤反应?本实验研究模拟不同+Gz值暴露对大鼠实验性胃损伤应激状态的可能抗损伤机制过程中,黏膜保护因子-SS、EGF、PGE2的影响及调节机制,为飞行员在飞行中高+Gz值暴露中胃黏膜损伤的防护提供参考。
1 材料和方法
1.1 一般材料 健康雄性Wistar大鼠40只,SPF级,体质量260~300 g,购买于北京斯贝福实验动物技术有限公司。大鼠由航天医学工程研究所动物房饲养,适应性饲养7 d后开始实验,每组大鼠均单笼饲养,自由饮食及水,动物室室温维持在(23±2)℃,12 h循环光照。模拟加速度动物离心机(由航天医学工程研究所提供),9 g/L氯化钠注射液(湖南康元制药有限公司,生产批号10070902B 05);碘伏消毒液(北京四环卫生药械厂有限公司,生产批号20110605)。戊巴比妥钠(Sigma公司,生产批号P4281)。动物手术器械等器械由航天医学工程研究所中心实验室提供。EGF、SS、PGE2放射免疫分析盒购自北京华英生物技术研究所(仪器厂家:r-911全自动放免技术仪,中国科技大学实业总公司)。病理组织切片机由空军总医院病理科提供。
1.2 方法
1.2.1 分组:健康雄性Wistar大鼠40只,随机分为四组:A组(对照组):+1 Gz值暴露(n=10),连续暴露5 min;B组:+5 Gz值暴露(n=10),连续暴露5 min;C组:+10 Gz值暴露(n=10),连续暴露5 min;D组:重复暴露组(n=10),+5 Gz值1.5 min,+10 Gz值2 min,+5 Gz值1.5 min。
1.2.2 大鼠模拟+Gz值暴露模型制备:参照吴战军等[4]方法,+Gz暴露方式采用动物离心机模拟 +Gz暴露。利用特制的固定盒承载大鼠,固定于动物离心机上。离心机半径为1.9 m。每只大鼠专用一个固定盒,保证加速度作用的方向。大鼠头朝向离心机轴心,仰面固定于离心机转臂远端,每组10只同时上机。采用梯形+Gz作用曲线,G值增长率1 G/s,由计算机进行加速度程序控制。A、B、C组持续时间暴露5 min。D 组:暴露于 +5 Gz 1 min,+10 Gz 2 min,+5 Gz 1.5 min。
1.2.3 胃黏膜组织病理学检测:每实验组大鼠下离心机后,立即2%戊巴比妥钠2.3 ml/kg腹腔麻醉。腹部剃毛、消毒,于剑突下腹正中线打开腹腔,取出胃,将胃冲洗,沿大弯侧剪开、展平,平展在平板上,光镜下观察胃黏膜改变,制成切片,进行HE染色观察组织病理学改变。刮取剩余胃窦和十二指肠球部黏膜组织,液氮保存。
1.2.4 SS、EGF、PGE2含量的检测(放免法):胃黏膜中抽取 PGE2方法参见文献[6],按 PGE2、SS、EGF、试剂盒说明测定,测得A值,据标准曲线求得其含量,胃黏膜中 PGE2、SS、EGF含量表示为 ng/mg。
1.3 统计学分析 实验数据采用SPSS 17.0统计软件分析处理,计量资料以表示。各组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况比较 A组光镜下观察胃底、胃窦、十二指肠黏膜光滑,完整,B组胃黏膜光滑平整,胃黏膜充血,呈均匀淡粉色,无出血、糜烂及溃疡,胃黏膜欠完整,有轻微点状损伤;C组、D组光镜观察胃底、胃窦、十二指肠黏膜均可见散在小溃疡及出血斑,冲洗后可见胃黏膜表面呈弥漫性水肿,可见广泛分布的大小不等的糜烂、出血灶,以胃体部和胃底部黏膜明显,部分黏膜充血剥脱(见图1)。
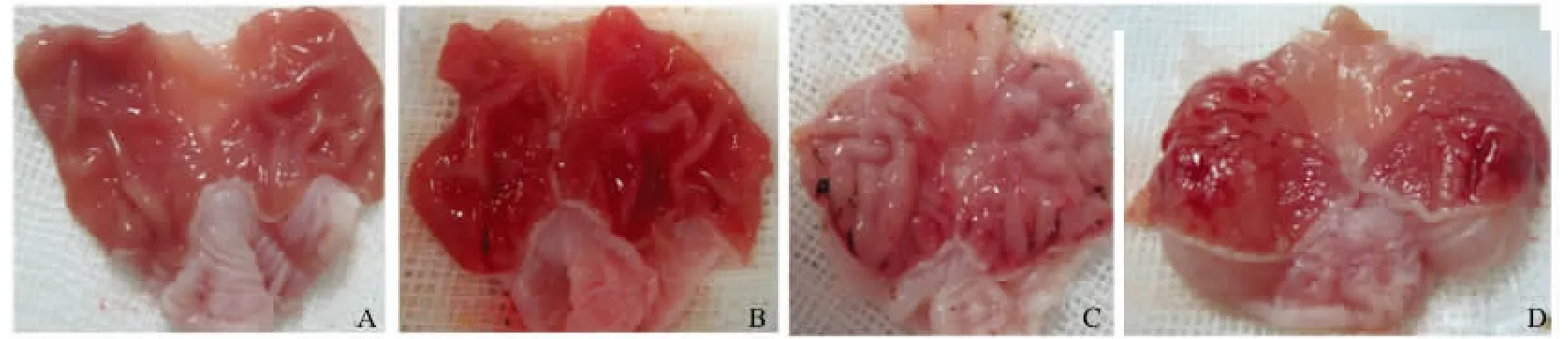
图1 各组大鼠胃黏膜损伤程度 A:对照组(+1 Gz实验暴露);B:+5 Gz暴露组;C:+10 Gz暴露组;D:连续暴露组Fig1 The degree of gastric mucosal injury in rats of different groups A:control group(+1 Gz experimental exposure);B:+5 Gz exposure group;C:+10 Gz exposure group;D:repeated exposure group
2.2 胃黏膜组织病理学 HE染色镜下观察:A组肠壁形态结构正常,黏膜层绒毛完整;黏膜下层、肌层、浆膜层结构正常。B组组织充血、水肿,损伤局限于黏膜表层,部分上皮细胞脱落,固有层可见较多的中性粒细胞浸润,一些淋巴细胞及嗜酸性粒细胞。C组、D组可见损伤侵入黏膜全层,大量上皮细胞脱落,腺体结构破坏,大量的炎性细胞全层浸润,部分病变深度超过黏膜肌层,形成浅溃疡(见图2)。
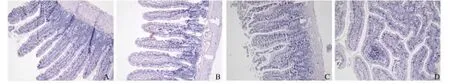
图2 各组大鼠胃黏膜组织组织学检查(200×)A:对照组(+1 Gz实验暴露);B:+5 Gz暴露组;C:+10 Gz暴露组;D:连续暴露组Fig2 Histological examination of the gastric mucosa in each group of rats(200×) A:control(+1 Gz experimental exposure)group;B:+5 Gz exposure group;C:+10 Gz exposure group;D:repeated exposure group
2.3 大鼠胃黏膜EGF、SS、PGE2在不同+Gz值暴露下的含量 大鼠胃黏膜EGF含量比较:与A组比较,不同+Gz值暴露组EGF含量明显减少,差异有统计学意义(其中B组与C组比较,P<0.05;其余两两对比,P 均 <0.01)(见表1)。
大鼠胃黏膜SS含量比较:B组>A组(P=0.007)。C组>A组(P<0.01);C组>B组(P<0.01)。D组>A组(P<0.01);D组>B组(P<0.001);D组>C组(P<0.01)。B、C、D组与A组相比较,两两相比均明显增加,差异有统计学意义(P<0.01,见表1)。
大鼠胃黏膜PGE2含量比较:B组<A组(P=0.007)。C组 <A 组(P=0.001);C组 <B组(P=0.003)。D组 <A组(P<0.001);D组 <B组(P<0.001);D 组 <C 组(P=0.001)。B、C、D 组与 A 组相比较,两两相比均明显增加,差异有统计学意义(P<0.01,见表 1)。
表1 不同+Gz值暴露下大鼠胃黏膜EGF、SS、PGE2含量(,ng/mg)Tab1 EGF,SS and PGE2contents in the gastric mucosa of rats in each group(,ng/mg)
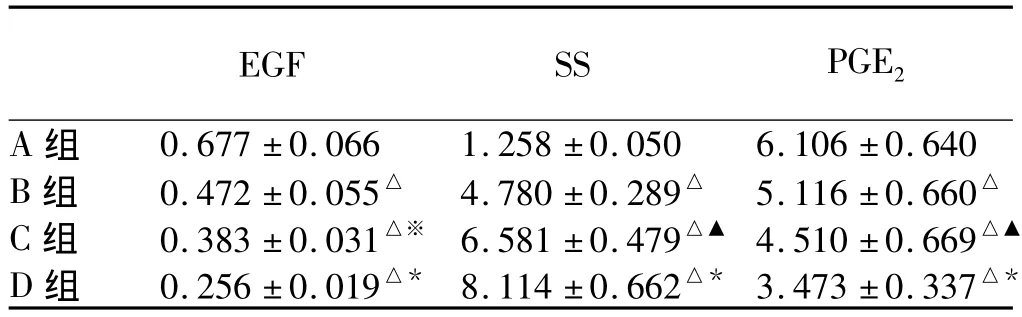
表1 不同+Gz值暴露下大鼠胃黏膜EGF、SS、PGE2含量(,ng/mg)Tab1 EGF,SS and PGE2contents in the gastric mucosa of rats in each group(,ng/mg)
注:与 A 组比较,△P<0.01;与 B 组比较,▲P <0.01,※P <0.05;与 C 组比较,*P <0.01。
EGF SS PGE2 A组0.677 ±0.066 1.258 ±0.050 6.106 ±0.640 B 组 0.472 ±0.055△ 4.780 ±0.289△ 5.116 ±0.660△C 组 0.383 ±0.031△※ 6.581 ±0.479△▲ 4.510 ±0.669△▲D 组 0.256 ±0.019△* 8.114 ±0.662△* 3.473 ±0.337△*
3 讨论
赵洪礼等[5]研究表明高+Gz值暴露是飞行人员胃肠功能性疾病和急性胃黏膜损伤发病率较高的一个重要原因[7]。高+Gz值暴露后引起脑组织葡萄糖含量降低,磷酸激酶和ATP水平下降,而乳酸含量增加,酸中毒可能是组织细血管结构改变的原因之一[6]。在飞行员模拟推拉动作后,血液黏度升高,影响了血流动力学,使局部尤其是组织血液灌流不足,出现微循环障碍,导致组织缺血、缺氧[7]。吴战军等[4]报道高 +Gz值暴露为一种强烈应激刺激,交感神经兴奋性增强,黏膜下血管痉挛收缩,黏膜血供减少,局部组织缺血缺氧,抵抗力降低;不同+Gz值暴露下急性胃黏膜有损伤,有胃肠激素的改变。
本实验研究发现:与A组(+1 Gz暴露)相比,B组(+5 Gz暴露)胃黏膜光滑,完整,病理切片显示组织充血、水肿,损伤局限于黏膜表层,部分上皮细胞脱落,说明B组与A组相比对大鼠胃黏膜损伤较小。C组(+10 Gz实验暴露)、D组(+Gz连续暴露)大体可见胃黏膜有重度充血,胃肠胀气,浆膜层充血肿;胃壁内可见胃内少许淡咖啡样液体,黏膜水肿、充血、糜烂,可见点状或线状出血点和斑块。与A组相比,C组(+10 Gz实验暴露)、D组(+Gz连续暴露)的胃黏膜病理组织学改变可见损伤侵入黏膜全层,大量上皮细胞脱落,腺体结构破坏,中性粒细胞全层浸润,部分病变深度超过黏膜肌层,形成浅溃疡。部分主细胞、壁细胞肿胀,腺体结构大部完整,部分被破坏,固有层可见较多的中性粒细胞浸润,一些淋巴细胞及嗜酸性粒细胞。C组(+10 Gz实验暴露)、D组(+Gz连续暴露)胃黏膜损伤程度重于A组(+1 Gz暴露)、B组(+5 Gz暴露)。因此显示不同+Gz值暴露对胃黏膜损伤不同,随着+Gz暴露值的增加,胃黏膜损伤程度越重。
既往研究[8-9]急性胃黏膜损伤的形成机制研究表明EGF、PGE2、SS等在应激状态下参与胃肠黏膜的保护,在胃肠黏膜损伤中的变化,对胃肠黏膜的保护均有重要作用,是胃肠黏膜的重要防护因子:① EGF对维护胃黏膜完整性起重要作用[10]。② PGE2可通过增加胃黏膜血流量(GMBF),提高防御能力的方式来起到保护胃黏膜作用[11];胃黏膜内源性保护因子PGE2对上皮细胞的保护作用,不仅可以抑制胃酸和胃蛋白酶的分泌、刺激胃黏膜黏液的分泌并增加其碳酸盐含量,防止或减轻有害物质对消化道上皮的损伤[11-12],还具有维持胃黏膜微血管的完整性并增加其血流量[13]、促进胃小凹干细胞增殖移行修复胃黏膜上皮以及免疫调节、抑制胃运动过强等作用[14]。③ SS几乎对所有胃肠肽均起抑制作用;对胃酸、胃蛋白酶、胰液及胆汁的分泌均有抑制作用[6]。本实验研究发现:B组(+5 Gz暴露)、C组(+10 Gz实验暴露)、D组(+Gz连续暴露)与A组(+1 Gz实验暴露)相比,随着+Gz暴露值的增加,局部胃黏膜 SS含量增加,EGF、PGE2含量减少。
PGE2是一种最基本的协调黏膜对损伤刺激的保护性反应重要介质[12],PGE2的分泌是瞬间合成,不在细胞内贮存,PGE2的产生和释放是组织损害的结果[13]。Robert等[14]首先观察到 PGE2可以抑制胃酸分泌,且非抗酸剂量的PGE2可以完全防止酒精、强酸、强碱等物质引起的急性胃黏膜损伤。有研究发现患者在发生十二指肠溃疡后胃、十二指肠黏膜PGE2含量下降,在溃疡活动期下降尤为显著[13]。陈宝文等[15]发现随着PGE2含量明显下降,与胃黏膜损伤有明显的负相关;同时还发现PGE2与胃黏膜血流量呈正相关,这提示PGE2可能是通过增加GMBF,提高防御能力的方式来起到保护胃黏膜作用。本实验发现在越高+Gz值暴露应激下PGE2的含量明显减少,保护作用减弱。其中A组(+1 Gz暴露)胃黏膜损伤最轻,PGE2浓度最低;而随着+Gz值暴露PGE2浓度逐渐降低,胃黏膜损伤逐渐加重,其中D组(+Gz连续暴露)胃黏膜损伤最重。由此可以推论,在高+Gz值暴露强烈应激下,交感神经兴奋性增强,黏膜下血管痉挛收缩,黏膜血供减少,局部组织缺血缺氧引起急性胃黏膜损伤。黏膜血供减少,PGE2合成受到抑制,PGE2分泌减少但PGE2作为对损伤刺激的保护性反应重要介质,为了不断刺激胃黏液的生成和分泌,促进HCO-3的分泌,增加表面磷脂的生成,为了不断加强胃黏膜屏障的疏水性,以及保护胃黏膜微循环结构的完整,维持胃黏膜血液供应,引起胃黏膜中PGE2进一步减少,导致在高+Gz暴露下胃黏膜的急性损伤进一步加重。本实验说明PGE2可能在低+Gz暴露时PGE2胃黏膜血流量降低小时能够一定程度地通过增加GMBF,提高防御能力的方式来起到保护胃黏膜作用[15]。在高+Gz暴露下胃黏膜缺血不断加重,PGE2的消耗量高于分泌量,导致PGE2对胃黏膜细胞的保护作用进一步减弱,胃黏膜损伤进一步加重。
EGF对维持胃肠道正常的生理功能具有重要作用。当胃肠道出现强烈应激时,体液中EGF的量往往低下[10],治疗后体液中 EGF 含量又会明显增高[16]。EGF主要由颌下腺分泌,切除颌下腺的大鼠胃黏膜损伤加重,补充EGF后胃黏膜损伤减轻,说明EGF对维护胃黏膜完整性起重要作用。无水乙醇引起黏膜血流量明显降低,胃黏膜血流量与黏膜损伤程度也呈负相关,注入外源性EGF后,胃黏膜血流量明显增加,提示EGF的快速保护作用可能与增加胃黏膜血流量有关[17]。应激性胃黏膜损伤的发生、发展与EGF有着密切联系,EGF能促进细胞增殖、分化和迁移,参与溃疡再上皮化,填充黏膜缺损,在再生黏膜内建上皮结构,增加胃黏膜血流量,并且能够显著抑制胃酸分泌[18]。许春娣等[19]报道外源性EGF可显著增加血流量并参于黏膜早期的修复。本实验研究结果显示,与A组(+1 Gz暴露)相比,在不同加速度的3个实验组中,以C组(+10 Gz暴露)和D组(+Gz连续暴露)大鼠胃黏膜损伤较重,B组(+5 Gz暴露)损伤较轻;相应的,+10 Gz组和重复暴露组胃液EGF表达明显较少,B组(+5 Gz暴露)表达轻度减少。不论是C组和D组还是B组,大鼠胃液EGF含量均较对照组少,考虑可能是机体对胃黏膜损伤的适应性保护反应,消耗内源性的EGF有关[17],随着+Gz暴露值的增加胃液EGF含量逐渐下降,而C组和D组EGF的含量明显低于A组(对照组),考虑可能是胃黏膜在模拟+Gz暴露这种应激状态下随着黏膜血流减少加剧,内源性的EGF消耗过多,胃黏膜分泌EGF减少,对胃黏膜的保护作用越弱,同时组织缺血和缺氧导致乳酸含量增加,酸中毒加剧组织细血管结构改变[6],加重胃黏膜损伤。
研究发现SS能够抑制多种胃肠激素的释放,抑制胰腺的外分泌和胆汁的分泌,抑制胃肠运动和胆囊收缩。SS参与调节胃肠道蠕动的上行性收缩和下行性松弛,作用于 B细胞使IgM合成增加,抑制IgA合成[20]。Shen等[21]报道急性缺氧时飞行员血浆 SS 水平升高,推测SS在缺氧时有调节心血管系统活性的作用。氧自由基对机体的主要毒性是引起细胞质膜发生脂质过氧化,SS可抑制应激引起的胃黏膜脂质过氧化的增强,SS在保护胃黏膜免遭应激引起的损伤的同时,也显著地抑制了胃黏膜丙二醛(MDA)含量的升高[22]。本研究显示,与A组(+1 Gz暴露)相比,B组(+5 Gz暴露)、C组(+10 Gz暴露)和D组(+Gz连续暴露)大鼠胃黏膜损伤逐渐加重,在高+Gz暴露中胃黏膜SS含量均相应显著升高[4],这可能与在高+Gz暴露强烈应激下,胃肠道血流减少,黏膜缺氧,代谢障碍,局部微循环改变,使黏膜内D细胞合成SS增加或细胞膜通透性增加,局部组织SS含量增加[6]。SS能降低动脉压,调节血管活性,改善微循环[21]。缺氧时局部胃肠道黏膜SS含量增加。因此,在高+Gz暴露强烈应激中生长抑素(SS)作为一种抑制性脑肠肽,对胃黏膜起着重要的保护作用。
不同+Gz值暴露应激状态下大鼠胃黏膜保护是一个抗损伤和修复的过程,多种物质包括均参与其中。大鼠胃黏膜对越高水平+Gz值暴露损伤产生抗损伤越大;作为保护因子的SS水平反应性增高,同时EGF、PGE2的含量减少。SS、EGF、PGE2在不同 +Gz值暴露胃黏膜应激过程中起到重要抗损伤作用,对其产生具体机理,有待于进一步研究。
[1]Zhang S,Liu HF,Zhang CG.Research progress in mechanism of stress-induced gastric mucosal lesions[J].World Chinese Journal of Digestology,2009,17(17):1697-1701.张爽,刘海峰,张成岗.应激性胃黏膜损伤发病机制的研究进展[J].世界华人消化杂志,2009,17(17):1697-1701.
[2]Yang M,Sun H,Yu DW,et al.Effects of the polysaccharides isolated from ganoderma applanatum(PGA)on the level of PGE2 and gastric mucosal blood flow(GMBF)and gastric mucus secretion of rats with gastric mucosa injury[J].China Journal of Chinese Materia Medica,2005,30(15):1176-1178.杨明,孙红,于德伟,等.树舌多糖对胃黏膜损伤大鼠胃黏膜PGE2含量及血流量和黏液分泌的影响[J].中国中药杂志,2005,30(15):1176-1178.
[3]Wang W,Sun M.New advance in rehabilitation and anti-damage of gastric intestinal mucosa[J].World Chin J Digestol,2005,13(19):2355-2359.王玮,孙梅.胃肠黏膜抗损伤和修复新进展[J].世界华人消化杂志,2005,13(19):2355-2359.
[4]Zhong XJ,Wu ZJ,Sun YP,et al.Changes of somatostatin(SS)in stomach and duodenum of rats after+Gz exposure[J].Space Medicine& Medical Engineering,2005,18(2):148-150.钟学军,吴战军,孙延平,等.+Gz值暴露后大鼠胃十二指肠黏膜及生长抑素含量的变化[J].航天医学与医学工程,2005,18(2):148-150.
[5]Zhao HL,Wu ZJ,Sun Y,et al.The research for prevention & treatment of the rats gastric mucosa injury induced by exposuring to high+Gz value[J].Prac J Med& Pharm,2010,27(6):545-547.赵洪礼,吴战军,孙跃,等.高+Gz值暴露对胃黏膜损伤的防治性研究[J].实用医药杂志,2010,27(6):545-547.
[6]Sun XQ,Zhang LF,Wu XY,et al.Effects of repeated brain ischemia induced by rapid lower body negative pressure on brain water and Na+,K+-ATPase activity in rats[J].Aviat Space Environ Med,2002,73(1):50-53.
[7]Sa JH,Zhu HM,Liu YH,et al.Effects of simulated push-pull maneuver on platelet adhesiveness,platelet aggregation and hemorheology in rats[J].J Fourth Mil Med Univ,2003,24(6):522-524.沙建慧,朱洪鸣,刘英华,等.模拟推拉动作对大鼠血小板粘附聚集和血液流变学的影响[J].第四军医大学学报,2003,24(6):522-524.
[8]Qu BG,Bi WM,et al.Effects of prostaglandin and interrelated growthfactors in gastritis[J].Mod Diagn Treat,2011,22(3):153-156.曲宝戈,毕维民,等.前列腺素和相关生长因子在胃炎中的作用[J].现代诊断与治疗,2011,22(3):153-156.
[9]Chen TL,Lin SL,Liu JC,et al.Effects of hyperbaric oxygen on prostaglandins in the cerebral tissue of guinea pigs during fast decompression[J].Journal of Navy Medicine,2003,24(2):97-99.陈铁楼,蔺世龙,刘景昌,等.高压氧对快速减压应激损伤动物脑组织PGs的作用研究[J].海军医学杂志,2003,24(2):97-99.
[10]Xu CD,Xi RP,Din HZ,et al.Experimental study of recombinant human epidermal growth factor on gastric mucosal protective effect[J].Chin J Pediatr,1997,35(12):635-638.许春娣,奚容平,丁红珍,等.基因重组人表皮生长因子对胃黏膜保护的实验研究[J].中华儿科杂志,1997,35(12):635-638.
[11]Liang SL,Mei YW,Xing HY,et al.The experimental study of acute stress gastric mucosal lesion induced by intracerebral hemorrhage[J].Stroke and Nervous Diseases,2007,14(4):214-216,219.梁顺利,梅元武,邢宏义,等.脑出血致急性应激性胃黏膜病变的实验研究[J].卒中与神经疾病,2007,14(4):214-216,219.
[12]Ranta-Knuuttila T,Mustonen H,Kivilaakso E.Topical prostaglandin E2 protects isolated gastric mucosa against acidified taurocholate-,but not ethanol-or aspirin-induced injury [J].Dig Dis Sci,2000,45(1):99-104.
[13]Konturek SJ,Robert A.Cytoprotection of canine gastric mucosa by prostacyclin:possible mediation by increased mucosal blood flow[J].Digestion,1982,25(3):155-163.
[14]Robert A,Nezamis JE,Lancaster C,et al.Mild irritants prevent gastric necrosis through“adaptive cytoprotection”mediated by prostaglandins[J].Am J Physiol,1983,245(1):G113-G121.
[15]Chen BW,Lin ZX,Cao ZX,et al.Adaptive cytoprotection-weak irritants prevent gastric injury and ischemia are mediated by prostaglandins[J].Chinese Journal of Digestion,1994,14(Suppl 1):26-29.陈宝雯,林兆鑫,曹之宪,等.适应性细胞保护作用-弱刺激剂预防胃损伤和缺血是通过前列腺素介导的[J].中华消化杂志,1994,14(Suppl 1):26-29.
[16]Akbulut KG,Gönül B,Türkyilmaz A,et al.The role of epidermal growth factor formulation on stress ulcer healing of the gastric mucosa[J].Surg Today,2002,32(10):880-883.
[17]Hui WM,Chen BW,Kung AW,et al.Effect of epidermal growth factor on gastric blood flow in rats:possible role in mucosal protection[J].Gastroenterology,1993,104(6):1605-1610.
[18]Konturek S.Gastroenterd[J].Clin North Am,2002,19:41-65.
[19]Xu CD,Yuan YZ,Chen SN,et al.Relationship between content changes of epidermal growth factor(EGF)in body juice and healing of peptic ulcer[J].Shanghai Med J,2000,23(5):296-298.许春娣,袁耀宗,陈瞬年,等.体液中表皮生长因子水平变化与消化性溃疡愈合的关系[J].上海医学,2000,23(5):296-298.
[20]Tian DF,Wang YH,Ren HX.Research status of gastrointestinal hormones[J].Chinese Journal of Biochemical Pharmaceutics,2000,21(6):316-318.田德峰,王彦辉,任慧霞.胃肠激素的研究概况[J].中国生化药物杂志,2000,21(6):316-318.
[21]Shen D,Wang Y.Changes of plasma level of neurotensin,somatostatin,and dynorphin A in pilots under acute hypoxia[J].Mil Med,1998,163(2):120-121.
[22]Li T,Zhang XJ.Protective effects of somatostatin on gastric mucosa may be related to scavenging free radicals[J].Acta Physiologica Sinica,1994,45(4):369-374.李铁,张席锦.生长抑素对胃粘膜的保护作用可能与清除自由基有关[J].生理学报,1994,45(4):369-374.

