棘孢木霉生物防治相关代谢产物研究
杨 萍,杨 谦,许 倩
(1.哈尔滨工业大学环境科学与工程系,哈尔滨150050;2.哈尔滨商业大学 食品工程学院,哈尔滨150076;3.塔里木大学生命科学学院,阿拉尔843300)
棘孢木霉(T.asperellum)是重要的生物防治真菌,对多种植物病原菌具有拮抗作用,能分解纤维素,是重要的生防菌株.近年来研究发现:棘孢木霉(T.asperellum)有助于植物抵抗终极腐霉菌(Pythium ultimum)[1],可 抑 制 奇 异 根 串 珠 霉(Thielaviopsis paradoxa)导致的菠萝黑腐病[2],防治群结腐霉菌产生的根腐病[3],对立枯丝核菌有拮抗作用[4],可抑制菠萝上的奇异根串珠霉(Thielaviopsis paradoxa)[5].另外,利用棘孢木霉(T.asperellum)处理的菌核菌的菌丝体和细胞壁发生变化,且处理后的菌核菌致病力明显降低[6-8].棘孢木霉(T.asperellum)与菌根真菌共同作用可促进植物防御体系,抵抗黑荚果病[9].
目前,对于棘孢木霉(T.asperellum)生防代谢物的研究主要有三种,分别为细胞壁水解酶几丁质酶,外切β-1,3-葡聚糖酶,N-乙酰氨基葡萄糖苷酶.宋金柱对棘孢木霉(T.asperellum)生防相关几丁质酶基因的克隆和表达进行了研究[10].Nguyen等对棘孢木霉(T.asperellum)几丁质酶的抗菌活性进行了研究,研究表明棘孢木霉(T.asperellum)几丁质酶有强烈的降解微生物细胞壁的功能.Kumar等从棘孢木霉(T.asperellum)UTP-16中克隆得到外切几丁质酶基因[11].Marcello等克隆得到了外切 β -1,3 - 葡聚糖酶基因[12].Ramot等分离得到两个N-乙酰氨基葡萄糖苷酶[13].对于棘孢木霉(T.asperellum)其他水解酶和抗生素的研究尚未见报道.
1 菌株
棘孢木霉(T.asperellum)T4菌株保藏于中国普通微生物菌种保藏管理中心,菌种保藏号为:CGMCC3.14975;立枯丝核菌(R.solani)、杨树烂皮病菌(Cytospora chrysosperma)、尖孢镰刀菌(Fusarium oxysporum)、杨树叶枯病菌(Alternaria alternata)均为哈尔滨工业大学生命科学与工程学院微生物实验室保存.
2 实验方法
立枯丝核菌细胞壁的制备:将立枯丝核菌(R.solani)接种于PDA平板上于28℃恒温培养5 d后,在平板上打孔取菌块,转接到PD液体培养基中,28℃,200 r/min振荡培养5 d后,5 000 r/min离心10 min,弃上清液,用无菌水清洗菌体数次,弃上清液,沉淀物吸干水分,用液氮冷冻后研磨成粉末状,于121℃条件下灭菌15 min,即得病原菌细胞壁.
粗酶液制备:用PD培养基从培养5~7 d的PDA平板上洗下棘孢木霉野生型的分生孢子,稀释至孢子浓度为107个/mL,取1 mL的孢子悬液至1.5 mL离心管中,28℃条件下200 r/min振荡培养24 h后,接种至100 mL的细胞壁诱导培养基中,28℃条件下200 r/min振荡培养一定时间后,取1 mL培养液经5 000 r/min离心5 min,上清液即为粗酶液.
β-1,3葡聚糖酶酶活的测定:取0.1 mL粗酶液(以经煮沸5min的粗酶液作为阴性对照)加入0.1%的昆布多糖溶液0.4 mL,在40℃条件下水浴30 min,沸水浴 5 min灭酶,然后加入 0.25 mLDNS,沸水浴5 min,立刻用流动水冷却,于530 nm处比色,用葡萄糖标准曲线换算出酶活力,实验设三个重复.
纤维素酶酶活的测定:取0.5 mL粗酶液(以经煮沸5 min的粗酶液作为阴性对照)加入0.5%CMC溶液1 mL,在50℃条件下水浴30 min,加入2 mL DNS,沸水浴10 min,立刻用流动水冷却,于530 nm处比色,用葡萄糖标准曲线换算出酶活力,实验设三个重复.
几丁质酶活性测定参照参考文献[14];N-乙酰-氨基葡萄糖苷酶酶活的测定参照参考文献[15].
棘孢木霉抗真菌代谢物对病原菌的抑制作用:用无菌水洗下培养7 d的棘孢木霉的分生孢子,分别取1×107个/mL的孢子悬浮液1 mL接种至200 mL PD液体培养基中培养7 d,离心取上清液,用0.22μm滤膜过滤除菌,得到棘孢木霉野生型的发酵液.取发酵液与冷却至50℃的2×PDA培养基混匀倒平板,冷却后在培养基中间分别放四种致病菌的菌饼,置于28℃培养5 d,以无菌水处理作为对照,每个处理设置三个重复.
棘孢木霉抗生素6-戊基-α-吡喃酮产量的测定:采用气相色谱质谱分析,参照参考文献[16].
3 结果与讨论
3.1 不同碳源条件下棘孢木霉几丁质酶的酶活
将活化的棘孢木霉接种至1%不同碳源的诱导培养基中,恒温振荡培养6、12、24、48 h取样,测定几丁质酶的酶活,几丁质酶的产量如图1.
几丁质酶是催化几丁质水解生成N-乙酰-氨基葡糖苷反应的酶.几丁质是病原菌细胞壁的主要成分之一,棘孢木霉可以通过产生几丁质酶来水解病原菌细胞壁.从图1可以看出:在两种碳源诱导情况下,几丁质酶活性随时间的延长而增加,在诱导12 h之后以立枯丝核菌细胞壁为碳源的几丁质酶活性迅速增加,明显高于几丁质为碳源的情况,说明立枯丝核菌细胞壁水解物对棘孢木霉几丁质酶活性有诱导作用.
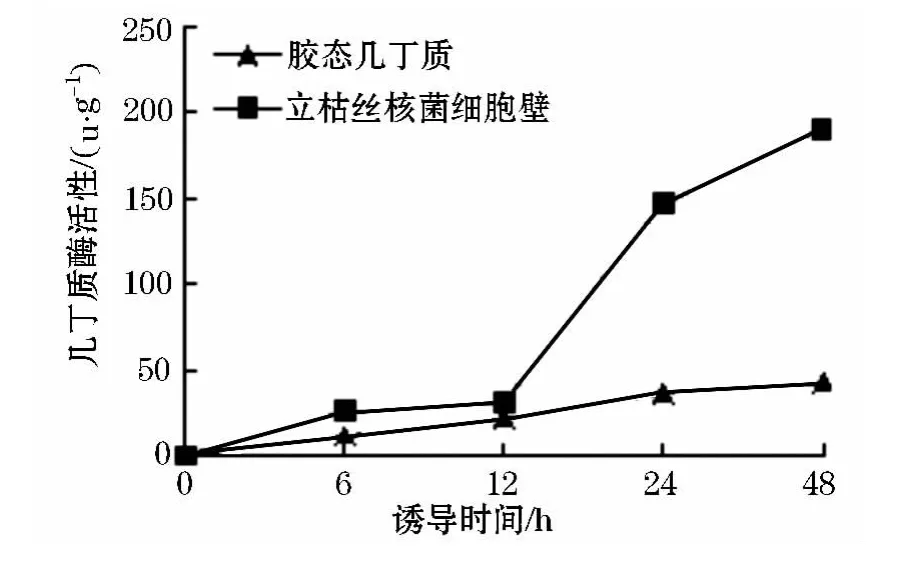
图1 不同碳源诱导条件下棘孢木霉几丁质酶酶活变化
3.2 不同碳源条件下棘孢木霉N-乙酰-氨基葡萄糖苷酶的酶活
将活化的棘孢木霉接种至1%不同碳源的诱导培养基中,恒温振荡培养6、12、24、48 h取样,测定N-乙酰-氨基葡萄糖苷酶的酶活,测定N-乙酰-氨基葡萄糖苷酶的活性,其产量如图2所示.

图2 不同碳源诱导条件下棘孢木霉N-乙酰-氨基葡萄糖苷酶酶活变化
N-乙酰氨基葡萄糖苷酶是既能水解N-乙酰-氨基葡萄糖苷,也能水解N-乙酰-氨基半乳糖苷的酶.从图2可以看出:在三种碳源诱导情况下,N-乙酰-氨基葡萄糖苷酶活性随时间的延长而增加;在诱导12 h之前,N-乙酰氨基葡萄糖苷为碳源的情况下,N-乙酰-氨基葡萄糖苷酶活性明显高于立枯丝核菌细胞壁和胶态几丁质为碳源的情况,在诱导12 h之后,以立枯丝核菌细胞壁为碳源的N-乙酰-氨基葡萄糖苷酶活性迅速增加,高于其他两种碳源,说明立枯丝核菌细胞壁水解物可以诱导N-乙酰-氨基葡萄糖苷酶活性.
3.3 不同碳源条件下棘孢木霉N-乙酰氨基葡萄糖苷酶的酶活
将活化的棘孢木霉接种至1%不同碳源的诱导培养基中,恒温振荡培养6、12、24、48 h取样,测定β-1,3葡聚糖酶的酶活,测定β-1,3葡聚糖酶的活性,产量如图3.
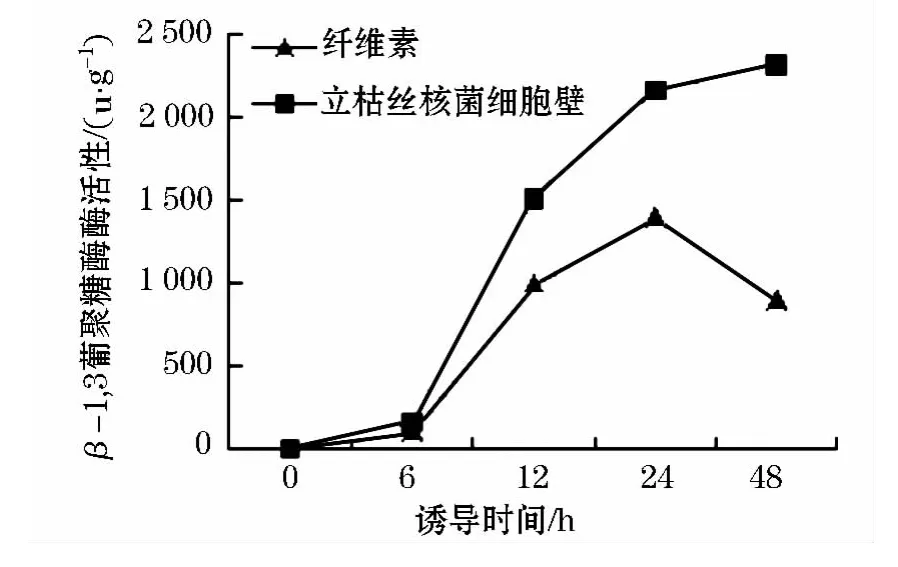
图3 不同碳源诱导条件下棘孢木霉β-1,3葡聚糖酶酶活变化
β-1,3葡聚糖是病原菌细胞壁的主要成分之一,棘孢木霉通过产生β-1,3葡聚糖酶来水解病原菌细胞壁.从图3可以看出:在两种碳源诱导情况下,β-1,3葡聚糖酶活性随时间的延长而增加,在诱导6 h之后,以立枯丝核菌细胞壁为碳源的β-1,3葡聚糖酶活性迅速增加,明显高于纤维素为碳源的情况,说明立枯丝核菌细胞壁水解物对棘孢木霉β-1,3葡聚糖酶活性有诱导作用.
3.4 不同碳源条件下棘孢木霉N-乙酰氨基葡萄糖苷酶的酶活
将活化的棘孢木霉接种至不同碳源的诱导培养基中,恒温振荡培养6、12、24、48 h取样,测定纤维素酶的酶活,产量如图4.
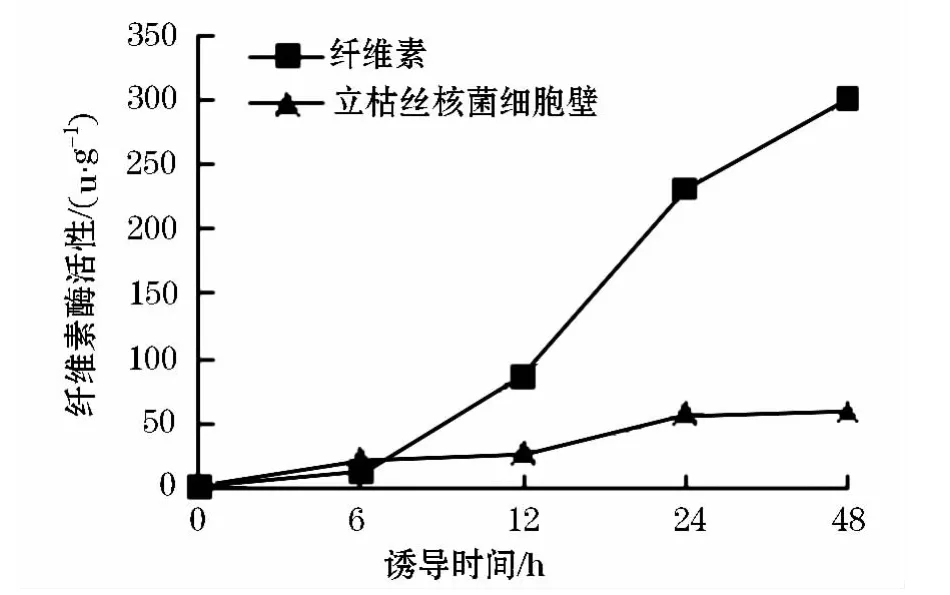
图4 不同碳源诱导条件下棘孢木霉纤维素酶酶活变化
病原菌细胞壁中含有少量纤维素.纤维素酶是水解纤维素成小分子物质的酶,棘孢木霉通过分泌纤维素酶水解病原菌细胞壁中的纤维素,破坏病原菌细胞壁.纤维素酶是由多种水解酶组成的一个复杂酶系,人们习惯将纤维素酶分成三类:C1酶、Cx酶和β-葡糖苷酶,C1酶是破坏纤维素链的结晶结构的酶;Cx酶是作用于经C1酶活化的纤维素、分解其β-1,4-糖苷键的酶;β-葡糖苷酶可以将纤维二糖、纤维三糖及其他低分子纤维糊精分解为葡萄糖.
从图4可以看出:在两种碳源诱导情况下,纤维素酶活性随时间的延长而增加,在诱导6 h之后,以立枯丝核菌细胞壁为碳源的纤维素酶活性迅速增加,明显高于纤维素为碳源的情况,说明立枯丝核菌细胞壁水解物对棘孢木霉纤维素酶活性有诱导作用.

图5 棘孢木霉代谢物对病原菌生长的抑制作用
3.5 棘孢木霉代谢物对病原菌生长的抑制
切取预培养5 d的立枯丝核菌,尖孢镰刀菌,杨树烂皮病菌和杨树叶枯病菌分别接种于含棘孢木霉发酵液的PDA培养基中培养5 d,以无菌水处理作为对照,结果如图5所示.
从图5可以看出:棘孢木霉的代谢产物对四种致病菌生长均有一定的抑制作用,对立枯丝核菌,尖孢镰刀菌和杨树叶枯病菌的抑制作用较强,对杨树烂皮病菌的抑制作用较弱,说明棘孢木霉代谢产物中含有抗真菌作用的物质.
3.6 棘孢木霉产生的抗生素6-戊基-α-吡喃酮的产量
切取预活化的棘孢木霉菌饼接种至覆盖玻璃纸的PDA培养基上培养5 d,去除玻璃纸,用乙酸乙酯萃取培养基中的抗生素,无水硫酸钠去除水分,经0.45μm滤膜过滤,取1μL样品进行气相色谱质谱分析.与标准品作对比,6-戊基-α-吡喃酮标准品的保留时间为7.72 min.棘孢木霉代谢产生的6-戊基-α-吡喃酮的量为1.32 mg/g菌丝干重.
4 结语
棘孢木霉(T.asperellum)是重要的生物防治菌,通过竞争作用、重寄生作用、抗生作用、诱导植物抗病性、促进植物生长和协同拮抗等机制防治植物土传病菌的危害。在生物防治过程中产生多种代谢产物,本文对与生物防治相关的代谢产物进行研究,得出了在不同碳源诱导条件下,细胞壁水解酶几丁质酶、外切β-1,3-葡聚糖酶、N-乙酰氨基葡萄糖苷酶和纤维素酶都随时间的延长而增加;棘孢木霉代谢产物对病原菌尖孢镰刀菌、立枯丝核菌、杨树烂皮病菌和杨树叶枯病菌都有抑制作用,并确定了了棘孢木霉代谢产生的抗生素6-戊基-α-吡喃酮的产量为1.32 mg/g菌丝干重.
[1]CALVET C,PERA J,BAREA J M.Growth response of marigold(Tagetes erecta L.)to Inoculation with Glomus mosseae,Trichoderma aureoviride and Pythium ultimum in a peat-perlite mixture[J].Plant and Soil,1993,148(1):1 - 6.
[2]WIJESINGHE C J,WIJIERATNAM R W,SAMARASEKARA J R,etal.Development of a formulation of Trichoderma asperellum to control black rot disease on pineapple caused by(Thielaviopsis Paradoxa)[J].Crop Protection,2011,30(3):300 -306.
[3]MBARGA J B,HOOPEN G T,ADIOBO J A,etal.Trichoderma asperellum:A potential biocontrol agent for Pythium myriotylum,causal agent of cocoyam(Xanthosoma sagittifolium)root rot disease in Cameroon[J].Crop Protection,2012,36:18 -22.
[4]夏 伟,张 红,颜艳伟,等.棘孢木霉L4对立枯丝核菌的拮抗机制[J].植物保护学报,2010,37(5):477 -478.
[5]WIJIESINGHE CJ,WIJIERATNAMRW,SAMARASEKARA J R,etal.Biological control of Thielaviopsis paradoxa on pineapple by an isolate of Trichoderma asperellum[J].Biological Control,2010,53(3):285 -290.
[6]孙冬梅,杨 谦,张军政.黄绿木霉诱变菌株对大豆根腐病镰刀菌的拮抗[J].大豆科学,2005,24(3):171 -175.
[7]孙冬梅,杨 谦,宋金柱.黄绿木霉菌代谢产物对大豆菌核病核盘菌的抑菌能力研[J].天然产物研究与开发,2005,17(6):691-695.
[8]孙冬梅,杨 谦,宋金柱.黄绿木霉菌代谢产物对杨树烂皮病菌抑菌能力的研究[J].北京林业大学学报,2006(1):76-79.
[9]TCHAMENI S N,NGONKEU M L,BEGOUDE B D,etal.Effect of Trichoderma asperellum and arbuscular mycorrhizal fungi on cacao growth and resistance against black pod disease[J].Crop Protection,2011,30(10):1321-1327.
[10]SONGJin-Zhu,YANGQian,LIU Bei-Dong,etal.Expression of the chitinase gene from Trichoderma aureoviride in Saccharomyces cerevisiae[J].Applied Microbiology and Biotechnology,2005,69(1):39-43.
[11]KUMAR D P,RAJESH K S,ANUPAMA P D,etal.Studies on Exo-Chitinase production from Trichoderma asperellum UTP-16 and its characterization[J].Indian Journal of Microbiology,2012,52(3):388 -395.
[12]MARCELLO CM,ANDREI SS,SILVANA PDTROFEZA DA S,etal.Expression analysis of the exo-β-1,3-glucanase from the mycoparasitic fungus Trichoderma asperellum[J].Microbiological Research,2010,165(1):75-81.
[13]RAMOT O,VITERBO A,FRIESEM D,etal.Regulation of two homodimer hexosaminidases in the mycoparasitic fungus Trichoderma asperellum by glucosamine[J].Current Genetics,2004,45(4):205-213.
[14]陈 艳.双链RNA介导的哈茨木霉mapk和rac基因沉默[D].哈尔滨:哈尔滨工业大学,2009.
[15]HARMAN G E,HAYESC K,LORITO M,etal.Chitinolytic enzymes of Trichoderma harzianum:purification of chitobiosidase and endochitinase[J].Phytopathology,1993,83:313 -318.
[16]REITHNER B,BRUNNER K,SCHUHMACHER R,etal.The Gprotein alpha subunit Tga1 of Trichoderma atroviride is involved in chitinase formation and differential production of antifungal metabolites[J].Fungal Genetics Biology,2005,42(9):749-760.

