采用超声骨刀在局部麻醉下行外科辅助上颌骨快速扩弓术的临床应用
刁晓洁 李彪 孙昊 柳稚旭 王旭东
1.新疆维吾尔自治区中医医院口腔科,乌鲁木齐 830000;2.上海交通大学医学院附属第九人民医院口腔颅颌面科;上海市口腔医学重点实验室,上海 200011
上颌骨横向发育不足的成年患者的骨骼骨化程度高,弹性差,经单纯的正畸扩弓往往不能满足治疗要求,应用外科辅助上颌骨快速扩弓(surgically assisted rapid maxillary expansion,SARME)技术可以达到治疗的目的[1]。SARME的手术方式多采用腭中缝截骨术+侧方骨皮质切开术+双侧翼颌连接截骨术[2]。传统治疗中,常采用电动或气动动力系统完成手术,因其创伤大,出血多,震动感强烈,故手术要在全身麻醉下进行。近年来,骨外科手术设备中引进了新的动力系统——超声骨刀,因其不损伤软组织,同时具有创伤小,切割精确等特点,已在口腔上颌窦提升手术、根尖囊肿刮治术等手术中获得广泛应用[3-5]。本研究尝试在局部麻醉下应用超声骨刀行SARME手术,并行超声骨刀术中感觉评价问卷调查,对患者术中的感受进行调查,以对该技术的可行性进行评价和验证。
1 材料和方法
1.1 病例资料
选择2011年3月—2012年7月于上海交通大学医学院附属第九人民医院口腔颅颌面科治疗的14例上颌骨横向发育不足患者为研究对象。14例患者中,男性6例,女性8例,年龄18~20岁,其中唇腭裂患者1例。所有患者均表现为前牙拥挤,上颌骨横向发育不足,上颌牙弓宽度不足,上下牙弓比例不协调,牙弓宽度相差5.5~7.5 mm,平均6.5 mm。经与正畸医生讨论,14例患者的临床表现均符合SARME适应证,确定需要采用SARME法配合正畸治疗以纠正上颌骨横向发育不足。正畸医生于术前1周在患者口内安置牙支持式扩弓器(Hyrax tooth-born appliance或Haas tooth-born appliance)。
1.2 手术设备
SARME手术应用法国赛特力超声骨刀PiezotomeTM进行,超声骨刀的选定频率为28~36 kHz,冷却系统的功率为40 W。
1.3 SARME手术及麻醉方法
患者仰卧位,常规消毒铺巾,牵张上唇使之紧绷,以利于穿刺时减少疼痛。在双侧上颌前庭沟处注射1%利多卡因约5 mL(含1∶100 000肾上腺素),先注射少量于黏膜内形成一小皮丘,再由浅至深分层注射至手术区域组织中,最终到达骨面,以利于骨膜剥离(图1a);然后用阿替卡因肾上腺素注射液(法国碧兰公司)在切牙孔、双侧腭大孔、双侧上颌结节处分别行鼻腭神经、腭前神经、上牙槽后神经阻滞麻醉,注射剂量分别为0.1、0.2、0.2 mL。待麻醉显效后,在上颌14—24位置前庭沟上方处做飞鸟形切口,切开黏膜、黏膜下层、肌层、骨膜,用剥离子剥离骨膜,翻瓣显露骨面,暴露梨状孔、鼻前棘、上颌窦前外侧壁、颧牙槽嵴,并沿上颌结节的弧形骨面,向后潜行剥离直达翼上颌连接处。翻瓣后,直视下在双侧眶下孔处注射阿替卡因肾上腺素注射液0.1 mL进行眶下神经阻滞麻醉。用剥离子在梨状沟分离鼻中隔前份黏骨膜,显露骨性鼻底前份,保护黏膜,用超声骨刀做上颌骨侧方骨皮质切开,自梨状孔水平向两侧至翼上颌连接处截骨(图1b、c)。咬骨剪剪断鼻前棘,超声骨刀截开鼻中隔软骨。在梨状孔下缘正中至11和21之间的牙槽嵴处用超声骨刀垂直截骨。此时采用超声骨刀截骨的工作完成,改用骨凿,在一些关键部位加强截骨,以确保截骨处完全截开。先用4 mm骨凿沿11和21之间截骨线向鼻底方向垂直凿入,方向偏向硬腭,凿入1.5 cm;再往牙槽嵴顶方向凿一下,凿的同时用食指抵在腭皱襞处保护,以免腭部黏膜穿通;再换用8 mm骨凿向后凿入,听到锤子敲击骨凿的声音从实声变为虚声表明腭中缝被劈开,撬动骨凿,可见到11、21之间牙缝增宽。用弯骨凿顺着上颌结节后方伸入翼上颌裂处,骨凿向前向下凿入,当离断翼上颌连接时也会听到锤击声音的改变。因为使用骨凿凿骨时会产生一定的震动感,所以使用骨凿的步骤均放在最后迅速完成,以减少患者的痛苦。截骨完毕,侧方骨皮质、腭中缝和翼上颌连接3条截骨线均被截开(图1d)。术中患者清醒,配合手术,出现疼痛时,随时追加阿替卡因肾上腺素注射液。
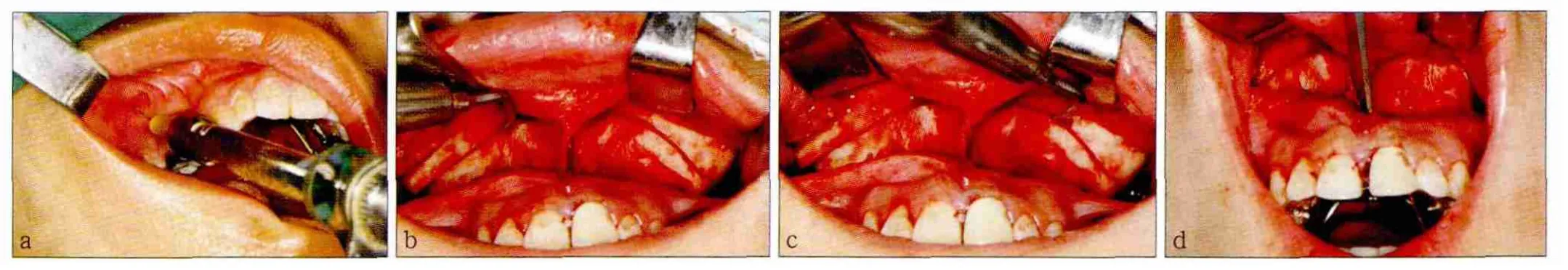
图1 采用超声骨刀行SARME手术的过程Fig 1 Using piezosurgery for SARME operation
1.4 问卷调查
术后1周内对患者进行超声骨刀术中的感觉进行问卷调查,调查项目包括术区震动感,声音畏惧感,术区疼痛感,牙齿酸痛感和牙齿麻木感。回答以患者的自我感觉为主,分值设为0、1、2、3,分别代表无感觉,轻度、中度和重度感觉。
1.5 模型测量
手术前及手术后6个月采用游标卡尺在患者模型上测量上颌尖牙、第一前磨牙和磨牙间宽度;上颌尖牙宽度为两侧上颌尖牙(13—23)牙尖之间的距离,上颌第一前磨牙宽度为两侧第一前磨牙(14—24)颊尖之间的距离,上颌磨牙宽度为两侧磨牙(16—26)近中颊尖之间的距离。
2 结果
所有患者的SARME手术均在门诊手术室采用局部麻醉完成。术中患者均耐受并配合手术。每例患者术中出血量约30 mL,均未形成血肿;患者术后反应较小,术区有轻度肿胀,未发生感染,切口愈合良好。术后1周,采用问卷调查方式了解患者在局部麻醉下接受超声骨刀截骨术的感受,其结果见表1:8例患者(占57.14%)在术中没有感觉或仅感觉到轻度的超声骨刀震动感;12例患者(占85.71%)在术中没有或仅感觉到轻度的疼痛和牙齿酸痛;11例患者(占78.57%)对超声骨刀的声音无畏惧感或仅有轻度畏惧感;这些结果表明大部分患者可以耐受在局部麻醉下进行此手术。患者术前和术后6个月牙弓的宽度见表2,可以看出手术扩弓的效果非常明显。术后随访CT可见上颌骨腭中缝被扩开的缝隙及成骨情况(图2)。比较术前术后口内照片可见,扩弓后双侧中切牙间隙增大,牙弓变宽(图3、4)。
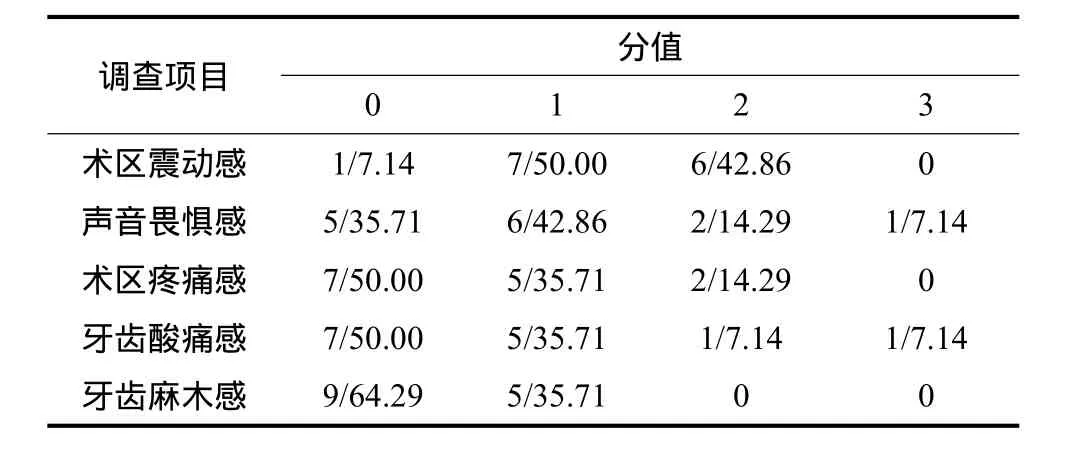
表1 SARME术中患者自我感觉评价结果Tab 1 The patients’ feeling during SARME operation n/%
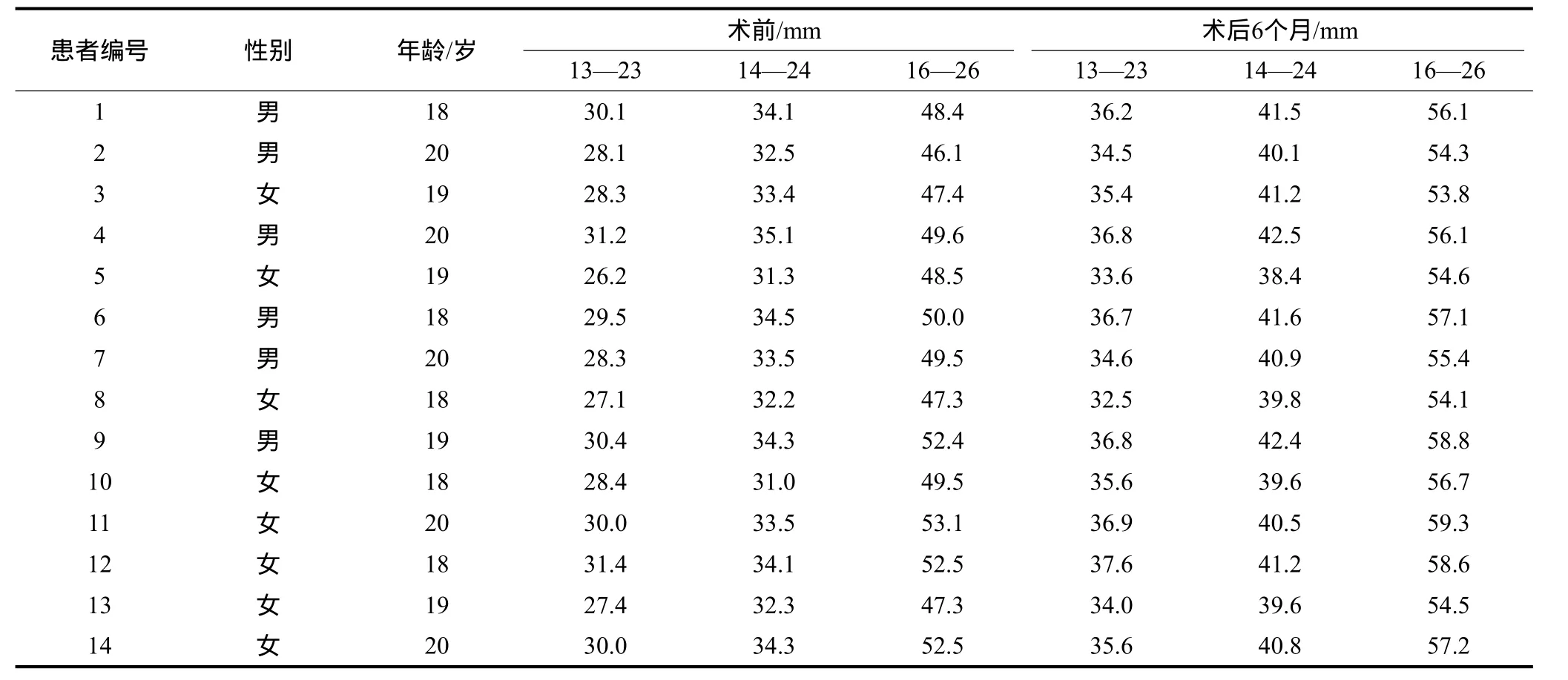
表2 术前术后患者牙弓宽度的变化Tab 2 Width of arch in maxillary pre- and post-operation
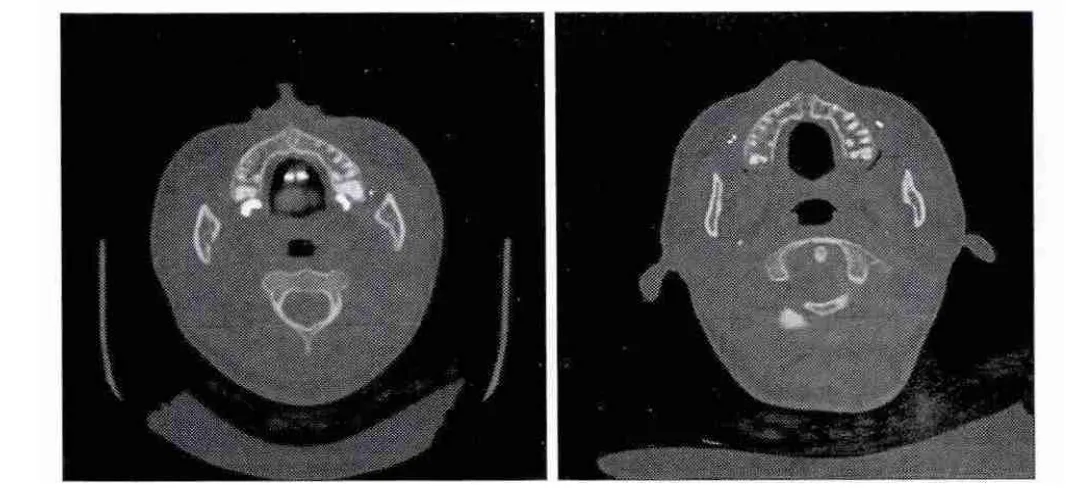
图2 患者术前(左)和术后6个月(右)的CT片Fig 2 CT imaging preoperatively (left)and six months postoperatively (right)
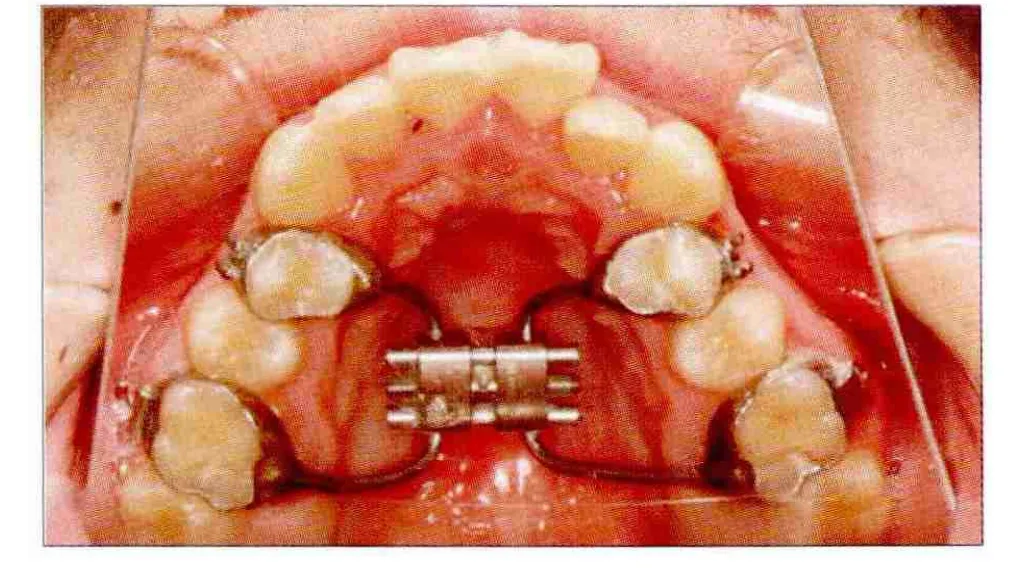
图3 患者术前的口内像Fig 3 Intraoral view preoperatively
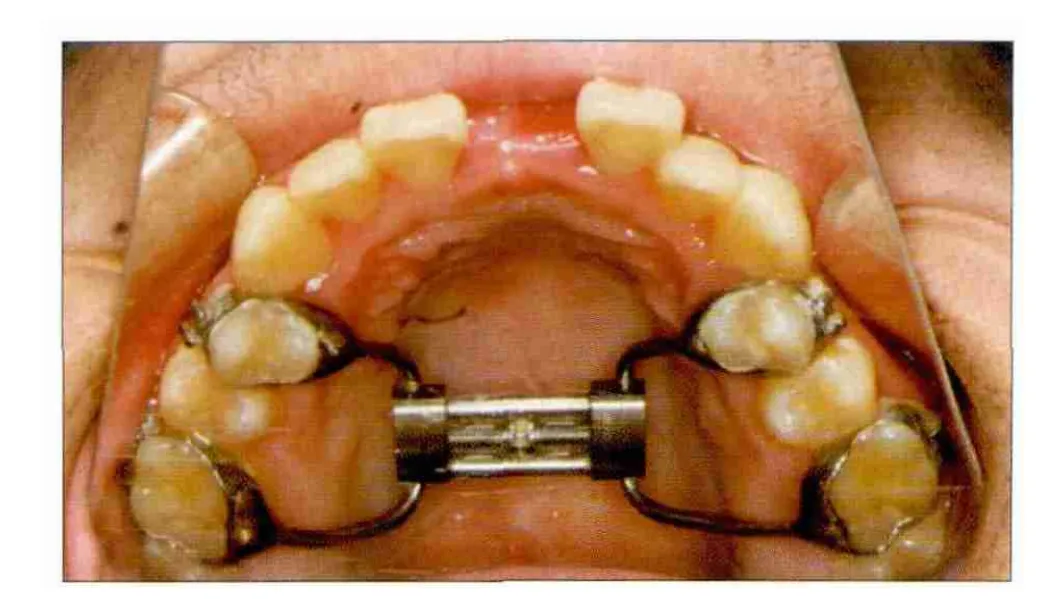
图4 患者术后6个月的口内像Fig 4 Intraoral view six months postoperatively
3 讨论
对于上颌骨横向发育不足,牙弓缩窄,牙列拥挤的患者,正畸治疗时通过扩大牙弓的方法可以获得牙弓间隙,解除拥挤。上颌快速扩弓(rapid maxillary expansion,RME)技术是正畸治疗上颌牙弓狭窄所采用的一种扩大牙弓的经典方法,应用黏固在牙齿上的快速扩弓矫治器来扩展上颌腭中缝,刺激骨缝内新骨沉积。对多数患者来说,18岁以前扩展腭中缝是有效的,随着年龄的增长,腭中缝骨融合逐渐致密,扩展腭中缝变得非常困难,此时需要借助外科手术的手段。SARME技术是应用外科截骨术松解颅面部存在阻力的骨骼结构并将上颌骨不完全离断,然后依赖扩弓器快速而稳定地打开上颌骨的技术。SARME的适应证包括:1)单侧上颌骨狭窄[6];2)只有上颌骨横向发育不足,无其他骨畸形,需增加牙弓长度,纠正后牙反;3)当扩弓量大于5 mm时,需先行SARME扩开上颌牙弓,为正颌外科手术做准备;4)腭裂继发上颌骨发育不全的扩弓治疗;5)存在上颌牙弓狭窄,但无拔牙指征;6)使用快速扩弓技术扩开腭中缝失败后[7];7)上颌骨横向发育不足并伴有鼻中隔偏曲或阻塞性睡眠呼吸暂停综合征[8];8)在成年人正畸治疗中为减少牙齿疼痛及减轻牙周并发症[9]。本研究中14例患者均为上颌骨横向发育不足的成年人,若单纯采用正畸方法,其矫治力量已经不能满足治疗的需求,需要采用SARME手术。SARME手术时,颅面部的主要阻力存在于前方的梨状孔支柱、侧方的颧突支柱、后方的翼颌连接和中央的骨化腭中缝[7]。本研究采用腭中缝截骨术+侧方骨皮质切开术+双侧翼颌连接截骨方式,将上颌骨内部连接离断又不使上颌骨移位。很多学者的研究证明,采用这种手术方式离断翼上颌连接后,颅面多数部位的应力下降,可以很好地保护颅底的重要解剖结构,以避免出现颅底骨折并发症[10-12]。对于SARME是否可在局部麻醉下离断翼上颌连接,国外医生存在争议:部分医生不主张离断,认为离断翼上颌连接时视野不清,容易出现术中出血[13-14];但是还有人认为如果离断翼上颌连接,就可以达到很好的上颌腭中缝扩弓效果[15-16]。本研究中手术前对患者的牙弓不调进行了分析,明确牙弓不调在前部还是后部。如果集中在前部,手术时不离断翼上颌连接;如果经过分析,牙弓后部也需要扩弓,则需要离断翼上颌连接。本研究中,未出现离断时出血的情况,尚需更多病例的观察和经验累积。
传统SARME术的截骨动力系统是电动或气动骨锯,创伤大,出血多,手术通常在全身麻醉下进行。近年来,随着超声骨刀技术的发展,超声骨刀已成为传统骨切割技术之外的一个新选择。超声骨刀目前已经在一些口腔门诊手术,如上颌窦提升手术、根尖囊肿刮治术、牙周手术、牙槽外科手术中广泛应用。超声骨刀创伤小,切割精确,切割创面清晰整齐,有利于创口愈合;工作尖具有多种角度的设计,符合解剖形态;60~200 μm振幅的微震动确保了只有硬组织被切割。工作时选用频率为28~36 kHz,这个频率可使截骨时软组织和神经组织免于受损[17];只有当频率大于50 kHz时,才有可能对软组织产生创伤[18-19]。在SARME术中,上颌骨骨壁较薄,用超声骨刀在上颌窦区切割时,降低了上颌窦黏膜损伤的危险,减少了手术创伤和出血,使SARME在门诊局部麻醉下实施成为可能。但是,超声骨刀和其他骨刀一样,工作时会发出声音和震动感。本研究中对术中患者的感受进行调查,结果表明:50.00%的患者感到术中超声骨刀截骨时有轻度震动感,42.86%感到有中度震动感,7.14%无明显震动感;术中对超声骨刀发出的声音有轻度畏惧感的患者占42.86%,中度占14.29%,无声音畏惧感的占35.71%。这些结果说明,大部分患者可接受超声骨刀的震动和发出的声音,也提示外科医生术前需告知患者术中能够听到骨刀的声音并有震动感,以便让患者有充分的心理准备。
因为超声骨刀的特性,笔者尝试采用局部麻醉进行手术。1%利多卡因溶液和阿替卡因肾上腺素注射液中均含有低体积分数的血管收缩剂——肾上腺素,有延缓麻醉药物吸收,降低毒性反应,延长麻醉时间和减少组织出血的作用。本研究术中采用分次、少量、多点注射的方式给予两种局部麻醉药物,结合局部浸润和神经阻滞麻醉两种方式,获得了很好的麻醉效果。经调查,50.00%的患者在术中不感觉疼痛,35.71%感轻微疼痛,仅14.29%有中度疼痛。患者术中清醒,可以配合手术,与全身麻醉相比较,局部麻醉手术风险小,更安全。
本研究中,通过对14例上颌骨横向发育不足的患者在局部麻醉下用超声骨刀行SARME手术,达到了与全身麻醉手术相同的扩弓效果。手术均在门诊手术室完成,手术带来的创伤、疼痛及术中超声骨刀的声音都能被患者耐受。采用这种方式进行麻醉及手术,减轻了患者的痛苦和恐惧,减少了手术风险;此外,患者不需住院治疗,节省了费用和时间,也节省了医院的成本和时间。由此可见,这种方式下行SARME手术是可行的,但仍需要更多病例的实践和更长时间的随访来验证其效果。
[1]Silverstein K, Quinn PD. Surgically-assisted rapid palatal expansion for management of transverse maxillary de fi ciency[J]. J Oral Maxillofac Surg, 1997, 55(7):725-727.
[2]Holberg C, Steinhäuser S, Rudzki I. Surgically assisted rapid maxillary expansion: midfacial and cranial stress distribution[J]. Am J Orthod Dentofacial Orthop, 2007, 132(6):776-782.
[3]Delilbasi C, Gurler G. Comparison of piezosurgery and conventional rotative instruments in direct sinus lifting[J].Implant Dent, 2013, 22(6):662-665.
[4]Canullo L, Peñarrocha D, Peñarrocha M, et al. Piezoelectric vs. conventional drilling in implant site preparation: pilot controlled randomized clinical trial with crossover design[J]. Clin Oral Implants Res, 2013. doi: 10.1111/clr.12278.
[5]Marconcini S, Barone A, Perrini N, et al. Conservative treatment of unicystic odontogenic keratocyst by piezosurgery approach. A case report [J]. Minerva Stomatol, 2014. [Epub ahead of print].
[6]Bailey LJ, White RP Jr, Prof fi t WR, et al. Segmental Le FortⅠ osteotomy for management of transverse maxillary defi ciency[J]. J Oral Maxillofac Surg, 1997, 55(7):728-731.
[7]Suri L, Taneja P. Surgically assisted rapid palatal expansion:a literature review[J]. Am J Orthod Dentofacial Orthop, 2008,133(2):290-302.
[8]姜文辉, 王旭东. 外科手术辅助上颌骨快速扩弓的治疗进展[J]. 口腔颌面外科杂志, 2009, 19(6):431-435.
[9]Deeb W, Hansen L, Hotan T, et al. Changes in nasal volume after surgically assisted bone-borne rapid maxillary expansion[J]. Am J Orthod Dentofacial Orthop, 2010, 137(6):782-789.
[10]Holberg C, Steinhäuser S, Rudzki I. Surgically assisted rapid maxillary expansion: midfacial and cranial stress distribution[J]. Am J Orthod Dentofacial Orthop, 2007, 132(6):776-782.
[11]Lanigan DT, Mintz SM. Complications of surgically assisted rapid palatal expansion: review of the literature and report of a case[J]. J Oral Maxillofac Surg, 2002, 60(1):104-110.
[12]姜文辉, 王旭东, 王冬梅. 3种截骨方式辅助上颌骨快速扩弓的应力分布[J]. 上海口腔医学, 2009, 18(6):609-614.
[13]Koudstaal MJ, Poort LJ, van der Wal KG, et al. Surgically assisted rapid maxillary expansion (SARME): a review of the literature[J]. Int J Oral Maxillofac Surg, 2005, 34(7):709-714.
[14]Lanigan DT, Mintz SM. Complications of surgically assisted rapid palatal expansion: review of the literature and report of a case[J]. J Oral Maxillofac Surg, 2002, 60(1):104-110.
[15]Robiony M, Polini F, Costa F, et al. Ultrasonic bone cutting for surgically assisted rapid maxillary expansion (SARME)under local anaesthesia[J]. Int J Oral Maxillofac Surg, 2007,36(3):267-269.
[16]Hernandez-Alfaro F, Mareque Bueno J, Diaz A, et al. Minimally invasive surgically assisted rapid palatal expansion with limited approach under sedation: a report of 283 consecutive cases[J]. J Oral Maxillofac Surg, 2010, 68(9):2154-2158.
[17]Walmsley AD, Walsh TF, Laird WR, et al. Effects of cavitational activity on the root surface of teeth during ultrasonic scaling[J]. J Clin Periodontol, 1990, 17(5):306-312.
[18]Vercellotti T. Piezoelectric surgery in implantology: a case report—a new piezoelectric ridge expansion technique[J].Int J Periodontics Restorative Dent, 2000, 20(4):358-365.
[19]von See C, Gellrich NC, Rücker M, et al. Investigation of perfusion in osseous vessels in close vicinity to piezo-electric bone cutting[J]. Br J Oral Maxillofac Surg, 2012, 50(3):251-255.

