胸腺瘤、重症肌无力合并支气管哮喘1例
刘欣 王连云 和宇峥 石彦涛
患者,女,60岁,主因“间断言语不清,右眼睑下垂9 d”于2013年5月8日就诊于我院。患者缘于9 d前与人交谈时出现舌头发硬,持续数秒钟缓解,发作两次,8 d前出现双眼流泪,右眼睑下垂,可间断缓解,于外院查颅脑MRI示右侧颞叶及双侧额叶深部脑白质散在缺血灶,诊断为“缺血性脑血管病”,给予输液治疗症状未见明显好转,4 d前出现吞咽困难,休息后缓解,为求进一步诊治收入神经内科。既往支气管哮喘病史30余年,高血压病史1年,预激综合征病史6个月。入院检查:T 36.3℃,P 64次/min,R 17次/min,Bp 130/87 mm Hg(1 mm Hg=0.133 kPa),神清语利,查体合作。头颅无畸形,双侧额纹对称,眼睑无水肿,右眼睑下垂,巩膜无黄染,双侧瞳孔正大等圆,对光反射灵敏,伸舌居中,鼻唇沟对称。颈软,无抵抗。胸廓无畸形,双肺呼吸音清,未闻及干湿性啰音。心率64次/min,律齐,各瓣膜听诊区未闻及杂音。腹软,无压痛、反跳痛及肌紧张,肝脾未触及。四肢肌力Ⅴ级,肌张力正常。腱反射正常。病理征均阴性。入院后查:重复频率电刺激:双面神经(眼轮匝肌记录)低频可见衰减现象。颅脑MRA:基底动脉小开窗畸形。胸腺CT(图1):(1)左前纵隔内软组织结节(大小1.77 cm×1.32 cm,CT值约29 Hu);(2)两侧胸膜轻度增厚;(3)主动脉及冠状动脉硬化。心电图:预激综合征。入院诊断:(1)重症肌无力;(2)胸腺瘤;(3)支气管哮喘;(4)预激综合征;(5)脑梗死;(6)高血压2级。于2013年5月13日转入我科拟行手术治疗,完善各项术前检查。患者于2013年5月20日自觉肌无力症状加重,出现吞咽困难,严重时饮水亦受影响。经全院会诊考虑可行手术治疗,术前可试验性应用新斯的明治疗。于2013年5月22日给予甲硫酸新斯的明注射液0.5 mg肌内注射,同时给予硫酸阿托品注射液0.5 mg肌内注射拮抗不良反应,患者病情平稳,未出现哮喘发作。于2013年5月24日在全麻下行胸腔镜胸腺瘤扩大切除术,于升主动脉左方找到大小2 cm×2 cm×3 cm质硬胸腺瘤,切除后完全清理剩余胸腺组织及周围心膈角脂肪,手术过程顺利。术后给予抗炎、化痰、抑酸、补液等综合治疗,患者右眼睑下垂及吞咽困难症状较前明显好转,未发生MG危象。病理诊断(图2):B2型胸腺瘤;免疫组化结果显示:CD1a(-),CD20(-),CD3(+),CD4(+),CD5(+),CD8(+),CD99(+),CK19(+),CK5/6(+),CK7(-),EMA(-),Ki-67(+70%),TdT(+)。于2013年5月26日10∶30突发阵发性室上性心动过速(218次/min),急请心内科会诊,给予盐酸胺碘酮注射液150 mg缓慢静推后转复成窦性心律。于2013年5月26日16∶00突发胸闷、气促,听诊双肺可闻及哮鸣音,考虑支气管哮喘发作,给予多索茶碱0.2 g入液静脉滴注后好转,并持续应用沙美特罗/氟替卡松粉吸入剂(50/100μg)1吸,1次/d。于2013年6月2日,术后第9天,患者右眼睑下垂及吞咽困难症状较术后前几日加重,遂起始给予溴吡斯的明30 mg,2次/d,口服,并逐渐加量至90 mg,2次/d,患者右眼睑下垂症状明显改善,吞咽困难较前减轻,于2013年6月10日好转出院。出院后第7天随访,患者右眼睑下垂症状消失,进硬食存在吞咽困难,溴吡斯的明剂量调整为60 mg,每6小时1次,(因90 mg,2次/d胃肠道反应严重),持续应用沙美特罗/氟替卡松粉吸入剂(50/100μg)1吸,1次/d,未见哮喘发作。
讨论 支气管哮喘是由多种细胞包括气道的炎性细胞和结构细胞(如嗜酸粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、平滑肌细胞、气道上皮细胞等)和细胞组分参与的气道慢性炎症性疾病[1,2]。重症肌无力(myasthenia gravis,MG)是指乙酰胆碱受体(AChR)抗体介导、细胞免疫依赖、补体参与、主要累及神经肌肉接头突触后膜AChR的获得性自身免疫性疾病[3]。体内异常抗体的产生已经被认为是多种疾病的重要发病机制,哮喘和MG也不例外。有研究发现,MG患者的胸腺生发中心可出现CD23(IgE受体)的超表达,而IgE则在变应性哮喘的诱发过程中起重要作用[4]。
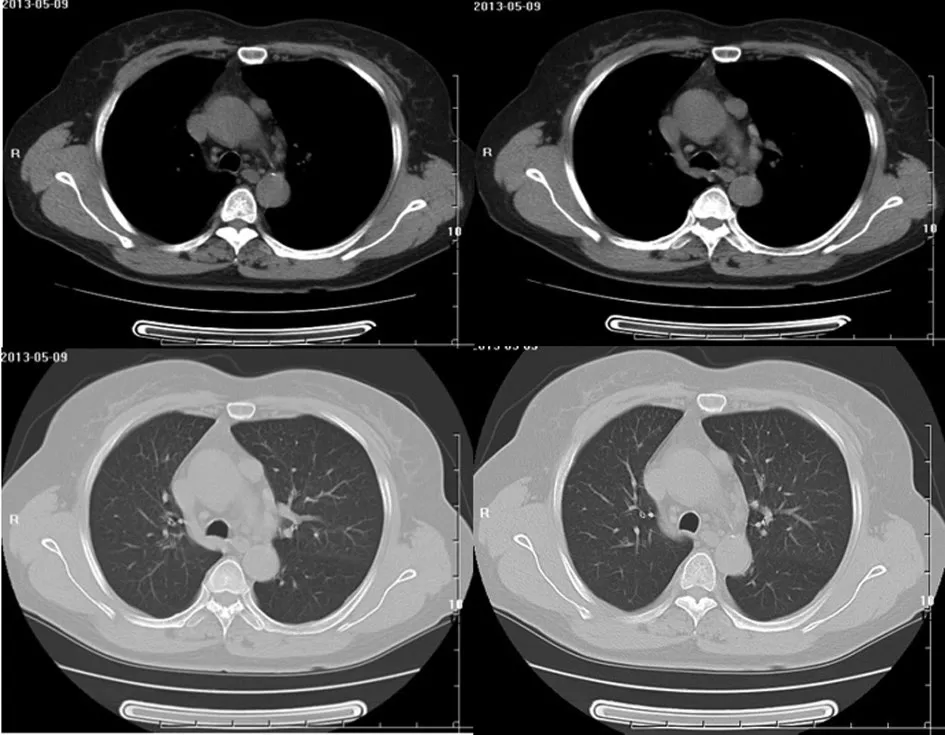
图1 胸腺CT可见左前纵隔内软组织结节
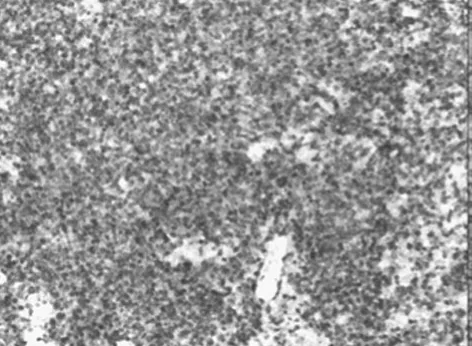
图2 HE染色
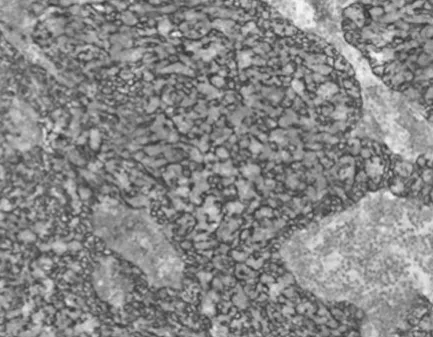
图3 免疫组化结果
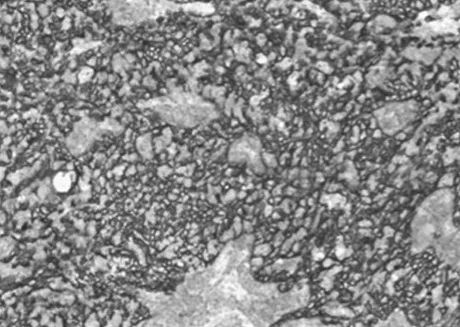
图4 免疫组化结果

图5 免疫组化结果
MG与支气管哮喘的共同特点为同属自身免疫性疾病,2个及其以上的免疫性疾病同时出现并不少见,而哮喘合并MG从1960年至2011年则只有9例报道[5-13],同时合并胸腺瘤者笔者则未见报道。
MG在各个年龄阶段均可发病,平均年发病率约为7.40/百万人(男性7.66/百万人,女性7.14/百万人)。约15%左右的MG患者同时伴有胸腺瘤,约60%左右MG患者同时伴有胸腺增生,20% ~25%胸腺瘤患者可出现MG症状[3]。
MG主要治疗方法为抗胆碱酯酶药物与免疫抑制剂治疗,应用抗胆碱酯酶药物可能会诱发哮喘,哮喘发作可加重肌无力症状,而停用抗胆碱酯酶药物,重症肌无力情况会加重。因此,这两种疾病同时存在时,呼吸肌处于机械弱势,稍有不慎则会导致严重的呼吸困难。
本患者MG症状明显,哮喘则处于稳定期,治疗以MG为主,适时手术,兼顾哮喘。有研究显示,大部分患者通过根治性切除可治愈胸腺瘤,但仍有部分患者术后出现肌无力症状,术后治疗尤其是药物治疗的继续跟进是非常必要的[12]。因此,本患者术前试验性给予抗胆碱脂酶药物治疗为术后口服溴吡斯的明奠定了基础。刘志广等[10]报道显示以支气管哮喘症状为主时,早期使用糖皮质激素十分重要,糖皮质激素是控制哮喘发作的最有效的一线治疗药物,通过抑制体液免疫反应从而抑制乙酰胆碱受体抗体合成,使突触后膜乙酰胆碱受体数量增加,减轻哮喘发作,但激素可一过性加重肌无力症状,需密切观察。Echaniz-Laguna等[13]研究显示如果哮喘诊断成立,应给予支气管扩张剂,并及时调整溴吡斯的明的用量。
MG患者中,确诊的胸腺瘤患者应行胸腺摘除手术,可不考虑MG的严重程度,早期手术治疗可以降低肿瘤扩散的风险[14,15],根治性切除至关重要。目前,胸腔镜技术在临床得到广泛应用和开展,其具有手术时间短,创伤小,术后患者恢复快,MG危象发病率低的特点[16,17],对于围手术期使用激素的患者,切口愈合不良的几率减小,胸腔镜胸腺扩大切除术治疗MG逐渐被国内外学者所采用。Meyer等[18]比较正中开胸和胸腔镜下胸腺扩大切除的疗效,结果表明两者的CSR率无统计学差异。本患者采用胸腔镜胸腺瘤扩大切除术,创伤小,未发生MG危象和重症哮喘,恢复较快,但仍需要进一步随访观察疗效。
1 中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗和管理方案).2008.
2 刘飒,王立民,五红阳,等.阿奇霉素对支气管哮喘疗效及细胞因子水平的影响.河北医药,2013,35:2032-2033.
3 中华医学会神经病学分会神经免疫学组,中国免疫学会神经免疫学分会.中国重症肌无力诊断和治疗专家共识.中国神经免疫学和神经病学杂志,2011,18:5:368-372.
4 Murai H,Hara H,Hatae T,et al.Expression of CD23 in the germinal center of thymus from myasthenia gravis patients.JNeuroimmunol,1997,76:61-69.
5 Weiner P,Ganem R,Weiner M.Unusual treatment for myasthenia gravis associated with asthma.Harefuah,1993,124:474-477.
6 Akiba Y,Takeuchi T,Nakanishi K,et al.Bronchial asthma complicated by myasthenia gravis.Nihon Kyobu Shikkan Gakkai Zassi,1996,34:449-453.
7 Muller-Felber W,Ansevin CF,Ricker K,et al.Immunossupressive treatment of rippling muscles in patients with myasthenia gravis.Neuromuscul Disord,1999,9:604-607.
8 Murai H,Osoegawa M,Ochi H,et al.High frequency of allergic conjunctivitis in myasthenia gravis without thymoma.JNeurol Sci,2004,225:27-31.
9 Souza-Machado A,Ponte E,Cruz A.Severe asthma associated with Myasthenia gravis and upper airway obstruction.JInvestig Allergol Clin Immunol,2007,17:267-270.
10 刘志广,康慧聪,刘金凤,等.重症肌无力合并支气管哮喘1例报告.神经损伤与功能重建,2011,6:5:380-381.
11 Nishantha KM,Madegedara D.Myastheniagravis:a rare cause of orthopnoea due to bilateral diaphragmatic paralysis.Indian J Chest Dis AlliedSci,2011,53:189-190.
12 Fredrik R.Thymoma in myasthenia gravis:from diagnosis to treatment.SAGE-Hindawi Access to Research Autoimmune Diseases.doi:10.4061/2011/474512.
13 Echaniz-Laguna A,Pistea C,Philippi N,et al.Asthma as a cause of persistent dyspnea in treated myasthenia gravis patients.Eur Neurol,2012,68:300-303.
14 Skeie GO,Apostolski S,Evoli A,et al.Guidelines for treatment of autoimmune neuromuscular transmission disorders.Eur J Neurol,2010,17:893-902.
15 Jani AA,Lisak RP.Myasthenia gravis.Curr Treat Options Neurol,2010,12:231-243.
16 Meacci E,Cesario A,Margaritora S,et al.Thymectomy in myasthenia gravis via original video-assisted infra-mammary cosmetic incision and median sternotomy:long-term results in 180 patients.Eur JCardiothorac Surg,2009,35:1063-1069.
17 Park IK,Choi SS,Lee JG,et al.Complete stable remission after extended transsternal thymectomy in myasthenia gravis.Eur J Cardiothorac Surg,2006,30:525-528.
18 Meyer DM,Herbert MA,Sobhani NC,et al.Comparative clinical outcomes of thymectomy for myasthenia gravis performed by extended transsternal and minimally invasive approaches.Ann Thorac Surg,2009,87:385-390.

