转移瘤CD34及微血管表达的研究
冯子明,袁中平,董谢平,邓 亮,付 旸
(江西省人民医院骨科,南昌 330006)
实体肿瘤的生长和转移与血管生成密切相关。目前,大多数研究者采用CD34等泛血管内皮细胞标记物检测肿瘤新生血管的微血管密度(microvessel density,MVD)[1-4]。本研究采用免疫组织化学方法检测CD34抗体转移瘤微血管的分布,探讨转移癌微血管表达的特点。
1 资料与方法
1.1 病例资料
选择江西省人民医院2007年6月至2013年6月手术切除转移瘤组织标本43例 (转移癌组),均经病理检查证实。其中男27例,女15例,年龄30~77岁,平均49.48岁;鳞癌转移瘤25例,直肠癌转移瘤18例。另选择同期本院的手术切除舌鳞癌癌组织标本11例(鳞癌组),男6例,女5例,年龄 25~63岁,平均 38.7岁。
1.2 方法
1.2.1 主要仪器与试剂
石蜡切片机 (SLEE,德国);0.5~10.0 μL 单道电动数字移液器(Brand,德国);微波炉(格兰仕,广东);电热恒温箱 PVD-050,上海);双筒显微镜(Olympus,日本);显微照相系统(Nikon,AFX-ⅡA,日本)。鼠抗人单克隆抗体CD34(即用型)、SP免疫组化试剂盒(即用型)及DAB显色试剂盒均购自福州迈新生物技术开发有限公司。
1.2.2 CD34染色方法及结果判定
CD34染色均采用免疫组织化学SP法检测。样本经体积分数为10%中性甲醛溶液中固定,常规石蜡包埋,4 μm厚切片后,按试剂盒说明书操作步骤进行检测。所有切片结果应用数码相机采集图像,彩色细胞图像分析系统计数微血管密度(MVD)值。CD34在光学显微镜下将血管内皮细胞染为棕黄色。
1.2.3 MVD的测定
采用Weidner等[5]提出的方法对研究结果进行MVD量化分析。首先在40倍光学显微镜视野下扫视整个切片,寻找血管高密度集中的区域;在200倍光学显微镜视野下,应用显微照相系统计数微血管数目,各计数3个高倍视野,取其平均值作为该标本的MVD数。
1.3 统计学方法
应用SPSS 14.0统计分析软件包对全部数据进行组间t检验及秩和检验,P<0.05为差异有统计学意义。
2 结果
CD34将肿瘤组织微血管标本染为棕黄色,在肿瘤组织的微小血管及大血管上表达均较强,与其他组织分界清楚。转移癌组的标本在200光学显微镜视野下,应用显微照相系统计数微血管数目为2~6根;鳞癌组标本的微血管数目为14~19根。见封四图1—2。转移癌组CD34的表达明显低于鳞癌组(P<0.01);2组标本血管标记物标记的癌组织MVD值在男女患者间比较差异无统计学意义 (P>0.05);CD34标记的MVD值在不同的转移瘤之间比较差异均无统计学意义(P>0.05)。见表1。
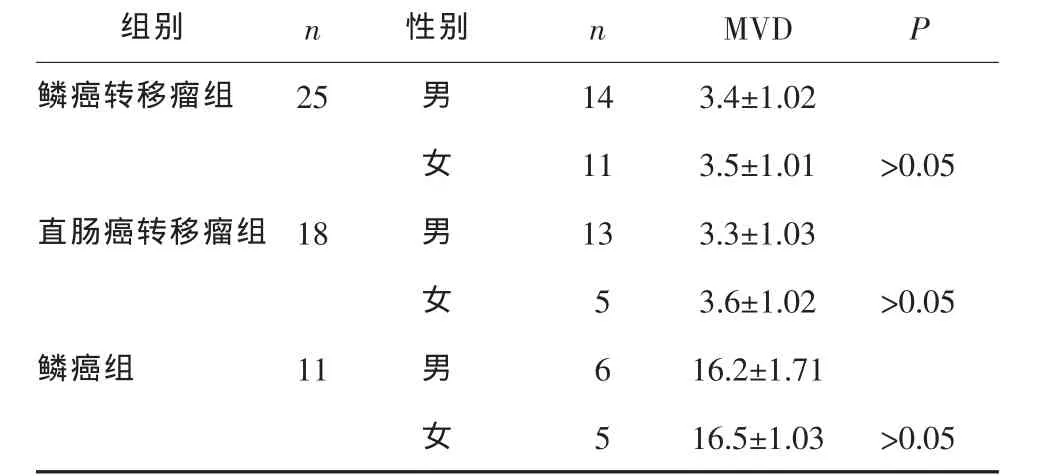
表1 CD34标记转移瘤、鳞癌MVD的比较 根
3 讨论
血管生成是肿瘤生长、侵袭、转移和复发的基础,肿瘤血管的生成与促血管生成因子、肿瘤细胞分泌激素及基因调控等诸多因素有关,其中血管生长刺激因子和血管生长抑制因子作用平衡与否,决定了血管生成是促进还是抑制[6]。当肿瘤体积增长>1~2 mm-3时,如无新生血管长入,肿瘤组织将保持静止状态或退化[7]。新生血管长入肿瘤后血液供应丰富,新生血管不仅为肿瘤组织提供足够的营养和氧,还提供大量的生长因子,促使肿瘤迅速生长。血管生成也与肿瘤转移有着重要的关系,因为肿瘤新生血管不成熟,结构缺乏完整性和细胞间连接,管壁薄弱,仅排列一层内皮细胞,缺乏平滑肌,基膜也不完整,因此穿透性较高,肿瘤细胞容易穿透微血管壁发生转移;肿瘤新生血管形成后使肿瘤病灶组织间质内液体量和压力增高,从而使淋巴回流增加,肿瘤细胞通过淋巴管系统转移,亦是促使肿瘤转移的重要影响因素。肿瘤内MVD与肿瘤的恶性程度也有密切的关系,目前原发肿瘤组织内的MVD已成为预测肿瘤转移、复发及判断预后的一项重要指标。本研究对转移瘤血管生成进行分析,发现原发癌与转移瘤在血管生成有明显差异,转移瘤血管形成较原发肿瘤明显减少(P<0.01)。
肿瘤血管生成与缺氧有明显的关系,缺氧是实体性肿瘤物理微环境的基本特征之一。肿瘤生长速度快,肿瘤细胞大量生长需氧量增加,当氧的需求超过供给,并且因肿瘤组织快速生长间质内压力增高,使肿瘤内不成熟的血管塌陷,肿瘤病灶微环境缺氧加重;缺氧将刺激肿瘤细胞和宿主细胞合成分泌多种促血管生成因子,促进局部新生血管形成;缺氧还通过缺氧诱导因子1(hypoxia induced factor-1,HIF-1)上调血管内皮生长因子 (vascular endothelial growth factor,VEGF)及其受体的表达[8-9]。
目前的研究[10]认为,与肿瘤血管生成相关的基因主要有Rac-1、p53及PTEN。Rac-1是Rho家族蛋白中的一个分子,Rho GTPases是一组相对分子量为20000~25000的单体鸟苷酸结合蛋白,属小G蛋白家族。Rac-1在缺氧状况下促进HIF-1的活化,并且加强HIF-1的转录活性和蛋白表达。同时还发现 Rac-1可调节细胞外基质(ECM)和VEGF诱导内皮细胞的趋化作用,促进内皮细胞的增殖、运动和迁移,是VEGF后信号通路的一个重要中间分子。因此,目前认为Rac-1可能也是血管生成过程中的一个重要的调控因子[10]。
p53可以抑制肿瘤血管生成,其的缺失或突变可导致肿瘤血管增生明显。p53的作用机制主要是通过泛素介导的蛋白水解作用,降解HIF-1α,从而抑制 HIF-1α 介导的血管生成[11-12]。有学者[13-14]研究发现,随着肿瘤组织细胞缺氧时间的延长,p53表达水平出现逐渐下降的趋势,而与VEGF表达的上升呈现相反趋势。因此,增强p53基因的表达可以抑制肿瘤血管的生成。
近年来的研究[14]认为,人第10号染色体缺失的磷酸酶及张力蛋白同源基因(PTEN)是与肿瘤血管生成有关的基因,位于染色体10 q23.3,编码一双特异性的磷酸酶,起抑制调控PI3K2AKT,导致细胞周期的停滞和凋亡。随着肿瘤组织缺氧时间的延长,PTEN蛋白的表达出现逐渐下降趋势,而与VEGF表达的上升呈现相反趋势。Jiang等[15]的研究也发现,PTEN高表达可抑制鸡尿囊胚血管生成,并通过PI3K2AKT途径抑制VEGF的表达。
肿瘤血管生成的过程是肿瘤细胞和正常细胞产生的具有相反作用的血管生成因子不平衡作用的结果。目前,在人类肿瘤血管生成方面的研究中,检测肿瘤血管生成是通过测定MVD来实现的,通过血管内皮细胞标记物进行测量是公认的能够代表肿瘤血管生成状态的方法。研究已经发现的血管内皮细胞标记物主要有 CD31、CD34、Tie2、E9 及TEC等[16]。本研究采用CD34作为肿瘤血管内皮细胞标记物检测肿瘤新生血管的MVD,转移癌组微血管数目为2~6根;鳞癌组标本的微血管数目为14~19根。应用SPSS14.0统计分析软件包对全部数据进行组间t检验及秩和检验,转移癌组CD34的表达明显低于鳞癌组(P<0.01);血管标记物标记的癌组织MVD值在男、女患者间比较差异无统计学意义(P>0.05),CD34 标记的 MVD 值在不同的转移瘤之间比较差异无统计学意义(P>0.05)。如果对转移瘤血管在血管生成因子,肿瘤血管生成相关基因Rac-1、p53及PTEN的表达等方面进行研究可能会有更多的新发现。
[1]Hasan J,Shnyder S D,Bibby M,et al.Quantitative angiogenesis assays in vivo-a review[J].Angiogenesis,2004,7(1):1-16.
[2]Shivakumar S,Prabhakar B T,Jayashree K,et al.Evaluation of serum vascular endothelial growth factor(VEGF)and microvessel density(MVD)as prognostic indicators in carcinoma breast[J].J Cancer Res Clin Oncol,2009,135,(4):627-636.
[3]Benckert C,Thelen A,Cramer T,et al.Impact of microvessel density on lymph node metastasis and survival after curative resection of pancreatic cancer[J].Surgery Today,2012,42(2):169-176.
[4]Hansen T F,Sorensen F B,Spindler K L,et al.Microvessel density and the association with single nucleotide polymorphisms of the vascular endothelial growth factor receptor 2 in patients with colorectal cancer[J].Virchows Archiv,2010,456(3):251-260.
[5]Weidner N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma[J].N Engl J Med,1991,324(1):1-8.
[6]Ferrara N,Gerber H P,Couter J.The biology of VEGF and its receptors[J].Nat Med,2003,9(6):669-676.
[7]Nesbit M.Abrogation of tumor vasculature using gene therapy[J].Cancer Metastasis Rev,2000,19 (1/2):45-49.
[8]Folkman J.Role of angiogensis in tumor growth and metastasis [J].Semin Oncol,2002,29(6 S16):15-18.
[9]Nyberg P,Xie L,Kalluri R.Endogenous inhibitors of angiogensis[J].Cancer Res,2005,65(10):3967-3979.
[10]薛妍,毕锋,刘文超,等.缺氧状况下 Rho GTPases的表达和活性变化及其与肿瘤血管生成关系的研究[J].中华肿瘤杂志,2004,26(9):517-520.
[11]Matsubara T,Funabiki T,Jinno O,et al.p53 Gene mutations and overexpression of p53 product in cancerous and noncancerous biliary epithelium in patients with pancreaticobiliary maljunction[J].J Hepatobiliary Pancreat Surg,1999,6(3):286-293.
[12]Biesaga B,Niemiec J,Ziobro M.Microvessel density and status of p53 protein as potential prognostic factors for adjuvant anthracycline chemotherapy in retrospective analysis of early breast cancer patients group [J].Pathol Oncol Res,2012,18(4):949-960.
[13]Breier G,Blum S,Peli J,et al.Transforming growth factor2beta and Ras regulate the VEGF/VEGF2receptor system during tumor angiogenesis[J].Cancer,2002,97(2):142-148.
[14]Ravi R,Mookerjee B,Bhuj walla Z M,et al.Regulation of tumor angiogenesis by p53-induced degradation of hypoxia-inducible factor 1alpha[J].Genes Dev,2000,14(1):34-44.
[15]Jiang B H,Zheng J Z,Aoki M,et al.Phosphatidylinositol 3-kinase signaling mediates angiogenesis and expression of vascular endothelial growth factor in endothelialcells[J].ProcNatlAcadSciUSA,2000,97(4):1749-1753.
[16]Miyata Y,Sagara Y,Watanabe S,et al.CD105 is a more appropriate marker for evaluating angiogenesis in urothelial cancer of the upper urinary tract than CD31 or CD34[J].Virchows Archiv,2013,463,(5):673-679.

