金矿区中国林蛙体内DNA甲基化水平
李雅芬,王 宁,柏建雯
东北师范大学环境学院, 长春 130024
金矿区中国林蛙体内DNA甲基化水平
李雅芬,王 宁*,柏建雯
东北师范大学环境学院, 长春 130024
采集金矿附近山区河流水质、沉积物和当地两栖类动物中国林蛙样品,应用高效液相色谱仪测定污染区和对照区林蛙体内各组织器官的胞嘧啶(c)和5-甲基胞嘧啶(5-mc)含量,探讨因金矿开采引起的汞污染以及对林蛙体内组织器官DNA甲基化水平的变化,研究汞胁迫下,两栖类动物体内分子水平的影响。结果表明:金矿开采区河流水质和沉积物已受到甲基汞污染,污染区林蛙体内甲基汞含量远高于对照区;林蛙体内各组织器官中DNA甲基化水平发生不同的变化:污染区林蛙肝脏和皮肤中DNA甲基化水平高于对照区,肌肉和脑干DNA甲基化水平低于对照区;雄性林蛙肝脏和脑干DNA甲基化水平高于雌性,肌肉和皮肤DNA甲基化水平却低于雌性。以上结果说明汞胁迫下,中国林蛙体内组织器官DNA甲基化水平可以发生一定的变化,环境中重金属汞离子进入林蛙体内含量的不同,可以促进或抑制其体内甲基化水平的变化,引起基因毒性作用。
甲基汞;DNA胞嘧啶甲基化;中国林蛙;组织器官
汞和甲基汞对生物尤其是哺乳动物的毒害作用早已被世界卫生机构和科研者所公认,可造成动物体内神经系统、内脏器官的病变以及免疫毒性、生殖毒性和胚胎、发育毒性等,这些均与哺乳动物DNA甲基化水平的变化有关。DNA甲基化是一种重要的遗传修饰,其作用机制是在甲基转移酶(DNA methyltransferase, MTase)的催化作用下,将甲基供体S-腺苷甲硫氨酸(SAM)分子中的甲基化基团添加到DNA分子中的碱基上,最常见的是加在胞嘧啶上,形成5-甲基胞嘧啶(5-mC)[1]。DNA甲基化是动植物正常发育、分化所必需的,在维持正常细胞功能、遗传印记、胚胎发育过程中具有重要的生物学意义[2]。研究表明,不同环境下DNA甲基化和染色体结构的不同将引起基因表达产生差异,而影响哺乳动物DNA甲基化水平的因素很多,包括温度、营养水平、重金属胁迫和辐射等[3-4]。目前有关重金属影响生物体内DNA甲基化水平发生变化的研究主要集中在植物和农作物方面,对动物的影响研究主要为哺乳动物和水生生物。如Lee Y W,Broday L,Costr M的研究表明,重金属镍处理中国仓鼠虽然在短期内使细胞中甲基胞嘧啶转移酶的活性有所降低,但5-甲基胞嘧啶含量却迅速升高[5];Hix S,Augusto O认为,叔丁基氢过氧化铁能引起小牛胸腺DNA的甲基化水平提高[6];Donald Yee 等研究了美国三藩市海湾中水生生物DNA甲基化水平,证明当地金矿开采已经导致大量的汞进入环境而造成了严重的污染[7];Maria Maldonado 等人研究蚯蚓中DNA 甲基化水平,发现砷和汞对其影响最大,同时证明了土壤遭到重金属的破坏,污染较重[8]。国内如朱国念等的研究表明,重金属离子的暴露极大地提高了鲫鱼肝脏DNA的总甲基化水平,金属离子的毒性作用干扰了鲫鱼细胞的正常生理周期和基因表达,是引发水生生物基因毒性作用的主要机制[9];曹哲明通过比较来自太湖三山岛自然水域(污染区)和南泉养殖基地(非污染区)背角无齿蚌样品不同组织的甲基化图谱,发现环境污染尤其是重金属污染对背角无齿蚌的基因表达有一定的影响[10]。这些成果对于我们了解重金属胁迫下动植物受污染的状况很有帮助,但对于矿区重金属污染影响下,两栖类动物体内DNA的损伤或影响却鲜见报道。基于几年来对吉林省夹皮沟金矿汞污染生态环境影响的研究,采样分析了汞和甲基汞对中国林蛙(Rana Chensinensis)体内各组织器官DNA胞嘧啶水平和影响的程度,为充分揭示重金属的遗传毒性、深入探讨金矿开采对当地两栖类动物的毒害机理提供科学依据。
1 研究区概况及样品实验(The general situation of research area and sample experiment)
1.1 研究区概况
夹皮沟金矿位于吉林省桦甸市东部,地理坐标127°15′~127°30′E,42°41′~43°00′N;是一个典型的山区,地势东南高、西北低,境内由北向南分布有老牛沟河、夹皮沟河和山麻河,均从东向西汇入苇沙河,再经红石进入第二松花江。夹皮沟地区为一个北西-南东向深大断裂带,分布有夹皮沟、老牛沟、老金厂、二道甸子等12个大小金矿,自1820年有组织有规模开采以来,至2006年一直使用混汞法进行选矿。虽然我国自2000年以后已经全面停止使用该法炼金,但此工艺开采金矿已带来了诸如当地河流水质、土壤等严重污染的环境问题[11]。
1.2 样品的采集与测定
1.2.1 样品采集
中国林蛙实验样品来自夹皮沟金矿开采区内老牛沟河、夹皮沟河和山麻河附近的林蛙饲养场,见图1。对照样品选择与研究区气候、地理等条件相似的吉林省辉南县国家龙湾(中心点地理坐标126°24E,42°20N)自然保护区林蛙饲养场。2011年5月和2012年5月在研究区老牛沟河上的五道沟、山麻河上的二道沟和马家店以及辉南龙湾每一地点采集2~3龄林蛙5只,同时采集附近河流水和表层沉积物(0~10 cm)样品,样品采集情况见表1。水样保存按照GB7468-87中的方法处理;沉积物自然风干,去除杂质,在陶瓷研钵中研磨,过80目筛待实验;林蛙样品经处死、取各组织器官后保存。

图1 金矿分布情况及采样点分布图Fig. 1 The gold distribution and distribution of sampling points
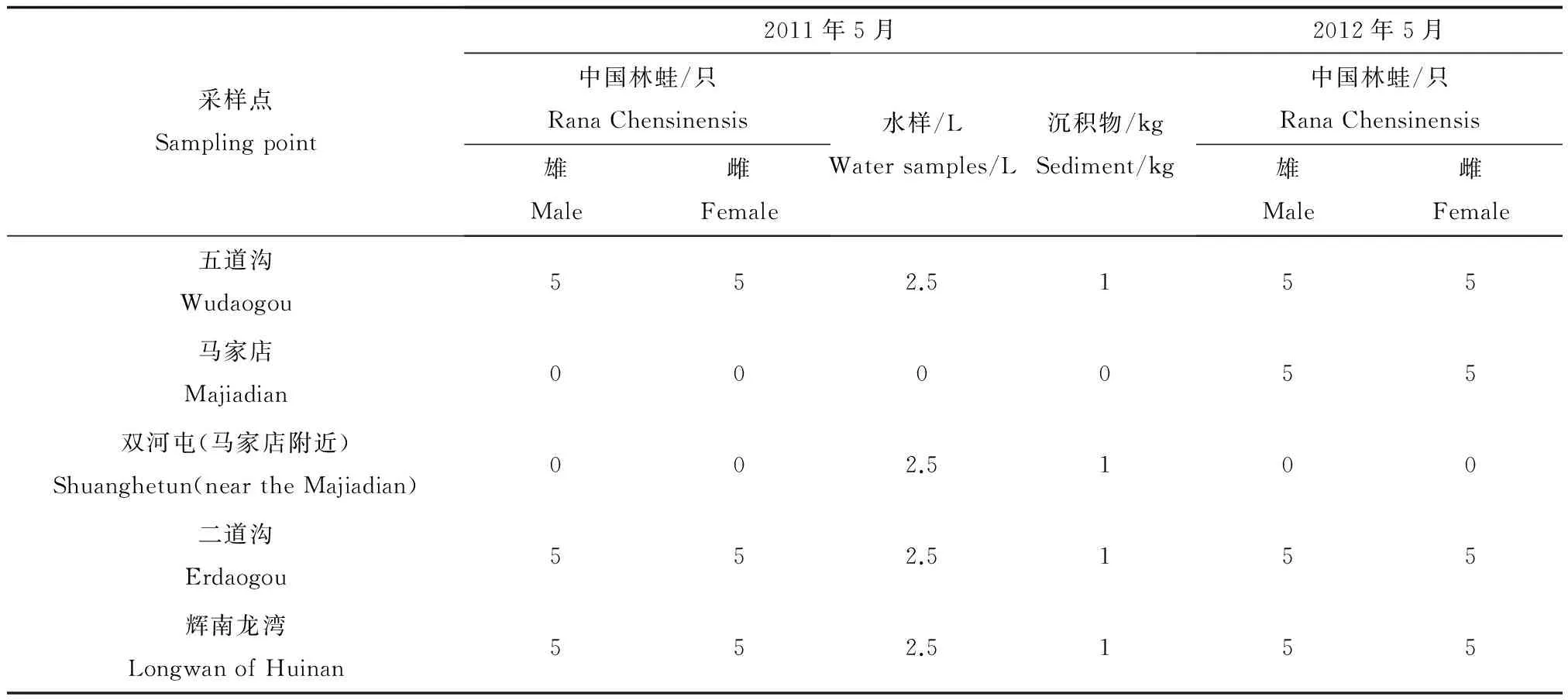
表1 样品采集情况Table 1 Detail of the samplings
1.2.2 样品测定
(1)样品预处理
河流中水的样品用巯基棉富集,盐酸洗脱,用苯萃取;沉积物样品取2.0 g样品加入2 mL 2 mol·L-1的盐酸搅拌,再加入1 mL 0.01 g·L-1的CuSO4溶液,浸提10 min。经巯基棉富集,盐酸洗脱、萃取后待测;林蛙样品甲基汞含量测定:取2.0 g,先加2.0 g NaCl研磨,加2 mL 2 mol·L-1盐酸进一步研磨至糊状。转移至25 ml具塞比色管中,振摇10 min,静置1 h;滤纸过滤;用苯萃取、离心,苯萃取后待测。
林蛙组织器官DNA甲基汞测定:每一采样点分别取大小近似的雄蛙和雌蛙各5只,回实验室处死后立即取其脑、肝脏、肌肉和皮肤,放入无水乙醇进行脱水,存储于2 mL高温灭菌后的生物学离心管中,并于-20℃保存。用上海生工生物工程技术服务有限公司生产的“UNIQ-10柱式动物基因组抽提试剂盒”提取林蛙各组织的DNA基因组,采用琼脂糖凝胶电泳分析DNA基因组的提取程度。
(2)分析方法
水和沉积物、林蛙样品按照气相色谱法(GB17132-1997)测定其甲基汞含量。所有样品均做3个平行,然后取平均。标准差±0.02,p<0.02,r=0.89。
图2 提取中国林蛙DNA示意图Fig. 2 The Extraction process of Rana Chensinensis
林蛙样品提取之后的DNA基因组采用高效液相色谱仪(HPLC)进行测定,由积分面积5-mC/(5-mC+C)的百分数检测基因组DNA中5-mC的含量,即DNA甲基化的水平。高效液相色谱仪色谱柱条件为安捷伦1200系列的TC-C18(250 mm×4.6 mm),10℃柱温条件下,以10%甲醇、5 mmol·L-1的戊烷磺酸钠、0.2%三乙胺混和液为流动相,流速为1.0 mL·min-1,紫外波长273 nm,灵敏度0.01 AUFS。每一样品测3个平行样取平均。选用上海生工生物工程技术服务有限公司胞嘧啶(c)和5-甲基胞嘧啶(5-mc)作为实验的标准样品,以0.5 mL、1.0 mL、1.5 mL、2.0 mL、3.0 mL、4.0 mL为进样量,做标准曲线。胞嘧啶的线性关系为:y=2779.1x+75.049,5-甲基胞嘧啶的线性关系为: y=1899.1x+18.118。
2 结果及分析(Results and analysis)
2.1 环境介质中甲基汞含量
气相色谱法测定河流水体和沉积物样品中的甲基汞含量,详见表2,表中当地背景值选自刘永懋编写的《中国松花江甲基汞污染防治与标准研究》。

表2 河流水体与沉积物甲基汞含量Table 2 The average content of methylmercury in river water and sediment
上表可见,老牛沟河、山麻河水中甲基汞含量都比较高,单因子评价法评价水体中甲基汞污染程度为中度污染;沉积物中甲基汞含量远超过当地环境背景值,地累积指数评价为极高环境风险。
2.2 林蛙体内不同部位甲基汞含量
中国林蛙对甲基汞有较强的富集作用。其中脑中甲基汞平均浓度为52.6820 ng·g-1;肝中甲基汞平均浓度为52.6127 ng·g-1;肌肉中甲基汞浓度平均浓度为57.0850 ng·g-1;皮肤中甲基汞平均浓度为62.7674 ng·g-1;卵中甲基汞平均浓度为20.7216 ng·g-1。利用SPSS进行了数据的显著性检验,均为95%置信区间内(p<0.05)。如表3和图3。
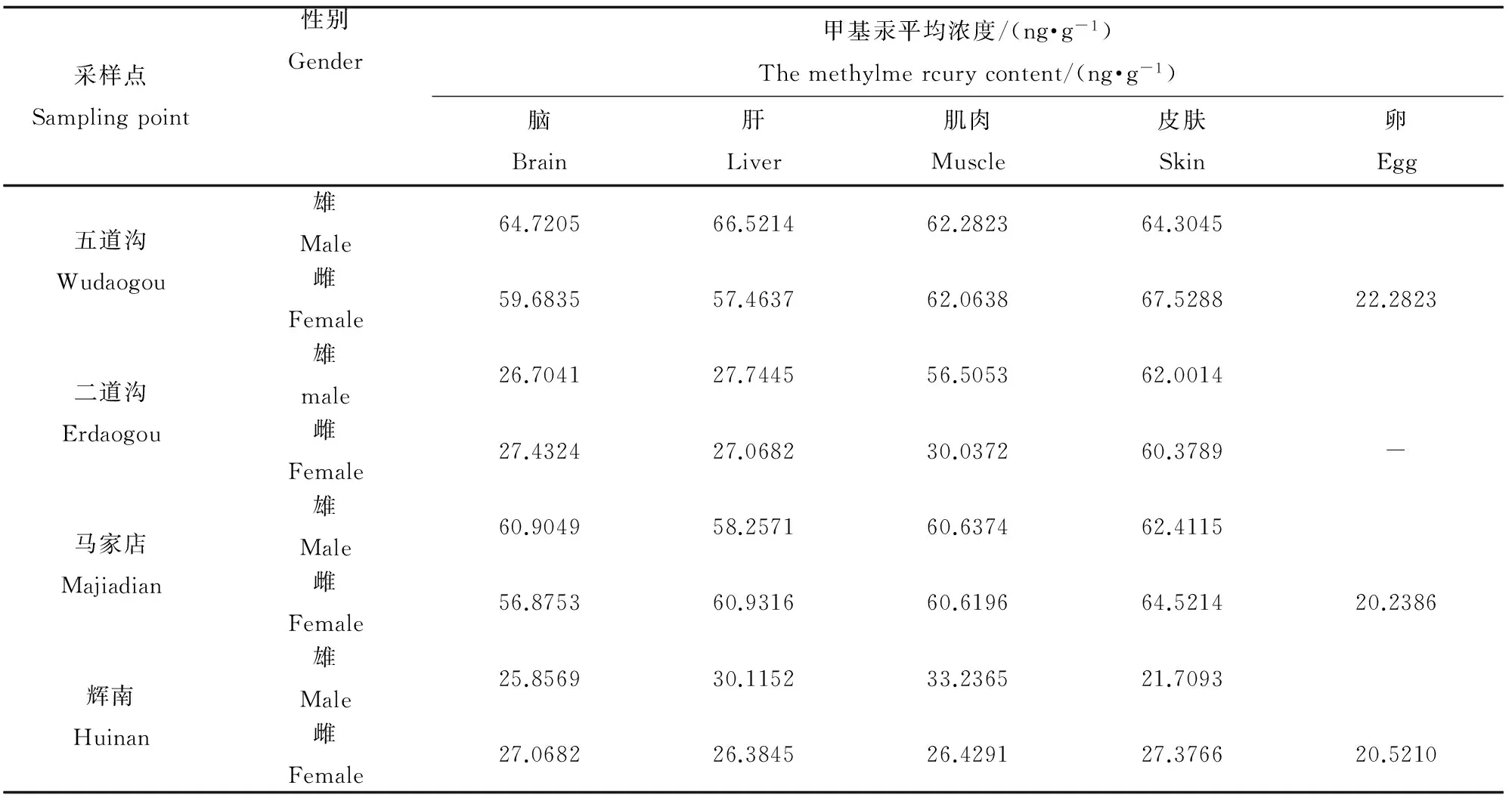
表3 不同采样点中国林蛙体内不同部位甲基汞平均浓度(ng·g-1)Table 3 The methylmercury content of different parts of different sampling points(ng·g-1)
注:脑、肝为1个样本;内脏、肌肉为3个平行样本;皮肤、卵为4个平行样本;“-”为无样本。
Note:Liver, brain is a sample; organs, muscles of three parallel samples; skin and eggs for 4 parallel samples; "-" for free samples.

图3 不同采样点中国林蛙体内不同部位甲基汞浓度Fig. 3 Methylmercury content of different parts of different sampling points
表3可见,桦甸地区(污染区)林蛙体内甲基汞含量均高于对照点。从采用地点分析,林蛙脑干、肌肉、皮肤和雌蛙肝脏中甲基汞含量的分布均为:五道沟>马家店>二道沟>辉南;雄蛙肝脏为五道沟>马家店>辉南>二道沟;卵:五道沟>马家店>辉南。林蛙各组织器官中甲基汞含量的分布并无规律,总体来看,皮肤较高,肝脏次之,卵最低。
结合表2河流水体和沉积物中甲基汞的测定数据可认为,金矿开采对该地区已造成较严重的影响,导致当地林蛙体内甲基汞的积累加重。中国林蛙是一种两栖动物,生活习性为每年4-9月在林间活动,9月到次年4月进入河流水栖。冬季来临时,林蛙群集于河床两侧深水处的砂砾或石块下冬眠。水体和沉积物中的污染物可通过皮肤渗透进入林蛙体内。因此,中国林蛙体内汞和甲基汞含量与水体、沉积物中汞和甲基汞含量有一定的相关性。通过计算不同采样点林蛙体内甲基汞含量对水和沉积物中甲基汞含量的富集因子,结果表明,甲基汞的富集因子几乎都大于1.0,其中,林蛙/水体大于林蛙/沉积物。最大的富集因子为3.3696,最小的富集因子为0.8417。表明林蛙对水和沉积物中甲基汞存在一定的富集作用,但有一定限度。
2.3 林蛙体内组织器官DNA胞嘧啶甲基化水平
2.3.1 林蛙组织器官中DNA胞嘧啶甲基化的平均水平
虽然中国林蛙体内DNA甲基化水平存在着个体差异,但实验证明栖息环境中汞污染的程度与其体内甲基汞含量有着密切的联系,对林蛙的胁迫作用可能导致其DNA胞嘧啶甲基化发生一定的变化。各采样地点中国林蛙体内肌肉中的DNA甲基化水平为0.0237~0.1449,肝脏中的DNA甲基化水平为0.0223~0.1994,皮肤中的DNA甲基化水平为0.0119~0.1027,脑中的DNA甲基化水平为0.0547~0.2308。见表4。
比较各采样点林蛙体内各部分DNA胞嘧啶甲基化的平均水平可见,辉南龙湾(对照区)林蛙的脑和肌肉DNA甲基化水平较高,肝脏与皮肤较低;而金矿开采区(污染区)的几个采样点中,二道沟林蛙肌肉和肝脏DNA甲基化水平较高,皮肤和脑较低;五道沟、马家店采样点林蛙体内各部分DNA甲基化为肝脏和脑干比较高,皮肤和肌肉较低。
2.3.2 不同性别林蛙组织器官中DNA胞嘧啶甲基化水平
各采样点不同性别林蛙组织器官的DNA胞嘧啶甲基化水平的比较见表5和图4。

表4 不同采样地点中国林蛙体内各部分DNA甲基化水平数据Table 4 The different parts DNA methylation level of different sampling points (%)

表5 各采样点不同性别林蛙体内组织器官的DNA甲基化水平(均值)Table 5 DNA methylation levels of the organizations in Rana Chensinensis at every sampling points
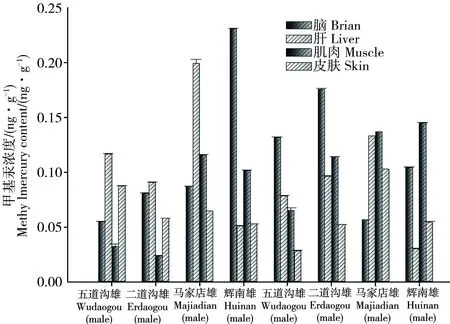
图4 林蛙体内组织器官的DNA甲基化水平(%)Fig. 4 DNA methylation levels of the organizations in Rana Chensinensis(%)
对比林蛙体内各组织器官DNA胞嘧啶甲基化水平可见,总体上林蛙肝脏和皮肤DNA甲基化水平仍与体内甲基汞含量的分布相同即污染区高于对照区,肌肉和脑干中DNA甲基化水平呈现污染区低于对照区的现象。
分析了不同性别林蛙体内组织器官DNA甲基化胞嘧啶水平的差别。可见,雄性林蛙肝脏和脑干中DNA甲基化水平高于雌性,肌肉和皮肤雄性低于雌性。
测定结果可见,中国林蛙受到汞和甲基汞胁迫后,体内某些组织器官DNA甲基化程度会发生一定的变化,污染区林蛙肝脏和皮肤的DNA胞嘧啶甲基化水平比对照区林蛙高,而肌肉和脑干DNA甲基化水平下降。推测与林蛙长期暴露在汞污染的环境中有关。前人的工作证明,重金属暴露能降低或提高哺乳动物肝细胞中DNA甲基转移酶(DNMTs )的活性,使基因组DNA发生甲基化。周新文等人的实验结果表明,肝脏细胞中的DNA总甲基化水平一般是较低的,如果暴露于含重金属离子的水体中时,其甲基化水平就会大大提高[12]。其主要机制认为,混合重金属离子的暴露诱发了鲫鱼组织的脂质过氧化作用,继而产生的自由基可以使DNA链发生断裂,更加速了DNA甲基化水平的提高。Takiguchi 等[13]曾用镉处理大鼠TRL1215肝脏细胞, 发现镉暴露时间短时,降低了DNMTs活性,并基因组DNA 发生低甲基化,镉暴露时间长时,则提高DNMTs活性发生基因组DNA的高甲基化。葛才林等[14]的实验发现,当进入细胞内的重金属浓度较低时,可能会对相应细胞DNA中胞嘧啶的甲基化起促进作用,相反,当进入细胞内的重金属浓度较高时,可能会对相应细胞DNA中胞嘧啶的甲基化起抑制作用。朱国念等[6]通过实验证明,多种重金属离子混合条件下,鲫鱼肝脏细胞的DNA总甲基化水平会由低迅速提高,干扰鲫鱼细胞的正常生理周期和基因表达,引发水生生物的基因毒性作用。从本次实验结果可见,重金属汞的污染,可以使林蛙体内不同组织器官DNA甲基化表现出不同的变化。也可以认为,环境中重金属汞离子进入林蛙体内含量的不同,可能会促进或抑制其体内甲基化水平的变化,从而引起林蛙的基因毒性作用。
除此之外,温度[15]、营养供给[16 ]和辐射[17]等都能引起动物体内DNA 甲基化水平的变化。Varriale 等[18]发现南极鱼类甲基化程度高于热带鱼类, 提示动物在进化的过程中体温与机体DNA 甲基化可能存在反比关系。因此,也说明夹皮沟地区存在使林蛙体内DNA甲基化水平发生变化的条件。
总之,通过气相色谱和液相色谱测定了夹皮沟金矿附近的河流水、沉积物、中国林蛙样品中的甲基汞含量以及林蛙各组织器官中DNA甲基化水平。发现:(1)研究区内老牛沟河和山麻河水体为甲基汞中度污染;沉积物为极高环境风险;中国林蛙体内不同部位的甲基汞浓度普遍高于对照点,说明了金矿开采对周围地区生态环境造成了比较严重的汞污染;(2)中国林蛙体内甲基汞含量分布为:皮肤>脑干和肝脏>卵;雌蛙和雄蛙无明显差别;地区分布总体上表现为污染区高于对照区,五道沟>马家店>二道沟>辉南;(3)污染区林蛙肝脏和皮肤的DNA胞嘧啶甲基化水平高于对照区,肌肉和脑干则低于对照区;不同性别林蛙组织器官DNA胞嘧啶甲基化水平为肝脏和脑干雄性高于雌性,肌肉和皮肤雄性低于雌性。证明金矿开采区河流水体、沉积物的汞污染对林蛙体内组织器官DNA甲基化水平有一定影响,环境中重金属汞离子进入林蛙体内含量的不同,可能会促进或抑制其体内甲基化水平的变化,引起基因毒性作用。
[1] Doerfler W. On the biological significance of DNA methylation [J]. Biochemistry (Moscow), 2005,70(5): 505-524
[2] Morris J. Genes, genetics, and epigenetics: A correspondence [J]. Science. 2001, 293(5532): 1103-1105
[3] Weidman J R, Dolinoy D C, Murphy S K, Jirtle RL. Cancer susceptibility: epigenetic manifestation of environmental exposures. Cancer J. 2007, 13(1): 9-16
[4] 曹家雪, 张红平, 杜立新.环境因素对DNA 甲基化的影响[J]. 遗传, 2013, 35(7): 839-846
Cao J X, Zhang H P, Du L X. Influence of environmental factors on DNA methylation[J]. Hereditas(Beijing). 2013, 35(7): 839-846 (in Chinese)
[5] Lee Y W, Broday L, Costr M. Effects of nickel on DNA methyltransferase activity and genomic DNA methylation levels [J]. Mutation research, 1998, 31: 213-218
[6] Hix S, Augusto O. DNA methylation by tert-butyl hydroperoxide-iron(2): A role for the transition metal ion in production of DNA baseadducts [J]. Chemico-Biological Interactions, 1999, 118(2): 141-149
[7] Yee D, McKee L J, Oram J J. A regional mass balance of methylmercury in San Francisco Bay, California, USA. Environmental Toxicology and Chemistry. 2011, 30(1): 88-96
[8] Santoyo M M, Flores C R, Torres A L, Wrobel K, Wrobel K. Global DNA methylation in earthworms: A candidate biomarker of epigenetic risks related to the presence of metals/metalloids in terrestrial environments [J]. Environmental pollution, 2011, 159(10): 2387-2892
[9] 朱国念,周新文,孙锦荷.混合重金属离子诱导的鲫鱼DNA损伤与基因表达[J]. 核农学报, 2003, 17 (3): 199-202
Zhu G N, Zhou X W, Sun J H. DNA damage and its gene expression of fish induced by mixture-metals [J]. Acta Agriculturae Nucleatae Sinic, 2003, 17 (3):199-202 (in Chinese)
[10] 曹哲明, 杨 建. 背角无齿蚌不同组织的基因组DNA甲基化分析[J]. 生态环境学报, 2009, 18(6): 2011-2016
Cao Z M, Yang J. Analysis of the methylation in genome DNA from different tussues of Anodonta woodiana [J]. Ecology and Environmental Sciences, 2009, 18(6): 2011-2016 (in Chinese)
[11] 李雅芬, 王 景, 王 宁. 松花江上游金矿开采区河流水体和沉积物中汞的污染特征及风险评估[J]. 农业环境科学学报, 2013,32(3):622-628
Li Y F, Wang J, Wang N. Distribution characteristics and risk assessment of mercury pollution in the river water and sediment of the Songhua River upstream gold mining area [J]. Journal of Agro-Environment Science, 2013, 32(3): 622-628 (in Chinese)
[12] 周新文, 朱国念, 孙锦荷, 等. Cu、Zn、Pb、Cd及其混合重金属离子对鲫鱼DNA(Carassius aruatus)甲基化水平的影响[J]. 中国环境科学, 2001, 21(6): 549-552
Zhou X W, Zhu G N, Sun J H, et al. Influence of Cu, Zn, Pb, Cd and their heavy metaltion misture on the DNA methylation level of the fish (Carassius aruatus) [J]. China Environmental Science, 2001, 21(6): 549-552 (in Chinese)
[13] Takiguchi M, Achanzar W E, Qu W, Li GY, Waalkes MP. Effects of cadmium on DNA-(Cytosine-5) methy-ltransferase activity and DNA methylation status during cadmiuminduced cellular transformation [J]. Experimental Cell Research, 2003, 286(2): 355-365
[14] 葛才林, 杨小勇, 刘向农, 等.重金属胁迫对作物DNA胞嘧啶甲基化的影响[J]. 农业环境保护, 2002, 21(4): 301-305
Ge C L, Yang X Y, Liu X N, et al. Effect of heavy metal stress on levels of methylation in DNA of crop[J]. Agro-Environmental Protection, 2002, 21(4): 301-305
[15] Navarro-Martín L, Vi as J, Ribas L, et al. DNA methylation of the gonadal aromatase (cyp19a) promoter is involved in temperaturedependent sex ratio shifts in the European sea bass [J]. PLoS Genetics, 2011, 7(12): e1002447
[16] Lyko F, Foret S, Kucharski R, et al. The honey bee epigenomes: Differential methylation of brain DNA in queens and workers [J]. PLoS Biology, 2010, 8(11): e1000506
[17] Kovalchuk O, Burke P, Besplug J. Methylation changes in muscle and liver tissues of male and female mice exposed to acute and chronic low-dose X-ray-irradiation [J]. Mutation Research, 2004, 548(1-2): 75-84
[18] Varriale A, Bernardi G. DNA methylation and body temperature in fishes [J]. Gene, 2006, 385: 111-121
◆
InVivoDNAMethylationLevelsofRanaChensinensisinGoldMiningArea
Li Yafen, Wang Ning*, Bai Jianwen
School of Environment, Northeast Normal University, Changchun 130024, China
16 May 2014accepted25 June 2014
The river water, sediment and Rana Cheninensis samples in a mountain area near a gold mine were collected and the control samples were collected from none-polluted area. The Hg contamination and its molecular influencing on different organs of Rana Cheninensis were studied. The amount of methyl mercury (Me-Hg) of these samples were tested with gas chromatography and the amount of cytosine (c) and 5-methylcytosine (5-mc) in organs of Rana Cheninensis were measured by using HPLC. The results showed that river water and sediment around gold mine were contaminated with Me-Hg. The amount of Me-Hg in Rana Cheninensis from the contaminated area was higher than that of the control area. Significant DNA methylation discrepancy was found in control and the experimental groups. The methylation levels of liver and skin tissues were higher in contaminated Rana Cheninensis, however, they were lower in muscle and brainstem. Interestingly, compared with the female ones, male Rana Cheninensis showed higher DNA methylation level in liver and brainstem but lower DNA methylation level in muscle and skin. These results showed that DNA methylation level in Rana Cheninensis organs could be altered under Hg suppressions. Different amount of methyl mercury in Rana Cheninensis could cause variation in DNA methylation level, and thus accumulated genotoxicity.
methylmercury; DNA cytosine methylation; Rana Chensinensis; organs
国家自然科学基金(40673059); 全国大学生创新性实验
李雅芬(1987-), 女, 硕士研究生, 研究方向为环境毒理学, E-mail: liyf990@nenu.edu.cn;
*通讯作者(Corresponding author): E-mail: nwang@nenu.edu.cn
10.7524/AJE.1673-5897-20140516002
2014-05-16录用日期:2014-06-25
1673-5897(2014)5-956-08
: X171.5
: A
王宁(1952—),女,博士,教授,主要研究方向为元素地表过程及环境效应。
李雅芬, 王 宁, 柏建雯, 等. 金矿区中国林蛙体内DNA甲基化水平[J]. 生态毒理学报,2014, 9(5): 956-963
Li Y F, Wang N, Bai J W, et al. The study of in vivo DNA methylation levels of Rana Chensinensis in Gold Mining area [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 956-963 (in Chinese)

