桑沟湾溶解态汞的生物地球化学行为
李 磊,任景玲,,刘素美,乔旭东,蒋增杰,杜金洲,方建光
1. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛,266100 2. 国家海洋局第二海洋研究所卫星海洋环境动力学国家重点实验室,杭州,310012 3. 中国水产科学研究院黄海水产研究所,青岛,266071 4. 华东师范大学河口海岸学国家重点实验室,上海,200062
桑沟湾溶解态汞的生物地球化学行为
李 磊1,任景玲1,*,刘素美1,乔旭东2,蒋增杰3,杜金洲4,方建光3
1. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛,266100 2. 国家海洋局第二海洋研究所卫星海洋环境动力学国家重点实验室,杭州,310012 3. 中国水产科学研究院黄海水产研究所,青岛,266071 4. 华东师范大学河口海岸学国家重点实验室,上海,200062
作为一种毒性极强的重金属元素,汞在海洋中可以通过海洋生物的呼吸、摄食和吸附等过程被利用,并在沿食物链传递的过程中不断富集,最终危害人类的健康。利用冷原子荧光光度法(CV-AFS)对2011年4月、8月、10月和2012年1月桑沟湾溶解态无机汞(DIHg)和溶解态有机汞(DOHg)的含量进行了测定。结果表明,桑沟湾四个季节DIHg的浓度范围分别为52~865、131~359、31~134和22~119 pmol·L-1,DOHg的浓度范围分别为37~214、52~635、21~98和未检出~51 pmol·L-1。桑沟湾DIHg和DOHg具有相似的分布特征,均呈现出从近岸向外海逐渐降低的趋势,有明显的季节变化。桑沟湾DIHg和DOHg的周日变化与潮汐呈现出较好的负相关关系,且存在明显的昼夜差异。影响桑沟湾DIHg和DOHg分布的主要因素包括河流和地下水的输入、大气的干湿沉降、与黄海的交换、活性气态汞(Hg0)在海-气界面的交换、表层水体发生的光化学还原反应以及养殖生物的清除等。通过初步计算,桑沟湾溶解态汞(TDHg)的存留时间约为(1.27±0.53)年,远远低于大洋。根据美国国家环境保护局汞的质量标准和我国地表水环境质量标准,桑沟湾没有明显的汞污染。但海产品体内富集的汞可能会带来潜在的生态危机和食品安全问题,需要相关部门加以重视,确保桑沟湾养殖产业的平衡发展。
溶解态汞;形态;分布;季节变化;桑沟湾
汞俗称水银,是自然界中常见的一种重金属元素。作为毒性极高的全球性环境污染物,汞具有极强的致癌作用,它能在食物链中传递,严重威胁生态平衡和人类的健康。即便在极低的剂量下,汞对生物的毒性作用依然不容小觑[1-2]。自工业革命以来,频繁的人类活动不仅改变了汞及其化合物的分布格局,也加快了汞在生态系统中的循环,尤其是1956年发生在日本的水俣病事件更是给人们敲响了警钟[3-4]。目前,许多国家都将汞列为环境污染的重点监控物质,并对其生物地球化学行为的研究给予了高度的重视。
汞在海洋中的含量极低,一般只有2~10 pmol·L-1,属于痕量元素的范畴[5-6]。通常情况下,天然海水中总溶解态汞(TDHg,[TDHg] = [DIHg] + [DOHg])主要以溶解态无机汞(DIHg)的形式存在,其中又以Hg2+及其络合物为主[7-8]。受光照和微生物作用的影响,表层水体中也有少量汞以活性气态汞(Hg0)的形式存在,一般不超过无机汞含量的10%[9]。在近岸海域受陆源输入和人为活动的影响,水体中溶解态有机汞(DOHg)的比例往往会显著升高[10-11]。一般认为,有机汞的毒性远远大于无机汞,其中又以甲基汞和二甲基汞的毒性最大[12]。海洋中的汞主要来源于海底火山喷发、河流径流、地下水的输入、工业废水和生活污水的排放、大气沉降、底层沉积物的释放、悬浮颗粒物的吸附解吸以及人类活动等,其中人类活动尤其是工业废水的排放是导致近海汞污染的主要原因[13-17]。通常情况下,海洋中的汞并不稳定,一般会随着温度、盐度、海-气交换能力、生物活动以及氧化还原环境的改变而发生迁移和形态上的转化[18-21]。例如在生物活动较为密集的表层水体,无机汞通常会发生生物甲基化反应,转化为有机汞,或者被生物体所富集,从而清除出水体[22-23]。汞在大洋中属于非保守元素,存留时间约为500年[24-25]。
桑沟湾(122.40°E ~ 122.60°E,37.00°N ~ 37.20°N)位于山东半岛的东部,荣成市境内,湾口向东,是一个典型的半封闭型海湾,面积约为144 km2,平均水深8 m。桑沟湾属于不规则半日潮区,潮差2 m左右。输入桑沟湾的河流主要有沽河、十里河、桑干河等,这些河流均为山溪性河流,年平均径流量为1.7 × 108~2.3× 108m3,约为湾内海水总体积的17%[26]。桑沟湾主要受黄海沿岸流的影响,通常情况下,方向由北向南,海流经北岸进入,沿南岸流出,秋、冬季的影响高于春、夏季[27]。桑沟湾是我国北方重要的养殖基地,养殖面积超过60 km2,年产量超过15万t。在湾外及湾口水深流急处以海带养殖为主,在湾内水浅流缓处以海带和贝类(牡蛎、扇贝、鲍等)间养或以贝类养殖为主[28](如图1)。由于湾内养殖生物的阻碍作用,桑沟湾的水动力状况在不同的季节变化很大。例如在养殖生物生长旺盛的春、夏季,湾内海水的平均半交换周期分别为38.5 d和45.5 d,而当秋、冬季海带等生物收获以后,湾内海水的交换能力明显加强,平均半交换周期只有30 d左右[29]。
目前我国对于桑沟湾海区已经开展了大量的研究工作。闫哲等[30]和张国玲等[31]曾在2006年对桑沟湾海域痕量元素砷和铝的分布及季节变化进行了初步地研究和探讨。本文在前人研究的基础上,对桑沟湾2011年4月至2012年1月春、夏、秋、冬4个季节海水中DIHg和DOHg含量进行了测定,研究和探讨了DIHg和DOHg在桑沟湾养殖区的分布、季节变化及其影响因素,估算了TDHg在桑沟湾养殖区的收支状况,以期为桑沟湾的生态环境管理提供科学依据。
1 材料与方法(Materials and methods)
1.1 站位设置和样品采集
分别于2011年4月、8月、10月和2012年1月对桑沟湾进行了调查采样,其中水深小于5 m的站位(含5 m)只采表层水,采样站位如图1所示。同时,对桑沟湾附近的爱莲湾和俚岛湾(共3个断面)进行了相同的实验观测,用于对比不同水文环境对桑沟湾溶解态汞的分布及季节变化的影响。不同养殖生物对溶解态汞的富集倍数可能有很大的差异,为了方便讨论和计算,我们将研究区域细化为海带养殖区、牡蛎养殖区、扇贝养殖区以及混合养殖区等四个主要的养殖区域(如图1所示),并在不同的养殖区合理布置观测站位,定量分析养殖生物对溶解态汞的海洋生物地球化学行为的影响。另外,图中还给出了2012年6月桑沟湾补充调查航次中桑沟湾周边主要河流和地下水的观测站位,其中河流采样点位于河流的中下游(水样盐度为0),距入海口约3 ~ 10 km,包括沽河、八河水库、十里河等;地下水采集于桑沟湾周围的6处井水。为了进一步探讨潮汐作用对桑沟湾溶解态汞分布的影响,于2013年4月和10月先后两次对北岸寻山站(D1)和南岸楮岛站(D2)进行了同步的25 h连续采样与观测,采样频率为每3 h一次。

图1 桑沟湾调查站位示意Fig. 1 Sampling locations in the Sanggou Bay
所有样品均用有机玻璃采水器采集,采水器内壁在采样前用分析纯的酒精和Milli-Q水清洗。采样所用的采样桶和盛装样品所用的玻璃瓶在使用前均用1:5的盐酸浸泡一周,然后先后用蒸馏水和Milli-Q水洗净,装入双层塑料袋中备用。所有样品采集后用经盐酸处理过的Nalgene滤器和0.45 μm的醋酸纤维膜过滤,然后经浓硝酸酸化后保存(pH = 2)。现场用Milli-Q水过滤做空白水样,以考察采样条件对样品中痕量元素的影响。所有样品均于采集后半年内完成测定,同一样品中DIHg和DOHg的含量也于同一天内完成测定,符合痕量元素汞的测定要求[32-33]。航次中温、盐数据均通过Multi 350i 多参数水质分析仪现场测定获得。
1.2 样品测定
在实验室中利用冷原子荧光光度法(CV-AFS)对样品中DIHg的含量进行测定,即在1 mol·L-1的介质中,海水中的Hg2+被KBH4还原为汞蒸气,然后进入原子荧光光谱仪测定。该方法的检出限(3σ)为10 pmol·L-1,对0.05 μg·L-1和0.5 μg·L-1的样品进行9次平行测定的相对标准偏差均小于2.8%,对国家环境标准样品(4.06±0.32) μg·L-1的测定结果为(4.13±0.24) μg·L-1,二者无显著性差异(t检验,P<0.05,n=7)。样品中DOHg的测定则是在酸性条件下加入KMnO4,将水体中DOHg完全转化为DIHg,待反应充分后,再加入NH2OH·HCl将过量的KMnO4还原,然后按照DIHg的测定方法用CV-AFS进行测定,测定结果与DIHg的差值即为水体中DOHg的含量。利用该方法分别对甲基汞(GBW08675)和乙基汞(GBW081524)的国家标准物质进行了9次平行测定,其回收率分别为94.4%~106.2%(平均97.9%)和92.1%~104.5%(平均95.8%),精密度好于5%,方法的检出限(3σ)为20 pmol·L-1。叶绿素a(Chl-a)的数据则参照“海洋监测规范”,利用Turner II型荧光光度计测定获得。
2 结果与讨论(Results and discussion)
2.1 桑沟湾溶解态汞的含量与分布
表1给出了四个季节不同航次桑沟湾表层海水中DIHg和DOHg的含量。由表可知,桑沟湾DIHg的含量春季最高,夏季次之,秋、冬季最低,存在明显的季节性差异(t检验,P< 0.05,n = 19)。受生物活动影响显著的DOHg的含量则是夏季最高,春季次之,冬季最低。DOHg与TDHg的比值在夏季最高,春季最低。桑沟湾海域DIHg的平均浓度约为(222±92) pmol·L-1,约为黄海近岸海水中DIHg浓度(11~27) pmol·L-1的10倍左右[34],尤其是在春、夏季,而秋、冬季桑沟湾大部分海域DIHg的浓度与黄海差别不大。桑沟湾海域DOHg的平均浓度约为(139±65) pmol·L-1,远远高于黄海中DOHg的浓度(2~5) pmol·L-1[34]。由于桑沟湾水深较浅,通过显著性比较,桑沟湾表层海水中DIHg与DOHg的含量与底层相比并无显著性差异(t检验,P < 0.05, n=19)。
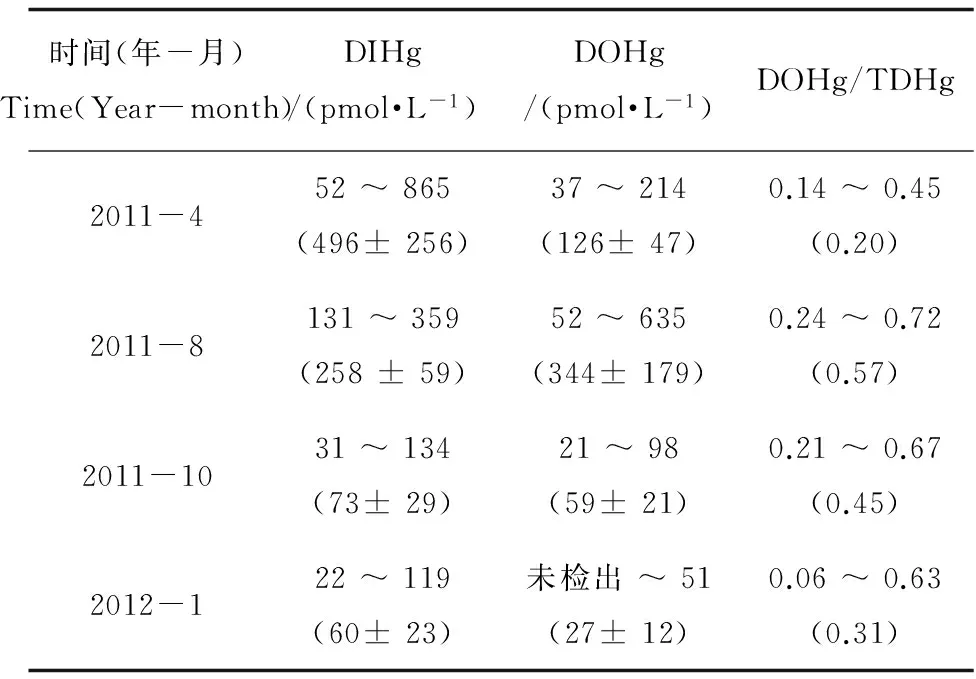
表1 桑沟湾表层海水中DIHg和DOHg的浓度范围以及DOHg与TDHg的比值Table 1 Concentration ranges of DIHg, DOHg and DOHg/TDHg ratios in surface waters of the Sanggou Bay
注: 括号内为平均值。
Note: Mean values are shown in the parenthesis.
图2给出了四个季节桑沟湾表层海水温度、盐度、DIHg和DOHg浓度的分布状况。根据温、盐分布可以看出,桑沟湾春、夏季水温由近岸向外海逐渐降低,且变化梯度较大;秋、冬季则与之相反,变化梯度并不明显。盐度与之有类似的分布特征,尤其在8月,近岸处可以观察到十分明显的淡水舌。这种分布特征与桑沟湾的生物养殖有着密切的关系。春、夏季是湾内养殖生物逐渐成熟的时期,湾内大量养殖生物(尤其是湾口处养殖的海带,成熟海带体长可达4 m)的存在严重阻碍了湾内、外水体的交换,而桑沟湾平均水深只有8 m左右,这就意味着在吸收同等热量的情况下湾内水温要比湾外升高得快。与此同时,随着夏季丰水期的到来,大量淡水的输入使得桑沟湾与外海之间形成了十分明显的盐度梯度差。相反,秋、冬季由于湾内海带等绝大多数的养殖生物已经收获,湾内、外水体交换顺畅,湾外海水的入侵使得湾内和湾外的温、盐差别不大。
桑沟湾DIHg的分布基本上呈现出从近岸向外海逐渐降低的趋势,最大值往往出现在河口处,但是在秋、冬季北侧湾口处也常常可以观测到相对高浓度的DIHg,这可能与黄海沿岸流的输送有关。DOHg的分布状况与DIHg类似,也表现出近岸高、外海低的分布特点,尤其在扇贝和牡蛎养殖区,DOHg的含量往往较高。桑沟湾DIHg和DOHg的含量在春、夏季变化梯度比较明显,这可能与夏季陆源输入较强以及养殖期海水交换受阻有关。相反,秋、冬季湾内海水混合比较均匀,除河口区个别站位的含量较高,其他站位的变化不大。桑沟湾DOHg与TDHg的比值在四个季节中没有明显的分布规律,春、夏季最大值往往出现在桑沟湾中部,而秋、冬季则出现在河口区。
爱莲湾和俚岛湾位于山东半岛最东端,与桑沟湾相邻或相近(如图1)。随着养殖范围的不断扩大,爱莲湾和俚岛湾也布满了较为密集的养殖筏架,以养殖海带为主,近岸部分海域养殖了少量的贝类[35]。由于同属山东省荣成市,三个海湾拥有几乎相同的气候条件。但就水文环境而言,它们之间存在比较明显的差异。图3给出桑沟湾、爱莲湾和俚岛湾4个季节TDHg浓度的对比。从中可以看出,春、夏季桑沟湾水体中TDHg的平均浓度远远高于爱莲湾和俚岛湾。养殖生物的阻碍作用使河流输入、底层沉积物的再悬浮释放所带来的高浓度汞得以在桑沟湾内富集,而爱莲湾和俚岛湾陆源输入较少且水体交换顺畅,外海水的稀释作用使得湾内汞的含量迅速降低。夏季桑沟湾DOHg的浓度显著升高,较强的陆源输入和养殖生物自身的吸收和转化可能是导致该现象出现的主要原因。然而该现象在爱莲湾和俚岛湾却并不显著,这可能与夏季爱莲湾和俚岛湾水体中产生的DOHg可以在与外海水的交换过程中迅速迁出有关。秋、冬季由于外海水的入侵,桑沟湾、爱莲湾和俚岛湾TDHg的平均浓度基本相同。

图2 桑沟湾表层海水温度/oC、盐度、DIHg/(pmol·L-1)以及DOHg/(pmol·L-1)的平面分布Fig. 2 Horizontal distributions of temperature/oC, salinity, DIHg/(pmol·L-1) and DOHg/(pmol·L-1) in the surface layer of the Sanggou Bay

图3 桑沟湾、爱莲湾和俚岛湾TDHg的平均浓度Fig. 3 TDHg concentrations of Sanggou Bay, Ailian Bay and Lidao Bay
世界部分海湾、河口以及大洋中DIHg的浓度如表2所示。通过对比可以看出,桑沟湾DIHg的含量低于受工业活动污染比较严重和河口和海湾,例如斯凯尔特河口、伊兹密尔湾等,与胶州湾,长江口的含量相当,略高于黄海和东海的浓度,约为大洋中DIHg含量的50 ~ 100倍。桑沟湾海水中DIHg的平均含量低于美国环境保护局汞的标准值[41](0.8 nmol·L-1)。根据中华人民共和国地表水环境质量标准[42],桑沟湾属于一级水质(< 0.25 nmol·L-1)。

表2 世界其他海域溶解态无机汞的浓度Table 2 Concentrations of dissolved inorganic mercury in other regions of the world
因此,桑沟湾目前不存在明显的人为污染,汞的含量处于自然状态。
2.2 桑沟湾溶解态汞的周日变化
表3给出了2013年4月和10月桑沟湾连续站表层海水中DIHg和DOHg的浓度以及DOHg与TDHg的比值。由表可知,2013年4月桑沟湾D1站DIHg和DOHg的含量分别为446 pmol·L-1和103 pmol·L-1,均远远低于D2站,而2013年10月二者之间则没有显著性差异(t检验,P< 0.05,n = 10)。桑沟湾4月水体中DIHg的含量远远高于10月,而DOHg的含量与10月相比则差别不大,DOHg与TDHg的比值则是4月低于10月。这一结果与2011年大面站的观测结果基本吻合,说明桑沟湾DIHg和DOHg的浓度均存在明显的季节变化。4月由于湾内密集养殖生物的阻碍,湾内DIHg和DOHg的浓度远远高于外海,且在湾口处存在明显的浓度梯度,因此在潮汐作用下连续站DIHg和DOHg的周日变化十分显著。相反,10月由于黄海沿岸流及湾内水交换能力的加强,桑沟湾大部分海域与黄海近岸DIHg和DOHg的含量差别不大,因此连续站观测到的DIHg和DOHg的周日变化幅度较小,远远低于4月的观测结果。与大面站观测结果相同,连续站表、底层DIHg和DOHg的含量也不存在显著性差异(t检验,P < 0.05,n = 10)。

表3 桑沟湾连续站表层海水中DIHg和DOHg的浓度以及DOHg与TDHg的比值Table 3 Concentration ranges of DIHg, DOHg and DOHg/TDHg ratios in surface waters of anchor stations in the Sanggou Bay
注:括号内为平均值。
Note: Mean values are shown in the parenthesis.
2013年4月连续站潮汐、DIHg和DOHg的周日变化如图4所示。从图中可以看出,桑沟湾DIHg和DOHg的周日变化与潮汐呈现出较好的负相关关系,即涨潮期DIHg和DOHg的含量会随着时间的变化而逐渐降低,落潮期则与之相反,DIHg和DOHg的含量随着时间的变化逐渐升高,最大值往往出现在低潮时。桑沟湾DIHg和DOHg的含量存在明显的昼夜差异。忽略不规则半日潮在两个潮周期内的变化,2013年4月D1站DIHg的含量在白天的最高值为496 pmol·L-1,低于夜间的最大浓度(572 pmol·L-1)。在10月同样可以观测到这一现象,白天DIHg的最高含量为122 nmol·L-1,而夜间的最大浓度为141 nmol·L-1,高出白天近16%。DOHg的平均含量与DIHg相反,白天的浓度高于夜晚,存在显著性差异(t检验,P < 0.05,n = 10)。此外,对比D1站和D2站DIHg和DOHg的观测结果可以发现,两个航次中D1站DIHg和DOHg的浓度随潮汐的变化范围较D2站相比更大一些,这表明桑沟湾北岸受潮汐作用的影响可能比南岸更为显著。
2.3 影响桑沟湾溶解态汞分布的主要因素
2.3.1 河流、地下水的输入及与黄海的交换
流入桑沟湾的河流主要包括沽河、十里河、桑干河、崖头河等,其中沽河占荣成市河流总径流量的70%以上,是流入桑沟湾最大的河流(2011年荣成市河流年报)。另外,荣成市最大的水库—八河水库也会在泄洪时将淡水排入桑沟湾。图5给出了桑沟湾2012年主要河流和地下水站位DIHg和DOHg的含量。从图中可以看出,桑沟湾河流中DIHg和DOHg的平均浓度分别为(522±171) pmol·L-1和(614±262) pmol·L-1,均高于夏季桑沟湾海水中DIHg和DOHg的含量。除八河水库外,桑沟湾主要河流中DOHg的含量均高于DIHg的含量,这可能与人类活动和水体富营养化有关。桑沟湾地下水中DIHg的含量普遍较低,除GW-1站之外,其他站位的平均浓度只有12 pmol·L-1。GW-1站位地下水采集于楮岛码头的一处废弃深井,可能由于码头施工和作业等人为因素的影响,除了汞之外,该站位地下水中砷[43]、硒、铁(未发表数据)等元素也都出现超标现象。地下水中DOHg的含量极低,大多数站位DOHg的浓度都低于检出限。利用镭同位素计算得到的地下水(地下淡水+海水再循环水)通量表观值约为河流通量的30倍左右(未发表数据),即便按5%的比例计算地下淡水的输入[44,45],其流量也高于河流,因而其对桑沟湾溶解态汞尤其是溶解态无机汞的影响不容忽视。

图4 2013年4月桑沟湾连续站潮汐、DIHg和DOHg的周日变化Fig. 4 Diurnal variations of tide, DIHg and DOHg in the anchor stations of the Sanggou Bay in April 2013
由于部分河流径流量太小,缺乏准确的数据支持,暂且忽略其他河流对桑沟湾DIHg和DOHg分布的影响,以沽河为例来估算河流对桑沟湾DIHg和DOHg的贡献量。河流入海通量(mol·a-1)可以用沽河河水中DIHg或DOHg的含量(mol·m-3)与沽河年径流量(m3·a-1)的乘积求得。代入数据计算可以得到沽河每年输入桑沟湾的DIHg总量约为(18.2±6.0) kg,而每年输入桑沟湾DOHg的总量约为(19.0±8.1) kg,其中在丰水期输入的总量超过全年输入总量的80%。这表明河流的输入可能是桑沟湾内DIHg和DOHg的重要来源,这也是桑沟湾河口和近岸海域总能监测到较高浓度的DIHg和DOHg的重要原因。
同理可以计算溶解态汞通过地下水输入桑沟湾的总量。代入数据计算可得,每年地下水向桑沟湾输入DIHg的总量约为(11.7 ± 3.5) kg,尤其在降雨量丰富的夏季,地下水对湾内DIHg的贡献尤为显著。由于大部分站位DOHg的浓度均低于检出限,故在此忽略地下水对桑沟湾DOHg的贡献。
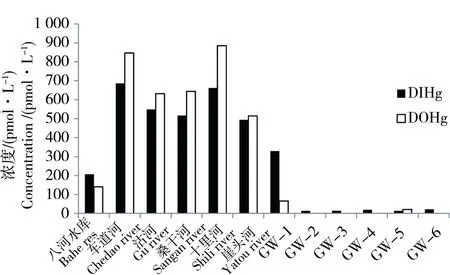
图5 2012年丰水期桑沟湾沿岸主要河流和地下水中DIHg和DOHg的含量Fig. 5 Concentrations of DIHg and DOHg in the flood season of 2012 in the main streams and the ground water (GW) emptying into the Sanggou Bay
最后,桑沟湾海水与黄海的交换也会影响到湾内DIHg和DOHg的分布。由于黄海中DIHg和DOHg的含量极低,在养殖期由于养殖生物的阻碍作用使得湾内、外水体交换滞缓,大量的陆源输入让DIHg和DOHg在湾内得以富集,含量显著升高。但随着秋、冬季养殖生物的收获,桑沟湾海水的半交换周期缩短,黄海水的入侵对湾内高浓度的DIHg和DOHg反而起到了稀释的作用,这也就是为何桑沟湾在秋、冬季DIHg和DOHg的浓度低于春、夏季的主要原因,连续站对潮汐的观测结果也从侧面印证了这一过程的发生。根据水文组在一个朔望月内对桑沟湾南、北岸水量的观测结果,可以计算出黄海平均每年向桑沟湾输入的水量约为876×108m3·a-1(未发表数据)。桑沟湾河流和地下水的年径流量约为4.2×108m3·a-1,海水年蒸发量约为1.5×108m3·a-1,年降水量为1.3×108m3·a-1[46],忽略污水排放等其它因素的影响,通过水交换平衡,可以计算出桑沟湾向黄海的年输出水量约为880×108m3·a-1。根据连续站的观测结果,涨潮时(前一个低潮时到下一个高潮时)入湾海水中TDHg的平均浓度在4月和10月分别为(548±121) pmol·L-1和(201±46) pmol·L-1,落潮时(前一个高潮时到下一个低潮时)出湾海水中的平均浓度则分别为(613±166) pmol·L-1和(169±35) pmol·L-1。以4月的观测结果代表养殖期(4月至8月)的端元浓度,10月的观测结果代表非养殖期(9月至次年3月)的端元浓度,根据公式Ci·Qi-Co·Qo(Ci和Co分别代表入、出湾海水中TDHg的平均浓度,Qi和Qo则分别代表不同时期黄海输入桑沟湾和桑沟湾向黄海输出的水量)即可计算出桑沟湾每年向黄海输出TDHg的量约为(147.4±64.8) kg。
2.3.2 大气的干、湿沉降
大气的干、湿沉降通常是海水中TDHg的主要来源之一。分别于2011年8月和2012年1月采集桑沟湾雨水样品,经0.45 μm醋酸纤维膜过滤后,测定样品中DIHg和DOHg的浓度,结果如表4所示。桑沟湾夏季雨水中DIHg的含量低于冬季,北方城市冬季燃煤取暖等人类活动向大气中排放过量的汞可能是导致该现象出现的主要原因。桑沟湾雨水中DOHg的含量极低,略高于检出限,且没有明显的季节变化。夏季雨水中DOHg与TDHg的比值略高于冬季,光化学还原和潜在的光致甲基化过程可能是导致这种现象的主要原因[47,48]。桑沟湾雨水中TDHg的平均浓度为106 pmol·L-1,年降雨量约为1.3×108m3,因此可以初步估算出大气湿沉降对桑沟湾水体TDHg的贡献量约为(2.8 ±1.2) kg·a-1。通过对比世界其他海域的观测结果[12,18,34]以及桑沟湾往年降雨量的变化,该计算结果的不确定度约为40%。
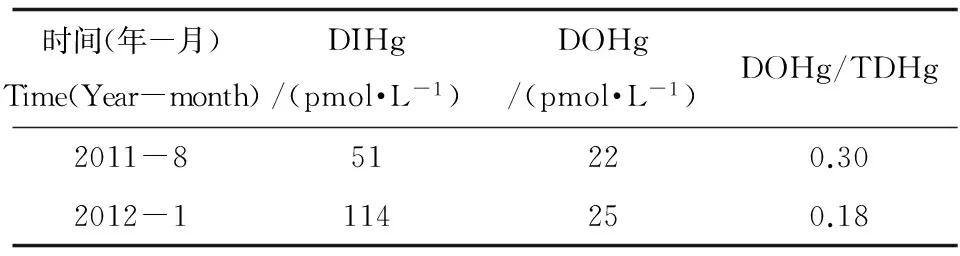
表4 桑沟湾雨水中DIHg和DOHg的含量以及DOHg与TDHg的比值Table 4 Concentrations of DIHg, DOHg and DOHg/TDHg ratios in the rain of the Sanggou Bay
大气中汞的干沉降主要通过测定气溶胶颗粒物中汞的沉降通量和溶出率来计算,目前气溶胶颗粒物中汞的测定多采用淋溶实验来完成。由于缺乏相关的观测数据,通过对世界其他近岸海域相关文献的查阅可以发现,在没有明显人为污染的情况下大气汞的干沉降量在不同海域的差别很小,约为150~200 pmol·m-3·d-1[17,22,49]。因此,为了方便后文的计算和讨论,本文采用世界其他近岸海域、河口及海湾的大气沉降通量的平均值和溶出率进行初步估算,可以得到桑沟湾大气干沉降对水体中TDHg的年贡献量约为(1.7±0.4) kg·a-1。
2.3.3 海-气界面的交换与光化学还原反应
表层海水中DIHg主要包括两种形态,即溶解态无机汞(Hg2+)和活性气态汞(Hg0)。汞在海-气界面有99.9%以上都是以Hg0的形式进行交换,这也是大洋表层水体中DIHg迁出或者迁入的主要途径之一,其方向主要取决于大气和表层海水中Hg0的浓度梯度[50]。海气界面DIHg的交换通量可以由下列公式进行计算[9,18,51]:
F = K·ΔC
ΔC = Cw-(Ca/H)
K = 0.31u2(ScHg/ScCO2)-0.5
式中F代表交换通量(pmol·m-2·d-1),K代表气体交换输运速率(m·d-1),ΔC代表气体的浓度梯度(pmol·m-3),Cw代表水体中Hg0的浓度(pmol·m-3),Ca代表大气中Hg0的浓度(pmol·m-3),H代表亨利定律常数,u代表风速(m·s-1),ScHg和ScCO2则分别代表汞和二氧化碳的施密特数。从上述公式中可以看出,在一定温度和风速条件下,K基本上是一个常数,大气中Hg0的含量在没有明显人为干扰的情况下也比较稳定,因此影响海-气界面交换通量的主要因素在于海水中Hg0浓度。经分析可知,春季到夏季桑沟湾海域DIHg的含量明显降低,忽略陆源输入的影响,其损失速率高达16.1 nmol·m-2·d-1,而实际损失速率可能更高。损失的DIHg部分可能被养殖生物富集,或者转化为DOHg清除出水体;另一部分则很有可能通过海-气界面向大气中释放。该推断与黄海近岸[50]及胶州湾[40]的测定结果十分吻合。
光化学还原反应是促进表层水体中Hg2+向Hg0转化的主要方式之一[52]。紫外光的辐射强度对海水中Hg0的生成起决定性作用,辐射强度越大,还原反应进行得越快[47]。除了光照强度之外,水体中的氧化还原环境也会对该反应产生较大的影响[5]。表层海水中Hg2+和Hg0存在化学平衡,高温、强光和还原环境将有利于该平衡向生成Hg0的方向移动[18,51]。通过上文的讨论可知,桑沟湾DIHg的迁出主要发生在4月至8月期间,而这一时期恰好满足光化学还原反应发生的有利条件。随着春、夏季温度的不断升高,紫外线辐射强度不断增强,养殖生物的呼吸作用导致水体中溶解氧的含量也有所降低(尤其在扇贝和牡蛎养殖区,实验室未发表数据),这些因素促使表层水体中大量的Hg2+被还原为Hg0,然后经海-气界面释放到大气中,从而降低水体中DIHg的含量。2013年连续站的观测结果也可以印证光化学还原过程的发生。考虑到生物活动的昼夜差异,为了尽可能避免生物活动的干扰,选取10月D1站(非养殖期、湾口处)对光化学还原过程进行初步的估算。以夜晚低潮时水体中DIHg含量作为背景值,通过计算可以发现,在光照充足的白天,桑沟湾表层海水中约有21 pmol·L-1的DIHg被清除出水体。忽略因不规则半日潮和少量生物转化作用所导致的计算误差,表层水体中有相当可观的Hg2+被还原为Hg0,而这一过程在日照充足的夏季可能更为显著。
由于本文缺乏表层水体中Hg0的相关数据,因而无法直接进行定量的计算。为了便于后文的讨论和估算,考虑到桑沟湾与胶州湾具有相似的地理位置和气候条件,本文参考胶州湾冬季海水向大气释放Hg0的通量[40](102±39) pmol·m-2·d-1进行初步估算。结果表明,桑沟湾表层水体向大气中释放Hg0的通量约为(1.0±0.4) kg·a-1。通常情况下,由于夏季Hg0在海-气界面的交换速率高于冬季,因此该计算结果可能偏低,海-气界面的交换对于湾内DIHg分布的影响不容忽视。
2.3.4 生物活动的清除作用
图6给出了桑沟湾2011年8月水体中DOHg与TDHg的比值和Chl-a的相关关系。从图中可以看出,除图中圆圈标注的站位外,DOHg/TDHg与Chl-a具有较好的正相关关系(r=0.62,P<0.05,n=16)。圆圈中的站位主要位于沽河和八河水库的入海口,该处Chl-a的含量较低,但DOHg与TDHg的比值却很高,这可能与表层水体中DOHg的来源并不单一有关。除了浮游生物的甲基化过程,夏季较强的陆源输入可能是导致水体中DOHg比例显著升高的主要原因之一。另外,表层水体的光致甲基化过程也会将DIHg转化为DOHg。
海洋生物对于海水中汞的富集作用是使其迁移出水体的主要途径,也是海洋中汞对人类产生毒害作用最主要的方式。海洋中的细菌、藻类、贝类和鱼类都可以通过甲基化反应,将上层水体中的DIHg转化为DOHg,然后在体内积累[53]。这种富集过程不具有选择性和主观意愿,当水体受到一定的汞污染后,养殖生物就会通过呼吸、体表吸附、皮肤吸收和摄食等多种途径吸收水体中的汞,尤其是摄食过程,会导致高浓度的汞在生物体内富集并沿食物链传递[54]。桑沟湾养殖了大量的海带、贝类和鱼类,这些养殖生物在生长过程中都会对水体中的汞进行富集,只是富集倍数存在一定的差异。刘永懋和翟平阳[55]在1996年通过加富培养实验发现,海洋生物对DIHg的富集倍数较低,只有几十倍左右,而对DOHg(尤其是甲基汞)的富集倍数很高,例如贝类对甲基汞的富集倍数约为1 140倍左右,海带高达5 000倍左右,而鱼类更高,个别鱼种甚至高达数万倍。根据以上数据,仅考虑海带和贝类对桑沟湾水体中有机汞的清除,其每年的清除量就高达31.4~42.7 kg·a-1,由此可见养殖生物对于桑沟湾内溶解态汞的分布有着至关重要的影响。这些被清除的汞部分会存在于有机碎屑中,以颗粒态汞的形式沉降,并随着时间的推移被底层微生物分解,最终转化为无机汞重新进入水体当中。汞在桑沟湾的这种内部转化过程可能是造成春季湾内无机汞出现明显富集现象的主要原因之一,王晓丽等[56]在2003年对桑沟湾颗粒有机物的迁移转化过程的研究也从侧面印证了这一过程的重要性。湾内养殖生物对于海水中汞的富集可能会导致生物体内汞含量超标,需要相关部门加强监测力度,确保桑沟湾养殖生物的食品安全和海湾的可持续发展。

图6 2011年8月桑沟湾表层海水中DOHg与TDHg的比值和Chl-a的关系Fig. 6 Relationship between the ratios of DOHg/TDHg and Chl-a in surface layer of Sanggou Bay in August 2011
2.3.5 桑沟湾溶解态汞的收支及存留时间
沉积物的再悬浮释放过程对水体中TDHg的贡献不容忽视。由于缺乏相关数据,本文利用与桑沟湾环境特点类似的拉瓦卡湾[57]、旧金山湾[58]和比斯开湾[59]沉积物释放TDHg的平均通量686 pmol·m-2·d-1进行初步估算计算,结果表明,桑沟湾沉积物向水体中释放TDHg的量约为(7.2±4.9) kg·a-1。图7总结了桑沟湾海域TDHg的收支状况。从图中可以看出,桑沟湾TDHg的主要来源包括河流和地下水的输入、沉积物向水体的释放以及大气的干、湿沉降等。向黄海的输出、养殖生物的清除以及表层水体中Hg0向大气的释放则是桑沟湾TDHg主要的汇。根据目前的估算结果,桑沟湾TDHg的源汇不守衡,源小于汇,二者差值为123.0 kg·a-1。通过对现有数据的分析可以发现,冬季到春季期间桑沟湾TDHg出现明显的富集现象,尤其是水体中DIHg的含量增加了约114.6 kg。此时并非汛期,河流和地下水的输入可能不是导致该现象出现的主要原因。而大气的干、湿沉降量十分有限,也无法满足此不平衡项。因此,该收支模型中可能有一个TDHg的重要来源没有考虑在内,例如悬浮颗粒物的解吸和颗粒有机汞的降解释放等,这些过程可能是导致桑沟湾TDHg的收支不平衡的主要因素。Gagnon等[60]在1996年对圣劳伦斯河口底层沉积物中汞的降解释放过程的研究时就曾指出,对于富含有机质的底层水体,颗粒态汞的降解释放过程对底层溶解态无机汞再生的贡献量超过80%。然而由于目前缺少这些过程的相关参数,所以还需要进一步研究计算加以确认。除此之外,计算结果的不确定性可能是导致TDHg收支不平衡的另一个原因。在计算过程中,部分基础参数获得于先前发表的文献而非实时观测数据。与黄海的交换量、大气湿沉降通量的计算所用到的观测样本的数量十分有限,利用两个季节的观测结果来计算全年的平均通量可能存在一定的误差,还需要进一步研究加以佐证。
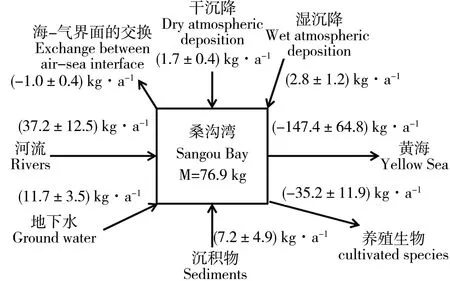
图7 桑沟湾TDHg的收支平衡Fig. 7 The mass balance for mercury in the Sanggou Bay
根据桑沟湾TDHg的收支状况和保有量,可以初步计算出湾内TDHg的存留时间约为(1.27±0.53)a。
综上所述,可以得到以下结论:
(1)桑沟湾DIHg和DOHg的平均浓度分别为(222±92) pmol·L-1和(139±65) pmol·L-1,存在明显的季节性差异。桑沟湾DIHg和DOHg的含量主要表现为从近岸向外海逐渐降低的趋势,且与潮汐呈现出较好的负相关关系,昼夜差异明显。
(2)影响桑沟湾DIHg和DOHg分布的主要因素包括河流、地下水的输入,大气的干、湿沉降,与外海水的交换,Hg0在海气界面的交换,光化学还原反应的发生,浮游生物的甲基化作用以及养殖生物的清除等。经过初步的计算,桑沟湾TDHg的存留时间约为(1.27±0.53) 年。
(3)桑沟湾DIHg的平均浓度低于美国环境保护局汞的标准值和我国地表水环境质量一级水质标准,说明其未受到明显的汞污染。但养殖生物体内富集了大量的有机汞可能会带来潜在的生态危机,需要有关部门严格监控,确保桑沟湾养殖生物的食用安全和生态系统的可持续发展。
致谢:衷心感谢中国水产科学研究院黄海水产研究所、华东师范大学河口海岸学国家重点实验室、国家海洋局第二海洋研究所、中国海洋大学海洋生物地球化学实验室以及荣成市海洋与渔业局的老师和同学们在样品采集、分析以及论文写作过程中提供的帮助和宝贵的建议!
[1] Wallace G T, Seibert J D L,Holzknecht S M, et al. The biogeochemical fate and toxicity of mercury in controlled experimental ecosystems[J]. Coastal and Shelf Science, 1982, 15: 151-182
[2] Shaw W. Heavy metals toxicity[J]. Chinese Chemical Letters, 2008, 2: 437-456
[3] Mahaffey K. Mercury as An Environment Problem: Perspectives on Health Effects and Strategies for Risk Management, International Conference on Mercury as a Global Pollutant [M]. Minamata: 2001
[4] 柯 屾. 该怎样对重金属污染损害说“不”[J]. 环境保护, 2009, 17: 11-19
[5] Mason R P, Sheu G R. Role of the ocean in the global mercury cycle [J]. Global Biogeochemical Cycles, 2002, 16(4): 1093-1118
[6] Sunderland E M, Krabbehof D P, Moreau J W, et al. Mercury sources, distribution, and bioavailability in the North Pacific Ocean: Insights from data and models[J]. Global Biogeochemical Cycles, 2009, 23(2): GB2010
[7] Mason R P, Lawson N M, Lawrence A L, et al. Mercury in the Chesapeake Bay[J]. Marine Chemistry, 1999, 65: 77-96
[8] Gehrke G E, Blum J D, Meyers P A. The geochemical behavior and isotopic composition of Hg in a mid-Pleistocene western Mediterranean sapropel[J]. Geochimicaet Cosmochimica Acta, 2009, 73: 1651-1665
[9] Strode S A, Jaegle L, Selin N E, et al. Air-sea exchange in the global mercury cycle[J]. Global Biogeochemical Cycles, 2007, 21: 1017-1029
[10] Roulet M, Lucotte M, Canuel R, et al.Spatio-temporal geochemistry of mercury in waters of the Tapajos and Amazon rivers, Brazil [J]. Limnology and Oceanography, 2001, 46(5): 1141-1157
[11] Zhang H, Feng X B, Larssen T, et al. Fractionation, distribution and transport of mercury in rivers and tributaries around Wanshan Hg mining district, Guizhou province, southwestern China: Part 1-total mercury[J]. Applied Geochemistry, 2010, 25: 633-641
[12] Mason P R, Fitzgerald W F, Hurley J, et al. Mercury biogeochemical cycling in a stratified estuary[J]. Limnology and Oceanography, 1993, 38(6):1227-1241
[13] Mason R P, Fitzgerald W F, Morel F M M. The biogeochemical cycling of elemental mercury: Anthropogenic influences Geochimicaet Cosmochimica Acta [J]. Geochimicaet Cosmochimica Acta, 1994, 58(15): 3191-3198
[14] Balogh S J, Engstrom D R, Almendinger J E, et al. History of mercury loading in the upper Mississippi River reconstructed from the sediments of lake pepin [J]. Environmental Science and Technology, 1999, 33(19): 3297-3302
[15] Steding D J, Flegal A R. Mercury concentrations in coastal California precipitation: Evidence of local and trans-Pacific fluxes of mercury to North America[J]. Journal of Geophysical Research, 2002, 107: 148-159
[16] Laurier F G J, Cossa D, Gonzalez J L, et al. Mercury transformations and exchanges in a high turbidity estuary: The role of organic matter and amorphous oxyhydroxides[J]. GeochimicaetCosmochimicaActa, 2003, 67(18): 3329-3345
[17] Selin N E, Jacob D J, Park R J, et al. Chemical cycling and deposition of atmospheric mercury: Global constraints from observations[J]. Journal of Geophysical Research, 2007, 112, D02308: 254
[18] Mason R P, Lawson N M, Sheu G R. Mercury in the Atlantic Ocean: factors controlling air-sea exchange of mercury and its distribution in the upper water[J]. Deep-Sea Research, Part II, 2001, 48: 2829-2853
[19] Hedgecock I M, Pirrone N, Trunfio G A, et al. Integrated mercury cycling, transport, and air-water exchange mode[J]. Journal of Geophysical Research, 2006, 111: 203-216
[20] Hollweg T A, Gilmour C C, Mason R P. Mercury and methylmercury cycling in sediments of the mid-Atlantic continental shelf and slope[J]. Limnology and Oceanography,2010, 55(6): 2703-2722
[21] Strode S A, Jaegle L, Emerson S. Vertical transport of anthropogenic mercury in the ocean[J]. Global Biogeochemical Cycles, 2010, 24: 210-220
[22] Mason P R, Fitzgerald W F. Mercury speciation in open ocean waters[J]. Water Air Soil Pollut, 1993, 56: 779-785
[23] Mason R P, Morel F M M, Hemond H F. The role of microorganisms in elemental mercury formation in natural waters [J]. Water Air Soil Pollut, 1995, 80: 775-787
[24] 冯士筰,李凤岐,李少菁. 海洋科学导论[Z]. 高等教育出版社, 1999: 115-118
[25] 周家义,潜琬英,符瑞文,等. 海水中汞的存在形态及其在海水—底质间相互交换研究[J]. 中国海洋大学学报(自然科学版), 1980, 4: 65-73
[26] 中国海湾志编纂委员会. 中国海湾志第三分册[M]. 北京, 海洋出版社, 1991: 377-424
[27] 苏纪兰. 中国近海水文[M]. 中国科学出版社, 2005: 55-61
[28] 蒋增杰, 方建光, 门 强. 桑沟湾贝类筏式养殖与环境相互作用研究[J]. 南方水产, 2006, 2(1): 23-29
[29] 孙 耀, 赵 俊, 周诗赉, 等. 桑沟湾养殖海域的水环境特征[J]. 中国水产科学, 1998, 5(3): 69-75
[30] 闫哲, 任景玲, 刘素美, 等. 桑沟湾总溶解态无机砷的分布与季节变化[J]. 海洋环境科学, 2008, 27(5): 432-436
[31] 张国玲, 任景玲, 张继红, 等. 桑沟湾养殖区铝的分布及季节变化[J]. 海洋环境科学, 2010, 29(6): 843-847
[32] Batley G E, Gardner D. Sampling and storage of natural waters for trace metal analysis[J]. Water Research,1977, 11(9): 745-756
[33] Seibert E L, Dressler V L, Pozebon D, et al. Determination of Hg in seawater by inductively coupled plasma mass spectrometry after on-line pre-concentration[J]. SpectrochimicaActa Part B, 2001, 56: 1963-1971
[34] Ci Z J, Zhang X S, Wang Z W, et al. Phase speciation of mercury (Hg) in coastal water of the Yellow Sea, China [J]. Marine Chemistry, 2011, 126: 250-255
[35] 张朝晖,吕吉斌,叶属峰. 桑沟湾海洋生态系统的服务价值[J]. 应用生态学报, 2007, 8(11): 2540-2547
[36] Li D J, Dag D. Ocean pollution from land-based sources: East China Sea, China [J]. A Journal of the Human Environment, 2004, 33(1): 107-113
[37] Kontas A. Mercury in the Izmir Bay: An assessment of contamination [J]. Journal of Marine Systems, 2006, 61: 67-78
[38] Leermakers M, Galletti S, Galan S D, et al. Mercury in the Southern North Sea and Scheldt Estuary [J]. Marine Chemistry, 2001, 75: 229-248
[39] 丁振华, 刘彩娥, 汤庆合, 等. 长江口及邻近海域环境污染研究的必要性—以汞污染为例[J]. 长江流域资源与环境, 14(2): 204-207
[40] 凌 敏. 冬季胶州湾海水汞的形态及大气释放研究[D]. 中国海洋大学, 2010
[41] USEPA. National Primary Drinking in Water Standards [S]. USEPA, Office of Water. Washington DC, USA.Doc. 810-F-94-00, 1999
[42] 中华人民共和国地表水环境质量标准: GB3833-2002. 中国环境出版社, 2002
[43] 李 磊, 任景玲, 刘素美, 等. 桑沟湾溶解态无机砷的分布, 季节变化及影响因素[J]. 环境科学, 2014, 35(7): 268-276
Li L, Ren J L, Liu S M, et al. Distribution, sesonal variation and influence factors of dissolved inorganic arsenic in the Sangou Bay [J]. Environmental Sciences, 2014 35(7): 268-276
[44] Bibi M H, Ahmed F, Ishiga H. Geochemical study of arsenic concentrations in groundwater of the Meghna River Delta, Bangladesh[J]. Journal of Geochemical Exploration, 2008, 97: 43-58
[45] 郭占荣, 黄 磊, 刘花台, 等. 镭同位素示踪隆教湾的海底地下水排泄[J]. 地球学报, 29(5): 647-652
[46] 山东省荣成市地方史志编纂委员会编. 荣成市志[M] . 济南: 齐鲁书社, 1999: 140
[47] Xiao Z F, Muthe J, Stromberg D, et al. Photochemical behavior of inorganic mercury compounds in aqueous solutions[J]. Mercury Pollution: Integration and Synthesis. LewisPublishers, London, 1994, 581-592
[48] Siciliano S D, O'Driscoll N J, Tordon R. Abiotic production of methylmercury by solar radiation[J]. Environmental Science & Technology, 2005, 39: 1071-1077
[49] Balcom P H, Hammerschmidt C R, Fitzgerald W F, et al. Seasonal distributions and cycling of mercury and methylmercury in the waters of New York/New Jersey Harbor Estuary [J]. Marine Chemistry, 2008, 109: 1-17
[50] Feng X B, Wang S F, Qiu G L, et al. Total gaseous mercury exchange between water and air during cloudy weather conditions over Hongfeng Reservoir, Guizhou, China [J]. Journal of Geophysical Research, 2008, 113-125
[51] Ci Z J, Zhang X S, Wang Z W, et al. Distribution and air-sea exchange of mercury (Hg) in the Yellow Sea [J]. Atmospheric Chemistry and Physics, 2011, 11: 2881-2892
[52] Costa M, Liss P S. Photoreduction and evolution of mercury from seawater[J]. Science Total Environment,2000, 261(1-3): 125-135
[53] Monperrus M, Tessier E, Amouroux D, et al. Mercury methylation, demethylation and reduction rates in coastal and marine surface waters of the Mediterranean Sea [J]. Marine Chemistry,2007, 107(1): 49-63
[54] Vasconcelos M T S D, Leal M F C. Seasonal variability in the kinetics of Cu, Pb, Cd and Hg accumulation by macroalgae [J]. Marine Chemistry, 2001, 74: 65-85
[55] 刘永懋, 翟平阳. 甲基汞在水生生物体内富集倍数的研究[J]. 水资源保护, 1996, 3: 1-9
[56] 王晓丽. 桑沟湾养殖水域颗粒态有机物迁移转化过程的研究[D]. 中国海洋大学, 2004, 46-47
[57] BloomN S, Gill G A, Cappellino S, et al. Speciation and cycling of mercury in Lavaca Bay, Texas, sediments [J]. Environmental Science and Technology, 1999, 33(1): 7-13
[58] Choe K Y, Gill G A, Lehman R D, et al. Sediment water exchange of total mercury and Monomethyl mercury in the San Francisco Bay Delta [J]. Limnology and Oceanography, 2004, 49(5): 1512-1527
[59] Stoichev T, Amouroux D, Wasserman J C, et al. Dynamics of mercury species in surface sediments of a macrotidal estuarine coastal system (Adour River, Bay of Biscay) [J]. Estuarine, Coastal and Shelf Science, 2004, 59: 511-521
[60] Gagnon C, Pelletier E, Mucci A, et al. Diagenetic behavior of methylmercury in organic-rich coastal sediments [J]. Limnology and Oceanography, 1996, 41(3): 428-434
◆
BiogeochemicalBehaviorofDissolvedMercuryintheSanggouBay
Li Lei1, Ren Jingling1,*, Liu Sumei1, Qiao Xudong2, Jiang Zengjie3, Du Jinzhou4, Fang Jianguang3
1. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao 266100, China 2. State Key Laboratory of Satellite Ocean Environment Dynamics, Second Institute of Oceanography, State Oceanic Administration, Hangzhou 310012, China 3. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China 4. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China
14 May 2014accepted11 June 2014
Mercury, a toxic heavy metal can be strongly bioaccumulated by the phytoplankton and passed up the food web in the sea, and finally be harmful to human beings. Four cruises were carried out in April, August, October 2011 and January 2012 in the Sanggou Bay. The concentrations of dissolved inorganic mercury (DIHg) and dissolved organic mercury (DOHg) were measured by Cold Vapor-Atomic Fluorescence Spectrophotometry (CV-AFS). The concentrations of DIHg were 52-865 pmol·L-1in April, 131-359 pmol·L-1in August, 31-134 pmol·L-1in October and 22-119 pmol·L-1in January. The concentrations of DOHg ranged from 37 to 214 pmol·L-1, 52 to 635 pmol·L-1, 21 to 98 pmol·L-1and less than detection limit to 51 pmol·L-1during four cruises, respectively. The concentrations of DIHg and DOHg both decreased seaward, and had significant seasonal variations. The negative relationship between the daily concentrations of DIHg or DOHg and tide could be observed at anchor stations, and showed obvious changes bet ween day and night. Riverine input, groundwater input, wet and dry atmospheric deposition, incursion of Yellow Sea, exchange of active gaseous mercury (Hg0) at air-sea interface, photochemical reduction in surface waters and bioaccumulation were the main factors affecting the distributions of DIHg and DOHg in the Sanggou Bay. The residence time of TDHg was estimated to be (1.27±0.53)a in the Sanggou Bay, which was much shorter than that in the open ocean. According to the National Primary Drinking in Water Standards from US Environmental Protection Agency and Environmental Quality Standards for Surface Water of China, there is no obvious anthropogenic mercury pollution in the Sanggou Bay. However, the enrichment of mercury by cultivated species may lead to potential ecological crisis and food safety problems, and need to be paid more attentions to ensure the sustainable development of aquaculture in the Sanggou Bay.
dissolved mercury; species; distribution; seasonal variation; Sanggou Bay
国家重点基础研究发展规划(973)项目(2011CB409801);国家自然科学基金项目(41176096);科技部国际科技合作项目(2010DFA24590)
李 磊(1989-),男,硕士,主要研究方向痕量元素的海洋生物地球化学,E-mail: lilei890115@126.com
*通讯作者(Corresponding author), E-mail: renjingl@ouc.edu.cn
10.7524/AJE.1673-5897-20140514006
2014-05-14录用日期:2014-06-11
1673-5897(2014)5-888-13
: X171.5
: A
任景玲(1973—),女,博士,主要研究方向痕量元素的海洋生物地球化学。
李 磊, 任景玲, 刘素美,等. 桑沟湾溶解态汞的生物地球化学行为[J]. 生态毒理学报,2014, 9(5): 888-900
Li L, Ren J L, Liu S M. Biogeochemical behavior of dissolved mercury in the Sanggou Bay [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 888-900 (in Chinese)

