氯化汞对鲤幼鱼鳃组织抗氧化系统和组织损伤研究
姜会民
山东高校十二五规划重点实验室“动物生理与生化及应用”重点实验室,菏泽 274015
氯化汞对鲤幼鱼鳃组织抗氧化系统和组织损伤研究
姜会民*
山东高校十二五规划重点实验室“动物生理与生化及应用”重点实验室,菏泽 274015
在急性毒性试验的基础上,设定0.052 mg·L-1(SL)、0.13 mg·L-1(SM)、0.26 mg·L-1(SH)三个汞离子染毒浓度和一个对照组(SC)研究无机汞污染对黄河鲤幼鱼鳃组织过氧化物酶(POD)活性和(丙二醛)MDA含量以及鳃组织损伤的影响。实验结果显示:POD活性随氯化汞浓度的增加先上升后下降,当浓度为0.26 mg·L-1时POD活性显著的低于对照组(p < 0.05);实验组MDA含量均显著高于对照组(p < 0.05);实验组鳃组织可见鳃小片肿胀,基部增生,上皮细胞脱落,泌氯细胞增多,细胞核溶解及金属沉积。试验结果表明氯化汞对鲤鳃组织结构和抗氧化系统具有明显的损伤。
氯化汞;鳃;过氧化物酶;丙二醛;组织损伤
汞( mercury Hg)是一种广泛分布于环境中的剧毒金属, 随着含汞农药在农业生产过程的使用,以及冶金、印染、木材防腐等含汞废水在工业生产中大量排放,造成了水环境中汞污染问题日益严峻[1]。特别是日本水俣病出现后,汞污染成为重金属污染物中的研究重点[2]。已有的研究结果表明[3],水体中Hg2+的毒性及危害作用表现在水体中的Hg2+通过鱼类等水生生物富集并在体内积累,进而随食物链传递的生物放大作用,最后在人体内积累,对人体产生毒性作用。其毒性机理表现为:Hg2+与体内许多重要酶的活性中心巯基结合而抑制一系列含巯基的酶的生理功能,从而影响细胞的正常代谢功能[4]。Canli 研究发现[5],鳃是挪威龙虾从水体吸收并蓄积汞的主要器官;我们课题组实验结果证明[6],水体高浓度的Hg2+能够对蟹鳃的组织结构造成明显的破坏;蔺玉华报道[7],甲基汞200 μg·L-1染毒24 h和80 μg·L-1染毒1周后鲤鱼鳃丝严重卷曲,氯细胞损伤明显。鲤鱼(Cyprinus carpio)是原产于亚洲的温带性淡水鱼,养殖广泛,便于实验室内饲养管理。张毓琪研究得出[8],无机汞可影响鲤鱼体组织中元素含量的变化,彭德姣研究结论[9],无机汞主要富集于鲤鱼内脏,其次是肌肉。目前尚无无机汞对鲤鳃组织抗氧化功能和组织损伤的报道。本研究在急性毒性试验的基础上进行慢性染毒的试验,研究不同浓度下的汞对鲤鳃组织结构损伤和抗氧化系统的影响。
1 材料与方法(Materials and methods)
1.1 试验动物
黄河鲤幼鱼(以下简称鲤鱼) (80.70±10.90) g,体长(15.5±2.5) cm,由菏泽辛集鱼苗养殖场提供。
1.2 主要药品与仪器
药品:分析纯氯化汞(HgCl2·2H2O);苏木精;伊红;MDA,POD检测试剂盒(南京建成生物工程研究所)。
仪器设备:电脑生物组织包埋机(KD-BM);包埋机冷冻台(KD-BL);自动脱水机(KD-TS3A)组织切片机;显微镜(Olympus);成像系统(DP72);染色缸;自动组织染色机(AO-820);电热鼓风干燥箱(CS101-2AB);电热恒温槽(S.H.W21-CR420);台式高速冰冻离心机(Eppendof);TU-1810紫外可见分光光度计(北京普西);玻璃匀浆器;电热恒温水浴锅;灭菌器。
1.3 试验设计
将鲤鱼在实验室玻璃水族箱(200 cm×60 cm×100 cm)驯养10 d后进行染毒试验,试验前先配置母液,后稀释至试验所需要的各级浓度。急性毒性试验的容器为PVC材料,实验根据前期预实验结果确定氯化汞质量浓度范围( 96 h后全致死浓度和全存活浓度),设置汞间隔浓度共5个浓度组和一个对照组,每个浓度组设2个平行,每一实验容器内各放入15条鱼开展急性毒性实验。试验室温为20 ℃,溶解氧为6~8 ppm,pH值6.5~8.5。分别用对应浓度的溶液浸洗实验容器,观测受试鲤鱼的活动情况,及时取出死亡个体,每24小时重新配置溶液。LC50的获取采用修瑞琴等[10]的方法求得为0.52 mg·L-1。
本试验在急性毒性试验的结果基础上设定四个水平。对照组(SC)试验水体中不添加氯化汞;低浓度试验组(SL)氯化汞浓度为0.052 mg·L-1( LC50/10);中浓度试验组(SM)氯化汞的浓度为的 0.13 mg·L-1( LC50/4);高浓度试验组(SH)氯化汞的浓度为0.26 mg·L-1(LC50/2)。染毒期为30 d,染毒期间室内温度、水体溶解氧、pH值同上。
1.4 MDA含量和POD活性测定
试验的1 d、3 d、7 d各组随机选取三条鱼在冰盘上解剖,取鲤鱼左侧腮,称取组织重量,并按重量(g)/体积(v)=1:9的比例加入生理盐水,冰水浴条件下机械匀浆,4 000 r·min-1离心10 min,取上清液进行过氧化物酶(POD)酶活力、丙二醛(MDA)含量和蛋白质含量测定。操作方法和单位的定义见南京建成生物工程研究所试剂盒操作说明。
1.5 组织学切片
取右侧鳃,Bouin氏固定液固定、常规梯度酒精脱水、石蜡包埋,切片厚 6 μm,H.E 染色。
1.6 数据的整理与统计分析
用SPSS软件对各处理组酶活性和MDA含量进行(One-way ANOVA)方差分析,显著性检验采用最小显著差数法(LSD)。
2 结果(Results)
2.1 氯化汞对于鲤鱼的急性毒性观察
在急性毒性试验期间,观察鲤鱼中毒症状初期表现为“毒物兴奋效应”。可见鲤鱼对于外界刺激反映异常活跃,无刺激情况下表现为上下或者旋转方向快速运动,有时表现为侧向游动,应为神经系统受损。染毒2 h 后发现高浓度组鱼体表面皮肤上覆盖有一层白色黏液,随之在6 h后中浓度鱼体表也出现类似的反应。取出死亡鱼体解剖发现除了体表的大量白色黏液外,鳃盖外侧和眼球周围也存在大量的白色黏液。同时部分鲤鱼出现了鳞片脱落,躯干或者尾部弯曲等中毒症状。
2.2 氯化汞对于鲤鱼鳃组织抗氧化酶活性影响
如图1所示,随Hg2+浓度的增加,鳃POD活性出现先上升后下降的规律性变化,SL组染毒3 d时鳃POD活性为最大值389.55 U·mg-1prot,极显著高于对照组(p<0.01),随Hg2+浓度的继续增加鳃POD活性下降。1 d时SH组POD活性显著低于SC(p<0.05),SL组POD活性极显著高于SC(p<0.01); 3d时SL组POD活性极显著的高于SC(p<0.01),SM组 POD活性显著的高于SC(p<0.05);7 d时SM组POD活性显著的高于SC(p<0.05)。
如图2所示,随Hg2+浓度的增加鳃组织MDA含量出现先上升后下降的规律性变化,SM组染毒3 d时鳃MDA含量为最大值33.80 nmol·mg-1prot,随Hg2+浓度的增加时间延长鳃MDA含量下降。1 d时各组MDA含量显著高于对照组(p<0.05);3 d时SM、SH组极显著高于SC组(p<0.01),SL组显著高于SC组(p<0.05);7 d时SM组极显著高于SC组(p<0.01),SL组、SH组显著高于SC组(p<0.05)。

图1 氯化汞对鲤鳃组织POD活性的影响注:图中*表示与对照组相比差异显著;**表示与对照组相比差异极显著,以下同。Fig. 1 The effect of mercury chloride on the activity of POD in the gill tissues of carpsNote: “*” indicates significant difference compared with the control group; “* *” indicates very significant difference compared with the control group. the same as follows.
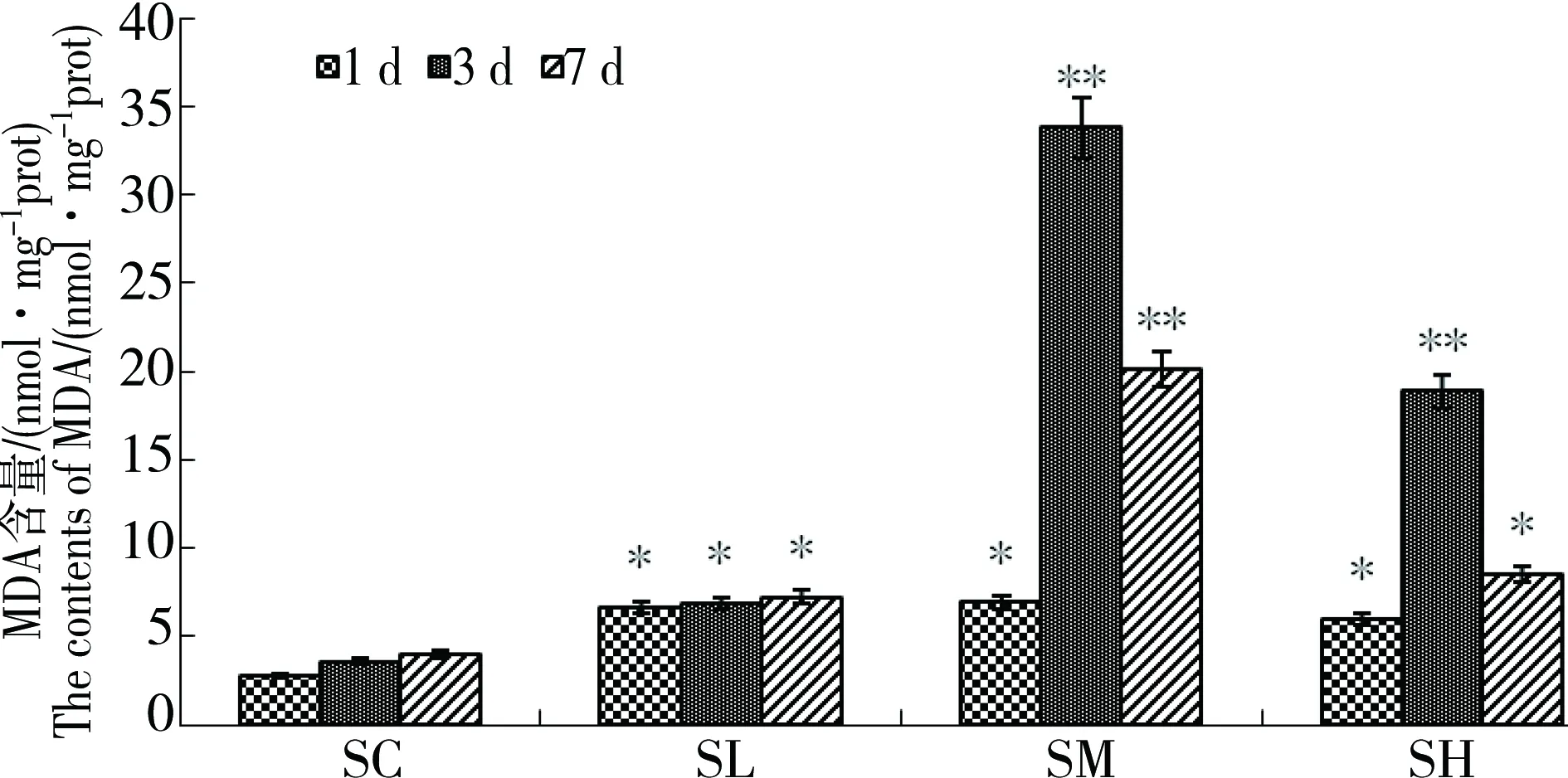
图2 氯化汞对鲤鳃组织MDA含量的影响Fig. 2 The effect of mercury chloride on the contents of MDA in the gill tissues of carps
2.3 氯化汞对于鲤鱼鳃组织损伤观察
暴露于低浓度Hg2+溶液中的鲤鱼鳃小片与对照组(图3A)相比出现肿胀增生(图3B);在中浓度组、高浓度组鲤鳃小片肿胀更加明显,相邻鳃小片黏连(图3C)。
与对照组和低浓度组(图4A)相比,中浓度及高浓度组鳃小片可见增生细胞,上皮细胞脱落(图4B);鳃小片基部泌氯细胞增多,支持细胞界限模糊,细胞核结构溶解(图4C);鳃小片金属沉积,空泡细胞数目增多(图4D)。

图3 染毒氯化汞对鲤鳃小片组织损伤整体结构的观察A SC鳃小片(H.E,×400);B SL鳃小片:BP表示基部增生(H.E,×400);C SM,SH鳃小片:LS表示鳃小片肿胀(H.E,×400)Fig. 3 Effect of mercury chloride on the overall structure of gill lamellae on carpA Gill lamellae of control(H. E, ×400);B Gill lamellae of Low concentrations(H. E, ×400);C Gill lamellae of Middle concentrations, High concentrations
对照组入鳃动脉血管血细胞染色均匀无金属色素沉积(图5A),在汞金属染毒各组可见入鳃动脉血管和管壁中金属沉积(图5B),中、高浓度组鲤鳃丝血管中也可见到金属的沉积(图5C(纵切)、5D(横切)),同时在高浓度组鳃小片基部毛细血管中也见到金属沉积(图5E)。
3 讨论(Discussion)
生物在受胁迫时会产生大量氧自由基,对机体产生毒害[11]。POD 催化过氧化氢与氢供给体之间的氧化反应[12],从而分解体内产生的部分有毒物质H2O2,使机体维持较低而有效的自由基水平[13]。研究表明,生物在轻度逆境胁迫时,POD 会升高来抵御外界刺激,在重度逆境胁迫下超过机体抵御能力,POD会降低[14]。本试验结果显示随Hg2+浓度的增加,鳃POD活性出现先上升后下降的规律性变化,表明了在低浓度条件下Hg2+刺激了鱼体内抗氧化系统,使鳃组织POD酶活性升高,而随Hg2+浓度的继续增大鳃组织POD活性下降,与焦传珍结果一致[14]。随染毒时间的延长低浓度组POD活性先升高后降低,在低浓度组3d时POD酶活性达最高值,说明时间对Hg2+在鲤机体内生理代谢有影响,Hg2+的毒性有时间累积效应,随时间的延长机体产生的过量自由基或过氧化产物致抗氧化酶变性从而降低了其活性,或者这些物质阻碍了酶的转录或者翻译的过程,或是机体中无机汞发生甲基化,使得其毒性进一步增强。

图5 染毒氯化汞对鲤鳃部血管汞沉积的观察A SC入鳃动脉(H.E,×1000); B SL、SM、SH入鳃动脉,图中MD表示金属沉积(H.E,×1000);C SH, SM鳃丝动脉,图中MD表示金属沉积(H.E,×1000纵切);D SH, SW鳃丝动脉,图中MD表示金属沉积(H.E,×1000横切);E SH鳃小片基部毛细血管,图中MD表示金属沉积(H.E,×1000)Fig. 5 The observation of mercury deposition in carp gill vessels exposed to mercuryA The artery of branchial on SC(H.E, ×1000);B The artery of branchial on SL, SH, SM(H.E, ×1000);C The arteries of gill filaments on SH, SM(Slitting)(H.E, ×1000);D The arteries of gill filaments on SH, SM (Crosscutting)(H.E, ×1000);E The capillaries of the base of Gill lamellae (H.E, ×1000)
生物膜中磷脂有多个不饱和键,因此生物膜易受自由基攻击,多不饱和脂肪酸中LH会在R的作用下启动LPO链式反应[15]。在脂质过氧化产物中,丙二醛(MDA)被认为是脂质过氧化水平的间接反映,因此,MDA的检测在水生态毒理学机制研究中越来越受到重视[16]。本试验随Hg2+浓度的增加,鳃组织MDA含量出现先上升后下降的规律性变化,当Hg2+浓度为0.13 mg·Kg-1染毒3 d时鳃MDA含量为最大值33.80 nmol·mg-1prot,随Hg2+浓度的增加和时间延长鳃MDA含量下降,提示水体Hg2+可直接影响鲤鱼体内的脂质过氧化水平从而造成机体细胞膜的氧化性损伤,表现为低浓度促进高浓度抑制。这可能是低浓度的Hg2+诱导机体POD等抗氧化酶的活性,同时与体内的大量的自由基反应,因此MDA含量增加,而高浓度的Hg2+抑制了机体内抗氧化酶活性,所以脂质过氧化反应产物MDA含量下降。中浓度染毒组鳃MDA含量最高,而此时POD活性显著下降到对照水平,可能是MDA可进一步与蛋白质形成交联物,使酶的结构和功能遭到破坏,进而降低抗氧化酶的活力[17]。因此机体内抗氧化酶的活性和其代谢物的含量相互影响。试验结果显示,染毒时间同样影响鳃组织MDA含量,3 d时各Hg2+染毒浓度组MDA含量最高,可能是鱼在初期随染毒时间延长体内汞含量不断增加,因为鱼类对水中汞的蓄积是没有低限的[18],后期随时间的继续延长蓄积的汞浓度导致其抗氧化酶的活性受到一定水平的抑制所以鳃组织MDA含量下降。
鳃为许多毒物作用的靶器官[19],关海红研究发现,重金属对松浦鲤鳃组织的损伤程度最大[20]。本研究表明,在低浓度Hg2+暴露下鳃小片出现增生,入鳃动脉出现色素沉积,说明鲤鳃组织是Hg2+毒性作用的靶器官之一。Vensna将鱼类鳃组织细胞受到毒物胁迫造成的损伤分为两类: 一是因防御而产生的损伤,包括上皮细胞肥大和增生,鳃小片呼吸上皮水肿等; 二是直接造成的损伤,包括鳃丝上皮脱落与坏死等[21]。本试验观察中浓度、高浓度组鳃小片间细胞增生,上皮细胞脱落,鳃小片基部泌氯细胞增多,支持细胞间界限模糊,细胞核结构溶解,空泡细胞数目增多,揭示Hg2+暴露不但引起了机体鳃组织的防御反应而且直接损伤了鳃组织细胞。低浓度Hg2+染毒鳃组织中仅在入鳃大动脉中见金属沉积,中浓度鳃组织中鳃丝动脉中可见金属沉积,高浓度中不仅在大动脉中可见汞金属沉积在鳃小片基部毛细血管中也有金属沉积。血管中沉积的金属可能为Hg2+结合了蛋白显示的金属颜色,鳃血管中的金属沉积颗粒较大可能阻塞毛细血管,从而引起鳃组织损伤。
致谢:论文实验、撰写和修改过程得到了菏泽学院楚德昌、朱道玉教授,张红梅副教授大量帮助,图表的制作得到了计算机系刘学老师的指导,谨此表示感谢。
[1] Liu Y Y, Shu H, Liu W. Study on enrichment of Songhua River methyl mercury in fish bodies and its affecting factors [J]. Design of Hydroelectric Power Station, 2004, 20: 63-66
[2] Tomiyasu T, Matsuyama A, Eguchi T, et al. Spatial variations of mercury in sediment of Minamata Bay Japan [J]. The Science of the Total Environment, 6, 368(1): 283-290
[3] Foestner U, Wittmann G T W. Metal Pollution in the Aquatic Environment [M]. Springer Verlag, 1979: 267-268
[4] Schroeder H A著. 微量元素与人[M]. 北京: 科学出版社, 1979
[5] Canli M, Robert W. Mercury and cadmium uptake from seawater and from food by the Norway lobster Nephrop norvegicus [J]. Environmental Toxicology and Chemistry, 1995, 14(5): 819-828
[6] 赵艳民, 王新华, 孙慧. Hg2+在中华绒螯蟹幼蟹鳃内的积累及其对组织结构的影响[J]. 动物学杂志, 2008, 43(1): 1-7
Zhao Y M, Wang X H, Sun H. Accumulation of waterborne mercury in gills of juvenile Eriocheir sinensis and its effect on gills structure [J]. Chinese Journal of Zoology, 2008, 43(1): 1-7 (in Chinese)
[7] 蔺玉华, 关海虹. 甲基汞对鲤鱼鳃组织及氯细胞的影响[J]. 水产学杂志, 2003, 16(1): 53-56
Lan Y H, Guan H H. Effect of methylmercurity chloride on gills filaments and chloride cells of common carp [J]. Chinese Journal of Fisheries, 2003, 16(1): 53-56 (in Chinese)
[8] 张毓琪, 陈叙龙, 杜式华, 等. 汞对鲤鱼(Cyprinus carpio L.)组织中某些元素含量比的影响 [J]. 环境科学学报, 1986(03): 286-291
Zhang Y Q, Chen X L, Du S H, et al. Effect of mercury accumulation on the content ratios of several elements in Carp (Cyprinus carpio L.) tissues [J]. Acta Scientiae Circumstantiae, 1986, (3): 286-291 ( in Chinese)
[9] 彭德姣, 侯娟, 陈琳. 无机汞在鲤鱼体内生物富集规律的研究[J]. 毒理学杂志, 2007, 21(4): 129-135
Peng D J, Hou J, Chen L. A study of the bioconcentration of inorganic mercury in Cyprinus carpio [J]. Journal of Health Toxicology, 2007, 21(4): 129-135 (in Chinese)
[10] 修瑞琴, 许永香, 高世荣, 等. 砷与镉、锌离子对斑马鱼的联合毒性实验[J]. 中国环境科学, 1998, 18(4): 349-352
Xiu R Q, Xu Y, Gao S R, et al. Joint toxicity test of arsenic with cadmium and zinc ions to zebrafish, brachynanio rerio [J]. China Environmental Science, 1998, 18(4): 349-352 (in Chinese)
[11] Huang W, Cao L, Ye Z J, et al. Antioxidative responses and bioaccumulation in Japanese flouder larvae and juveniles under chronic mercury exposure [J]. Comparative Biochemistry & Physiology, 2010, 152 (1): 99-106
[12] Huang W, Cao L, Liu J, et al. Short-term Mercury exposure affecting the development and antioxidant biomarkers of Japanese flounder embryos and larvae [J]. Ecotoxicology and Environmental Safety, 2010, 73(8): 1875-1883
[13] Chanee B, Maehly A C. Methods in Enzymology [M]. NewYork: Aeademie Press, 1995
[14] 焦传珍. 铈对镉染毒泥鳅肝胰脏中超氧化物歧化酶和过氧化物酶活性的影响[J]. 水产科学, 2009, 28(12): 786-788
Jiao C Z. The effect of cerium on SOD and POD activities in hepatopancreas of oriental weatherfish (Misgurnus anguillicaudatus) stressed by cadmium [J]. Fisheries Science, 2009, 28(12): 786-788 ( in Chinese)
[15] Khan H A, Abdelhalim M A K, Al-Ayed M S, et al. Effect of gold nanoparticles on glutathione and malondialdehyde levels [J]. Saudi Journal of Biological Sciences, 2012, 19(4): 461-464
[16] Orestis I, Basilios P, Panagiotis T, et al. Effect of moxifloxacin on survival, lipid peroxidation and inflammation in immunosuppressed rats with soft tissue infection caused by stenotrophomonas in liver, lung and heart of rats [J]. Saudi Journal of Biological Sciences , 2012, 19(4): 461-464
[17] Martinez Alvarez R M, Hidalgo M C, Domezain A, et al. Physiological changes of strugeon Acipenser naccarii caused by increasing environmental salinity [J]. Journal of Experimental Biology, 2002, 205: 3699-3706
[18] Allen P. Soft-tissue accumulation of lead in the blue tilapia, Oreochromis aureus(Steindachner), and the modifying effects of cadmium and mercury [J]. Biological Trace Element Research, 1995, 50(3): 193-208
[19] Boyle D, Al-Bairuty G A, Ramsden C S, et al. Subtle alterations in swimming speed distributions of rainbow trout exposed to titanium dioxide nanoparticles are associated with gill rather than brain injury [J]. Aquatic Toxicology, 2013, 126: 116-121
[20] Vensna P, Vesela K. Effects of trifluralin on carp: Biochemical and histological evaluation [J]. Ecotoxicology and Environmental Safety, 1999, 43(2): 213-221
[21] 关海红, 潘伟志, 蔺玉华, 等. 4种重金属对松浦鲤生长及组织的影响[J]. 华中农业大学学报, 2005, 24(1): 68-73
Guan H H, Pan W Z, Lin Y H, et al. The effect of four heavy metals on Cyprinus carpio Songpu carp's growth and tissues [J]. Joural of Hua Zhong Agricultural University, 2005, 24(1): 68-73 ( in Chinese)
◆
EffectofMercuryChlorideonAntioxidantSystemandInjuryinGillofCarps
Jiang Huimin
The Key Laboratory of Shandong University “the Application of Animal Physiology and Biochemistry” Heze 274015, China
26 May 2014accepted9 July 2014
Based on the acute toxicity test, three mercury exposure concentration groups (0.052 mg·L-1、0.13 mg·L-1、0.26 mg·L-1)and one control group were set to study the effect of mercury on activity of peroxidase(POD) and content of malondialdehyde (MDA) on gills as well as the injury of gill tissue. Results showed as follows: The activity of POD increased and then decreased with the concentration of mercury chloride increased, the activity of POD in SH group was significantly lower than that of the control group (p<0.05); The content of MDA in experiment group was significantly higher than that of control group (p<0.05 ); The gill lamella of carps swelled, the base of gill lamella appeared hyperplasia, epithelial cells shed, the number of vacuolated cells increased, the cells of chloride increased, and the nucleus was dissolved, the deposition of mercury was visible. The results showed that mercury chloride has a significant effect on activities of antioxidant system and tissue injury in gill of carp.
mercury chloride; gills; POD; MDA; injury
山东高校十二五规划重点实验室"动物生理与生化及应用";山东省教育厅基金项目(llLC53)
姜会民(1976-)男,硕士,讲师,研究方向:水产动物毒理;E-mail:50694731@qq.com
10.7524/AJE.1673-5897-20140526003
2014-05-26录用日期:2014-07-09
1673-5897(2014)5-998-06
: X171.5
: A
姜会超. 氯化汞对鲤幼鱼鳃组织抗氧化系统和组织损伤研究[J]. 生态毒理学报,2014, 9(5): 998-1003
Jiang H C. Effect of mercury chloride on antioxidant system and injury in gill of carps [J]. Asian Journal of Ecotoxicology, 2014, 9(5): 998-1003 (in Chinese)

