多聚腺苷二磷酸核糖聚合酶抑制剂AG014699联合化疗对三阴性乳腺癌细胞株MDA-MB-231增殖的影响
孙 颖,丁 焕,黎晓晴,黎 莉
1山东大学 齐鲁医院肿瘤中心化疗科,济南 250012
2浙江大学医学院,杭州 310058
多聚腺苷二磷酸核糖聚合酶抑制剂AG014699联合化疗对三阴性乳腺癌细胞株MDA-MB-231增殖的影响
孙 颖1,丁 焕1,黎晓晴2,黎 莉1
1山东大学 齐鲁医院肿瘤中心化疗科,济南 250012
2浙江大学医学院,杭州 310058
目的研究多聚腺苷二磷酸核糖聚合酶 (PARP)抑制剂AG014699联合多西他赛 (DTX)或卡铂 (CBP)对三阴性乳腺癌细胞株MDA-MB-231增殖的影响,探讨PARP抑制剂AG014699联合化疗是否有协同抗肿瘤效应。方法PARP抑制剂AG014699与DTX、CBP单独或联合作用于MDA-MB-231细胞,细胞增殖及细胞毒性实验法检测细胞增殖并用联合用药公式分析合用效应 (q值0.85~1.15为单纯相加,>1.15为协同,<0.85为拮抗);流式细胞仪分析细胞凋亡及周期分布。结果PARP抑制剂AG014699、DTX、CBP单独作用于MDA-MB-231细胞,均可抑制增殖,诱导凋亡,引起细胞周期阻滞;PARP抑制剂AG014699(10 μmol/L) 与DTX(10-8、10-7、10-6、10-5mol/L)、CBP(10-5、10-4mol/L) 联合作用时,q值在0.85~1.15,显示相加效应;PARP抑制剂AG014699与CBP(10-3mol/L)联合作用时,q值>1.15,显示协同效应。PARP抑制剂AG014699联合DTX或CBP能进一步促进凋亡,并使G2/M期细胞比例增加。结论PARP抑制剂AG014699联合化疗药物DTX或CBP能显著抑制MDA-MB-231细胞增殖,发挥相加或协同抗肿瘤作用。
三阴性乳腺癌;多聚腺苷二磷酸核糖聚合酶;多西他赛;卡铂
Acta Acad Med Sin,2014,36(2):135-139
三阴性乳腺癌具有恶性程度高、进展快、侵袭性强、复发和转移率高等特点[1-3]。由于其缺乏针对雌、孕激素受体的内分泌治疗及针对人表皮生长因子受体-2的靶向治疗,寻找新的治疗靶点成为三阴性乳腺癌研究的热点。多聚腺苷二磷酸核糖聚合酶 [poly(ADP-ribose)polymerases,PARP]抑制剂是DNA复制、损伤修复、细胞增殖分化调控等过程中的关键酶[4-6],尤其PARP-1在DNA单链损伤修复中发挥重要作用。根据“合成致死”理论,PARP抑制剂对伴有人类乳腺癌易感基因突变导致存在DNA双链损伤修复缺陷的三阴性乳腺癌可能发挥治疗作用[7-9]。铂类药物通过与肿瘤细胞DNA结合形成Pt-DNA复合物导致DNA链间或链内交联,DNA复制障碍,从而抑制肿瘤细胞分裂[10]。理论上与影响DNA损伤的药物PARP抑制剂联合应该显示协同抗肿瘤作用。多西他赛是作用于有丝分裂期 (M期)的周期特异性化疗药物,多项临床研究已证实以多西他赛为基础的化疗能显著延长三阴性乳腺癌患者的总生存期[11]。本研究旨在观察PARP抑制剂AG014699联合多西他赛 (docetaxel,DTX)或卡铂(carboplatin,CBP)能否进一步抑制三阴性乳腺癌细胞株MDA-MB-231的增殖,发挥协同抗肿瘤作用,以探讨PARP抑制剂联合化疗在三阴性乳腺癌治疗中的价值。
材料和方法
材料三阴性乳腺癌细胞株MDA-MB-231由生物化学与分子生物学研究所提供;PARP抑制剂AG014699、DTX、CBP均购自Sigma公司;PARP抑制剂AG014699用二甲基亚砜配制成10-3mol/L储存液,二甲基亚砜终浓度 <0.1%;DTX、CBP用磷酸缓冲液(phosphate buffer solution,PBS)分别配制成10-3mol/L、10-2mol/L储存液;1640培养基、胰酶含EDTA购自Gibco公司;胎牛血清购自Hyclone公司;细胞增殖与细胞毒性检测试剂盒 (cell counting kit,CCK)-8及周期分布凋亡试剂盒购自碧云天公司。
细胞培养三阴性乳腺癌细胞株MDA-MB-231培养于含10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的1640培养基中,在37℃、5%CO2、饱和湿度的培养箱中孵育。细胞贴壁生长,每2~3天传代1次。
CCK-8实验检测细胞增殖检测PARP抑制剂AG014699(0.1、1、10、20、40 μmol/L)、DTX(10-9、10-8、10-7、10-6、10-5mol/L)、CBP(10-6、10-5、10-4、10-3mol/L)3种药物对MDA-MB-231细胞增殖的抑制作用。将接近半数抑制浓度 (inhibitory concentration 50,IC50)的PARP抑制剂AG014699,分别与各浓度 DTX(10-9、10-8、10-7、10-6、10-5mol/L)或CBP(10-6、10-5、10-4、10-3mol/L) 联合作用于MDA-MB-231细胞。观察PARP抑制剂AG014699联合DTX或CBP对MDA-MB-231细胞增殖的抑制作用。
取对数生长期MDA-MB-231细胞,按7×103/孔接种于96孔板,隔夜细胞贴壁后,弃原培养基,替换为PARP抑制剂AG014699、DTX、CBP各浓度单药以及PARP抑制剂AG014699与不同浓度的DTX或CBP联合,作为实验组;常规加培养基1640作为对照组,培养24 h。PBS洗涤,加100 μl含10%CCK-8培养基,作用1 h后,酶标仪测各孔光密度值 (optical density,OD)。公式:细胞活力 (%)= [(实验组OD-空白组OD)/(对照组OD-空白组OD)] ×100%;抑制率 (%) =(1-细胞活力) ×100%;联合用药效果根据金氏公式[12]判断:q=E(a+b)/(Ea+Eb-Ea×Eb),其中E(a+b)为联合抑制率,Ea和Eb分别为A药和B药单用的抑制率。q值0.85~1.15为单纯相加,>1.15为协同,<0.85为拮抗。
流式细胞术检测凋亡、周期分布根据CCK-8实验结果,PARP抑制剂AG014699、DTX、CBP均选取接近IC50浓度用于流式检测。观察PARP抑制剂AG014699、DTX、CBP单药以及PARP抑制剂AG014699联合DTX或CBP对MDA-MB-231细胞凋亡及周期分布的影响。将MDA-MB-231细胞以105/孔接种于6孔板,隔夜细胞贴壁后,弃原培养基,替换为PARP抑制剂 AG014699、DTX、CBP单药以及 PARP抑制剂AG014699联合DTX或CBP,每组设3个复孔,作用24 h后收获细胞。凋亡检测:4℃预冷的PBS洗细胞2次,按照异硫氰酸荧光素细胞凋亡试剂盒说明书测定细胞凋亡。周期分布检测:与细胞凋亡检测同样方法收集PBS洗涤后细胞,加预冷70%乙醇固定,4℃过夜。加碘化丙啶,37℃避光30 min,上机检测细胞周期分布。
统计学处理 实验数据以均数±标准差表示,两两比较进行独立样本t检验,P<0.05为差异具有统计学意义。
结 果
PARP抑制剂 AG014699、DTX、CBP对 MDAMB-231细胞增殖的影响PARP抑制剂AG014699(0.1、1、10、20、40 μmol/L) 作用 24 h,MDA-MB-231细胞活力分别为 (94.83 ±3.93)%、(79.42 ±5.52)%、 (63.75 ± 4.34)%、 (38.97 ± 8.42)%、(29.70±3.35)%,PARP抑制剂AG014699与对照组比较差异均有统计学意义 (P均<0.05)(图1)。IC50=(17.77 ± 3.72) μmol/L。其中 0.1、1、10 μmol/L均小于IC50,将10 μmol/L作为与DTX、CBP联合的PARP抑制剂AG014699药物浓度。
DTX(10-9mol/L)单药或DTX(10-9mol/L)联合PARP抑制剂 AG014699(10 μmol/L) 作用 24 h,MDA-MB-231 细胞活力分别为 (81.24 ± 11.91)% 和(69.77±17.94)%,两者比较差异无统计学意义 (P>0.05),q 值 <0.85,无拮抗和促进效应;DTX(10-8、10-7、10-6、10-5mol/L) 作用24 h,MDA-MB-231细胞活力分别为 (85.74±3.10)%、 (72.74±4.66)%、(55.18 ±3.19)%、(45.95 ±3.82)%,与 PARP 抑制剂AG014699(10 μmol/L) 联合作用 24 h,MDA-MB-231细胞活力分别为 (58.34 ±2.59)%、(52.81 ±2.01)%、(41.23 ±3.38)%、(24.82 ±0.73)%,联合后细胞活力显著降低,差异具有统计学意义 (P均<0.05),q值均在0.85~1.15,显示相加效应 (图2)。DTX 10-6mol/L浓度最接近 IC50= (4.82 ±0.03) ×10-6mol/L,将10-6mol/L DTX用于凋亡周期分布检测。
CBP(10-6mol/L)单药或CBP(10-6mol/L)联合PARP抑制剂 AG014699(10 μmol/L) 作用24 h,MDA-MB-231细胞活力分别为 (90.00±6.18)%和(78.33±2.89)%,两者比较差异无统计学意义 (P>0.05),q 值 <0.85,无拮抗和促进效应;CBP(10-5、10-4mol/L)作用24 h,MDA-MB-231细胞活力分别为(87.87 ±2.30)%、(76.82 ±3.37)%,与 PARP 抑制剂 AG014699(10 μmol/L) 联合作用24 h,MDAMB-231细胞活力分别为 (60.44 ±1.95)%、(50.55 ±3.07)%,联合后细胞活力显著降低,差异具有统计学意义 (P均<0.05),q值均在0.85~1.15,显示相加效应;CBP(10-3mol/L)单药或CBP(10-3mol/L)联合PARP抑制剂AG014699(10 μmol/L) 作用24 h,MDA-MB-231细胞活力分别为 (40.71±1.68)%和(12.07±1.63)%,联合后细胞活力显著降低,差异具有统计学意义 (P<0.05),q值>1.15,显示协同效应 (图3)。CBP 10-4mol/L浓度最接近 IC50=(4.92±0.37) ×10-4mol/L,将10-4mol/L CBP 用于凋亡周期分布检测。
PARP抑制剂 AG014699、DTX、CBP对 MDAMB-231细胞周期分布的影响PARP抑制剂AG014699(1、10、20、40 μmol/L) 作用MDA-MB-231细胞24 h,G2/M期细胞比例分别为 (60.35±2.23)%、(65.46±2.24)%、(69.45 ±2.07)%、(82.71 ±2.39)%,与对照组二甲基亚砜 (21.44±2.14)%比较,G2/M期细胞比例增加,差异具有统计学意义 (P均<0.05)(图4)。
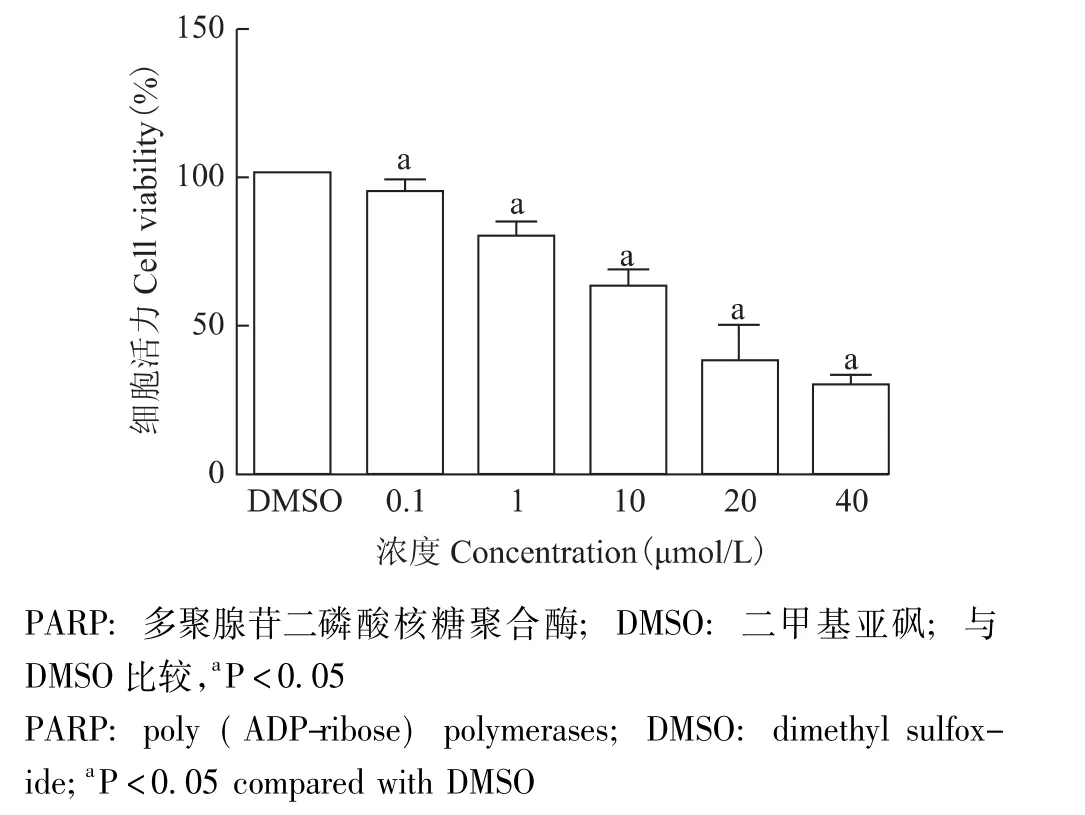
图1 PARP抑制剂AG014699对MDA-MB-231细胞增殖的影响Fig 1 Anti-tumor effects of PARP inhibitor AG014699 on MDA-MB-231 cells
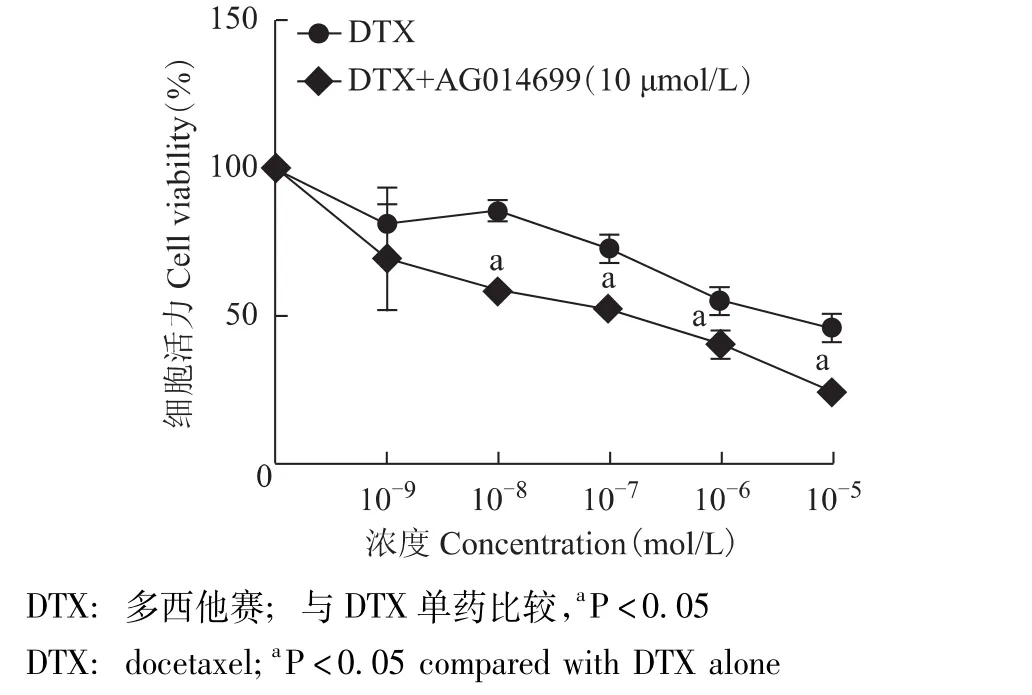
图2 DTX单药或DTX联合PARP抑制剂AG014699对MDAMB-231细胞增殖的影响Fig 2 Anti-tumor effects of DTX alone or combined with PARP inhibitor AG014699 on MDA-MB-231 cells
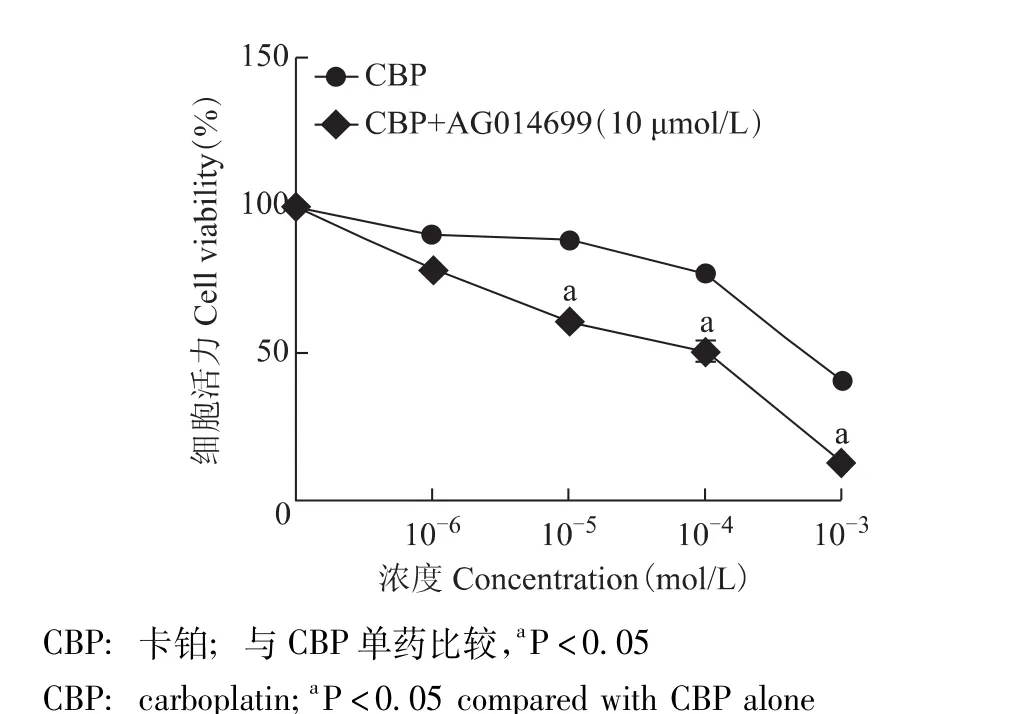
图3 CBP单药或CBP联合PARP抑制剂AG014699对MDA-MB-231细胞增殖的影响Fig 3 Anti-tumor effects of CBP alone or combined with PARP inhibitor AG014699 on MDA-MB-231 cells
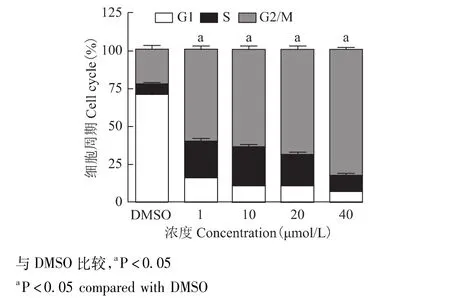
图4 PARP抑制剂AG014699对MDA-MB-231细胞周期分布的影响Fig 4 The effect of PARP inhibitors AG014699 on cell cycle distribution
DTX(10-6mol/L)作用MDA-MB-231细胞24 h,G2/M期细胞比例为 (50.93±4.22)%,联合 PARP抑制剂AG014699(10 μmol/L)后,G2/M期细胞比例为 (62.69±3.30)%,与 DTX(10-6mol/L) 单药比较,联合后G2/M期细胞比例进一步增加,差异具有统计学意义 (P<0.05)。
CBP(10-4mol/L)作用MDA-MB-231细胞24 h,G0/G1期、G2/M期细胞比例分别为 (78.85±4.21)%、(10.49 ±3.22)%; 联合 PARP 抑制剂 AG014699(10 μmol/L)后,G0/G1期、G2/M期细胞比例分别为 (43.37 ±4.37)%、 (41.19 ±5.16)%,G0/G1 期细胞比例减少,G2/M期细胞比例增加,差异具有统计学意义 (P均<0.05)。
PARP抑制剂 AG014699联合 DTX或 CBP对MDA-MB-231细胞凋亡的影响DTX(10-6mol/L)单药或DTX(10-6mol/L)联合PARP抑制剂AG014699(10 μmol/L),MDA-MB-231细胞凋亡率分别为 (19.78±3.22)%、(36.57±1.35)%,联合后细胞凋亡率提高,差异具有统计学意义 (P<0.05);CBP(10-4mol/L)单药或CBP(10-4mol/L)联合PARP抑制剂AG014699(10 μmol/L),MDA-MB-231细胞凋亡率分别为(14.89 ±1.67)%、(32.97 ±2.20)%,联合后细胞凋亡率提高,差异具有统计学意义 (P<0.05)。
讨 论
针对单一靶点的抗肿瘤治疗常疗效有限且容易产生耐药,不同作用机制的联合治疗有望获得更佳疗效[13]。铂类药物作用机制主要是与DNA上的鸟嘌呤、腺嘌呤和胞嘧啶结合形成Pt-DNA加合物,导致DNA的链间交联或链内交联,引起DNA损伤,从而导致细胞死亡。有报道鉴于PARP抑制剂是通过影响DNA损伤修复发挥抗肿瘤作用,其与影响DNA化学结构的药物 (如铂类、蒽环类)联合,应该发挥协同抗肿瘤作用[14-15]。本研究显示 PARP抑制剂 AG014699联合CBP,能明显抑制MDA-MB-231细胞增殖,产生单纯相加或协同效应,并进一步促进细胞凋亡,这与Hay等[16]研究结果一致。此外,本研究 PARP抑制剂AG014699与CBP的联合抑制增殖作用与CBP的浓度相关,当CBP浓度较低时,不显示联合功效,随着CBP浓度的增加,显示相加或协同功效,提示联合用药时需考虑化疗药物的浓度。
多西他赛属紫杉醇类药物,通过实质上“冻结”细胞内在骨架,抑制肿瘤细胞分化,最终导致细胞死亡[17-18]。本研究将PARP抑制剂AG014699与非DNA损伤药物DTX联合,MDA-MB-231细胞增殖受到明显抑制,产生相加效应,同时可以进一步促进凋亡,使细胞阻滞于G2/M期,这提示PARP抑制剂AG014699联合DTX有可能是治疗三阴性乳腺癌的有效措施。PARP抑制剂AG014699与DTX联合产生相加效应的机制可能与多西他赛可以降低胞内依赖于周期蛋白的激酶 (细胞周期蛋白依赖性激酶1),而细胞周期蛋白依赖性激酶1在一定程度上又可以提高PARP抑制剂AG014699对细胞的杀伤作用。针对PARP抑制剂AG014699联合DTX的良好抗肿瘤作用机制有待进一步研究。
综上,PARP抑制剂AG014699联合DTX或CBP能明显抑制三阴性乳腺癌细胞株MDA-MB-231的增殖,促进凋亡,发挥相加或协同抗肿瘤作用,为提高三阴性乳腺癌的联合治疗效果提供了新的思路。
[1]Bartsch R,Ziebermayr R,Zielinski CC,et al.Triple-negative breast cancer[J].Wien Med Wochenschr,2010,160(7-8):174-181.
[2]Dent R,Trudeau M,Pritchard KI,et al.Triple-negative breast cancer:clinical features and patterns of recurrence[J].Clin Cancer Res,2007,13(15 Pt 1):4429-4434.
[3]Haffty BG,Yang Q,Reiss M,et al.Locoregional relapse and distant metastasis in conservatively managed triple negative early-stage breast cancer[J].J Clin Oncol,2006,24(36):5652-5657.
[4]Ashworth A.A synthetic lethal therapeutic approach:poly(ADP)ribose polymerase inhibitors for the treatment of cancers deficient in DNA double-strand break repair[J].J Clin Oncol,2008,26(22):3785-3790.
[5]Kinsella TJ.Understanding DNA damage response and DNA repair pathways:applications to more targeted cancer therapeutics [J].Semin Oncol,2009,36(2):S42-S51.
[6]Rouleau M,Patel A,Hendzel MJ,et al.PARP inhibition:PARP1 and beyond [J].Nat Rev Cancer,2010,10(4):293-301.
[7]Audeh MW,Carmichael J,Penson RT,et al.Oral poly(ADP-ribose)polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer:a proof-of-concept trial[J].Lancet,2010,376(9737):245-251.
[8]Chuang HC,Kapuriya N,Kulp SK,et al.Differential antiproliferative activities of poly(ADP-ribose) polymerase(PARP)inhibitors in triple-negative breast cancer cells[J].Breast cancer Res Treat,2012,134(2):649-659.
[9]Mcauliffe PF,Meric-Bernstam F,Mills GB,et al.Deciphering the role of PI3K/Akt/mTOR pathway in breast cancer biology and pathogenesis [J].Clin Breast Cancer,2010,10(Suppl 3):S59-S65.
[10]Teo M,Karakaya E,Young CA,et al.The efficacy of induction chemotherapy with docetaxel,cisplatin and 5-fluorouracil combined with cisplatin concurrent chemoradiotherapy for locally advanced head and neck squamous cell carcinoma:a matched pair analysis[J].Clin Oncol(R Coll Radiol),2013,25(11):647-653.
[11]Liu F,Feng L,Zhang L,et al.Synthesis,characterization and antitumor evaluation of CMCS-DTX conjugates as novel delivery platform for docetaxel[J].Int J Pharm,2013,451(1/2):41-49.
[12] 戴体俊.合并用药的定量分析 [J].中国药理学通报,1998,14(5):479-480.
[13]Paez J,Sellers WR.PI3K/PTEN/AKT pathway.A critical mediator of oncogenic signaling [J].Cancer Treat Res,2003,115:145-167.
[14]Drew Y,Mulligan EA,Vong WT,et al.Therapeutic potential of poly(ADP-ribose)polymerase inhibitor AG014699 in human cancers with mutated or methylated BRCA1 or BRCA2[J].J Natl Cancer Inst,2011,103(4):334-346.
[15]Yap TA,Sandhu SK,Carden CP,et al.Poly(ADP-ribose)polymerase(PARP)inhibitors:exploiting a synthetic lethal strategy in the clinic [J].CA Cancer J Clin,2011,61(1):31-49.
[16]Hay T,Matthews JR,Pietzka L,et al.Poly(ADP-ribose)polymerase-1 inhibitor treatment combination with carboplatin[J].Cancer Res,2009,69(9):3850-3855.
[17]Chabalier C,Lamare C,Racca C,et al.BRCA1 downregulation leads to premature inactivation of spindle checkpoint and confers paclitaxel resistance [J].Cell Cycle,2006,5(9):1001-1007.
[18]Sarries C,Haura EB,Roig B,et al.Pharmacogenomic strategies for developing customized chemotherapy in non-small cell lung cancer [J].Pharmacogenomics,2002,3(6):763-780.
Effects of Poly(ADP-ribose)Polymerase Inhibitor AG014699 Combined with Chemotherapy on the Proliferation of Triple-negative Breast Cancer Cell Line MDA-MB-231
SUN Ying1,DING Huan1,LI Xiao-qing2,LI Li1
1Department of Clinical Oncology,Qilu Hospital of Shandong University,Jinan 250012,China
2Medical College,Zhejiang University,Hangzhou 310058,China
LI Li Tel:0531-82169851,E-mail:drlili5060@163.com
ObjectiveTo observe the effects of poly(ADP-ribose)polymerase(PARP)inhibitor AG014699 alone and combined with docetaxel(DTX)or carboplatin(CBP)on the proliferation of triple-negative breast cancer cell line MDA-MB-231 and to investigate whether PARP inhibitor AG014699 combined with chemotherapy could play a synergistic antitumor effect.MethodsMDA-MB-231 cells were treated by PARP inhibitor AG014699 alone or combination with DTX or CBP.Cell proliferation was measured by cell counting kit-8 assay.The combined effect was evaluated by q value less than 0.85,in the range of 0.85 and 1.15,more than 1.15,which respectively meant that the combined effect of the drugs was antagonistic,additive,and synergistic.Results Treatment with PARP inhibitor AG014699,DTX,or CBP alone inhibited the proliferation,induced apoptosis and blocked the cell cycle.The cell viability of AG014699(10 μmol/L)combined with DTX(10-8,10-7,10-6,10-5mol/L)or CBP(10-5,10-4mol/L)were lower than that of the drug used alone,and q value was between 0.85 and 1.15,suggesting the combined effect was additive.The cell viability of AG014699(10 μmol/L)combined with CBP(10-3mol/L)was lower than that of the drug used alone,and q value was more than 1.15,suggesting the combined effect was synergetic.A combination of PARP inhibitor AG014699 and DTX or CBP promoted apoptosis and increased the proportion of G2/M stage cells.Conclusion PARP inhibitor AG014699 combined with DTX or CBP can remarkably inhibit MDA-MB-231 cell proliferation,showing additive or synergistic antitumor effects.
triple-negative breast cancer;poly(ADP-ribose)polymerase;docetaxel;carboplatin
黎 莉 电话:0531-82169851,电子邮件:drlili5060@163.com
R730.53
A
1000-503X(2014)02-0135-05
10.3881/j.issn.1000-503X.2014.02.004
山东省科技发展计划 (2013GSF11839)Supported by the Shandong Province Sciences and Technology Development Projects(2013GSF11839)
2014-01-17)
·论 著·

