白介素-1β基因多态性与睡眠呼吸暂停综合征的相关性
张晶晶,李南方,姚晓光,周 玲,邵 亮,洪 静,殷 婷,孔剑琼
1新疆石河子大学医学院,新疆石河子 832000
2新疆维吾尔自治区人民医院高血压中心 新疆高血压研究所,乌鲁木齐 830001
白介素-1β基因多态性与睡眠呼吸暂停综合征的相关性
张晶晶1,李南方2,姚晓光2,周 玲2,邵 亮2,洪 静2,殷 婷2,孔剑琼2
1新疆石河子大学医学院,新疆石河子 832000
2新疆维吾尔自治区人民医院高血压中心 新疆高血压研究所,乌鲁木齐 830001
目的探讨白介素-1β(IL-1β)基因多态性与睡眠呼吸暂停综合征的关系。方法纳入2010年1至12月新疆维吾尔自治区人民医院高血压科住院且行多导睡眠监测的高血压患者850例,根据多导睡眠监测结果分为原发性高血压组 (225例)和高血压合并睡眠呼吸暂停综合症 (OSAS)组 (625例)。首先在96例重度OSAS患者中测序筛查IL-1β基因功能区的变异位点,选取代表性变异位点,应用Taqman-PCR在研究人群中进行基因型鉴定并开展病例-对照关联研究。结果在IL-1β基因的功能区共发现1个新的和5个已知的变异位点,选取3个代表性变异位点进行基因型鉴定。IL-1β基因rs1143633位点的等位基因频率在总人群及男性人群中分布差异有统计学意义 (χ2=9.258,P=0.002;χ2=5.119,P=0.024);总人群、男性人群及女性人群中rs1143633变异不同基因型组间各项睡眠呼吸监测参数差异均无统计学意义(P>0.05),但总人群及男性人群中CT基因型的呼吸暂停低通气指数值比CC、TT基因型高,而夜间最低血氧饱和度在3种基因型间 (CC>CT>TT)有逐渐增高趋势。总人群、男性人群及女性人群中两组间单体型频率差异均无统计学意义(P均>0.05)。Logistic回归分析显示在总人群及男性人群中IL-1β基因rs1143633变异位点CT基因型是OSAS的危险因素(OR=1.574,95%CI=1.061 ~2.437,P=0.042;OR=1.887,95%CI=1.091 ~ 3.265,P=0.023)。结论IL-1β 基因rs1143633变异位点可能与睡眠呼吸暂停综合征有关。
白介素-1β;基因多态性;睡眠呼吸暂停综合征
Acta Acad Med Sin,2014,36(2):145-152
睡眠呼吸暂停综合征 (obstructive sleep apnea syndrome,OSAS)是一种具有潜在危险的常见病,它表现为夜间反复发作的上气道阻塞,伴有血氧饱和度的降低,并由此引起白天嗜睡。研究显示OSAS与心脑血管疾病的发生密切相关,是高血压、冠心病、左心衰竭及脑卒中的独立危险因素,在成年人中患病率可达2% ~4%[1]。目前研究表明OSAS由于上气道的结构与功能异常,导致睡眠过程中反复发生低氧和再氧合引起的氧化应激反应,包括诱导炎症相关易感基因的表达与炎症蛋白等生物活性物质的合成,引起体内炎症反应和炎性细胞因子水平升高[2],OSAS也被认为是一种慢性炎症性疾病。白介素-1β(interleukin-1β,IL-1β)是一种能激活多种免疫细胞的促炎细胞因子,在启动和维持炎症反应中发挥重要作用,可刺激其他多种细胞炎症递质的生成与释放,从而引起一系列炎症反应和组织破坏[3]。陈梅晞和田小梅[4]通过建立经典的OSAS大鼠模型证实OSAS患者夜间反复间歇性低氧可能启动机体的炎症反应,引起炎性因子IL-1β释放增加。同时有研究显示OSAS患者夜间反复出现的缺氧与复氧过程可以产生大量的氧自由基,上调炎性因子的转录因子引起IL-1、肿瘤坏死因子α水平增高[5]。OSAS患者的反复低氧、复氧类似缺血再灌注,可产生大量的活性氧簇,活性氧簇可以上调炎性因子的转录因子如核转录因子κB的表达,大量活性氧簇也直接或通过氧化低密度脂蛋白间接造成血管损伤,从而使IL-1β的释放增加[6]。有研究表明IL-1β在睡眠调节中发挥重要作用,且IL-1β与嗜睡相关[7-9]。由此可知IL-1β基因在功能上可能与OSAS相关,可能是OSAS的候选基因,本研究选取IL-1β基因进行研究,旨在探讨IL-1β基因与OSAS的相关性。
对象和方法
对象选取2010年1至12月在新疆自治区人民医院高血压科随机连续入院的高血压患者,患者或家属述及有睡眠打鼾、夜间呼吸暂停,白天阅读、看电视、静坐、开会、坐车及餐后休息 (未饮酒)等情况下出现嗜睡以及其他原因不明的唇舌发绀、甲床发绀,红细胞数量和血红蛋白水平增高,建议患者进行夜间多导睡眠监测。入选对象共896例,完成多导睡眠监测患者共850例,根据多导睡眠监测结果中呼吸暂停低通气指数 (apnea hepopnea index,AHI),625例入选为高血压合并OSAS组 (OSAS组)[男性474例、女性151例,年龄 (48±9.9)岁],225例入选为原发性高血压组 (非OSAS组)[男性149例、女性76例,年龄 (43.8±8.9)岁]。诊断标准:(1)原发性高血压的诊断参考1999年世界卫生组织指定的高血压诊断标准;(2)OSAS的诊断参考2011年修订版《阻塞性睡眠呼吸暂停低通气综合征诊治指南》,氧减饱和度指数 (oxygen desaturation index,ODI4)定义为夜间每小时血氧饱和度下降超过4%的次数;血氧饱和度低于90%累计时间比 (percentage of the total time with oxygen saturation level<90%,TS90%)定义为血氧饱和度低于90%累计时间/总睡眠时间。研究对象入选前满足以下排除标准:严重颌面部畸形、长期严重酗酒、哮喘、支气管扩张、慢性阻塞性肺疾病、甲状腺疾病、心功能衰竭、长期高原工作、近6个月内出现的急性心脑血管病、原发性醛固酮增多症、嗜铬细胞瘤、肾动脉狭窄及其他严重高血压、严重心肝肾疾病、急性感染、精神病、大面积脑梗、有上呼吸道手术史和正在进行持续正压通气治疗者,以及已经确诊的2型糖尿病或正在服用降糖药物的患者。本研究经新疆维吾尔自治区伦理委员会、自治区卫生厅及新疆维吾尔自治区人民医院批准,所有研究对象均签署知情同意书。
一般测量及生化指标检测所有受试者均测量身高、体重、腹围等,计算体重指数,体重指数=体重(kg)/身高 (m)2。并在正常饮食且禁食10 h后抽取静脉血测定高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总胆固醇、甘油三酯、空腹血糖。
多导睡眠仪监测所有受试者均在新疆维吾尔自治区人民医院高血压科睡眠监测中心接受澳大利亚生产的Compumedies E系列多导联睡眠呼吸监测分析系统进行夜间连续7 h监测。检查当天禁止服用咖啡因、镇静剂、催眠药及饮酒。同步监测脑电图、眼动图、颏肌电图、口鼻气流、鼾声、胸腹式呼吸、体位、脉搏、血氧饱和度及心电图等。数据自动存储,人工手动评分,微机回放打印结果。根据监测结果计算AHI、最低血氧饱和度 (lowest blood oxygen saturation,LSaO2)、ODI4及TS90。监测完毕平卧20 min后专人测右臂肱动脉血压2次,取平均值作为晨起血压。
DNA提取及IL-1β基因测序基因组DNA提取按照基因组DNA提取试剂盒 (美国QIAGEN/BD)说明书进行,提取的DNA-80℃保存备用。在96例无亲缘关系的重度OSAS患者 (男性84例、女性12例)中,对IL-1β基因功能区 (包括所有外显子、外显子-内含子交界区、启动子及操纵子区)进行PCR扩增后测序(ABI公司3130XL测序仪)。PCR反应体系为25 μl,包括 10 × 缓 冲 液 2.5 μl,2.5 mmol/L dNTP 2 μl,20 μmol/L上下游引物各 0.5 μl,Taq 酶 0.3 μl,50 ng DNA 模板1 μl,去离子水18.2 μl。反应条件如下:预变性95℃ 15 min;变性94℃ 45 s,退火65℃ 45 s,退火温度每个循环下降0.5℃,延伸72℃ 60 s(前12个循环);变性94℃ 45 s,退火59℃ 45 s,延伸72℃ 60 s(后30个循环);最后72℃延伸10 min。测序采用ABI公司提供说明书操作。
IL-1β代表性基因型鉴定在测序发现的变异位点中,符合以下条件的变异,选取代表性单核苷酸多态性:(1)编码区的错义突变;(2)最小等位基因频率>5%;(3)进行连锁不平衡分析时r2>0.5,认为存在连锁不平衡,存在连锁不平衡的变异仅选取1个变异; (4)选取时尽可能兼顾到每个区域。共选取3个变异位点 (rs1143627、rs1143633、rs1143634)进行基因型分型。应用TaqMan-PCR技术在大样本自然人群中进行基因型鉴定,引物及探针由美国ABI公司设计并合成。PCR反应体系:PCR混合液2.25 μl,引物 0.125 μl,DNA 1.0 μl,加去离子水至 5 μl。Taq-Man-PCR反应条件:95℃预变性10 min,43个循环(95℃变性15 s,60℃退火1 min,72℃延伸1 min),最后72℃延伸7 min。反应在TaqMan 7900实时荧光定量PCR仪上进行,应用PCR扩增仪Data Analysis软件 (ABI公司)根据荧光信号变化判定等位基因型。基因型分型检测时均设有空白对照及阳性对照,同时分型结果与测序结果进行比对来验证分型的准确性(分型读取率98%,重复一致率100%)(TaqMan-PCR基因分型探针和引物信息从网站http://myscience.appliedbiosystems.com 获得)。
统计学处理数据处理应用SPSS 17.0软件。计量资料根据是否正态分布采用均数±标准差或中位数表示,不符合正态分布的数据采用非参数检验进行分析;各组间均数的比较用t检验。用SNPAlyze Version 7.0软件包进行单体型及Hardy-Weinberg平衡检验;组间基因型频率分布均采用χ2检验;变异位点不同基因型间睡眠呼吸监测参数的比较采用非参数检验及方差分析。OSAS危险因素用Logistic回归分析。P<0.05为差异具有统计学意义。
结 果
IL-1β基因功能区测序结果96例重度OSAS患者中共发现IL-1β基因功能区有6个变异位点:启动子区1个、外显子2个、内含子3个 (表1)。5个单核苷酸多态 (single nucleotide polymorphism,SNPs)在NCBI的SNP数据库中已有记录,变异位点4896G>C为此次研究新发现。计算各变异位点的连锁不平衡关系及最小等位基因型频率。根据代表性SNP挑选原则,挑选出3个SNP(rs1143627、rs1143633、rs1143634)作为代表性SNP在大样本人群中进行基因型鉴定。
人群基本特征OSAS组和非OSAS组的低密度脂蛋白胆固醇、收缩压、舒张压差异均无统计学意义(P>0.05);OSAS组的男性比例明显高于非OSAS组(75.8%比 66.2%,P=0.005);OSAS 组的年龄、体重指数、腹围、空腹血糖、总胆固醇、甘油三酯、AHI均显著高于非OSAS组,差异具有统计学意义 (P均<0.05);然而,OSAS组高密度脂蛋白胆固醇及LSaO2则显著低于非OSAS组,差异具有统计学意义(P <0.05)(表2)。
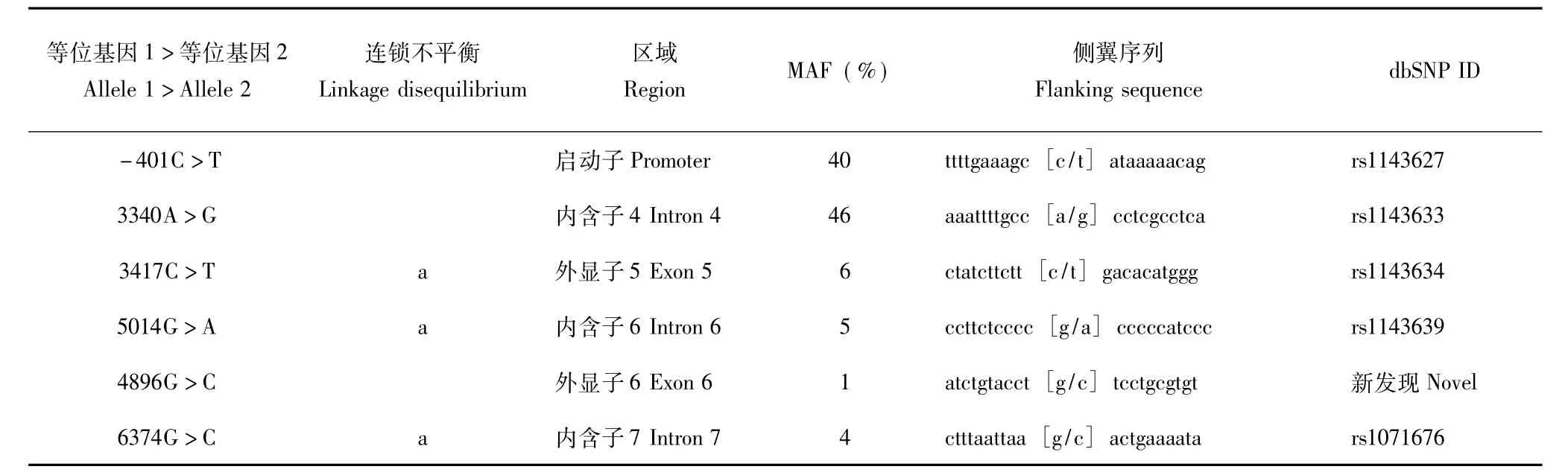
表1 96例重度OSAS患者IL-1β基因功能区测序筛查的变异位点Table 1 Sequence variations in IL-1β gene identified in 96 patients with severe OSAS
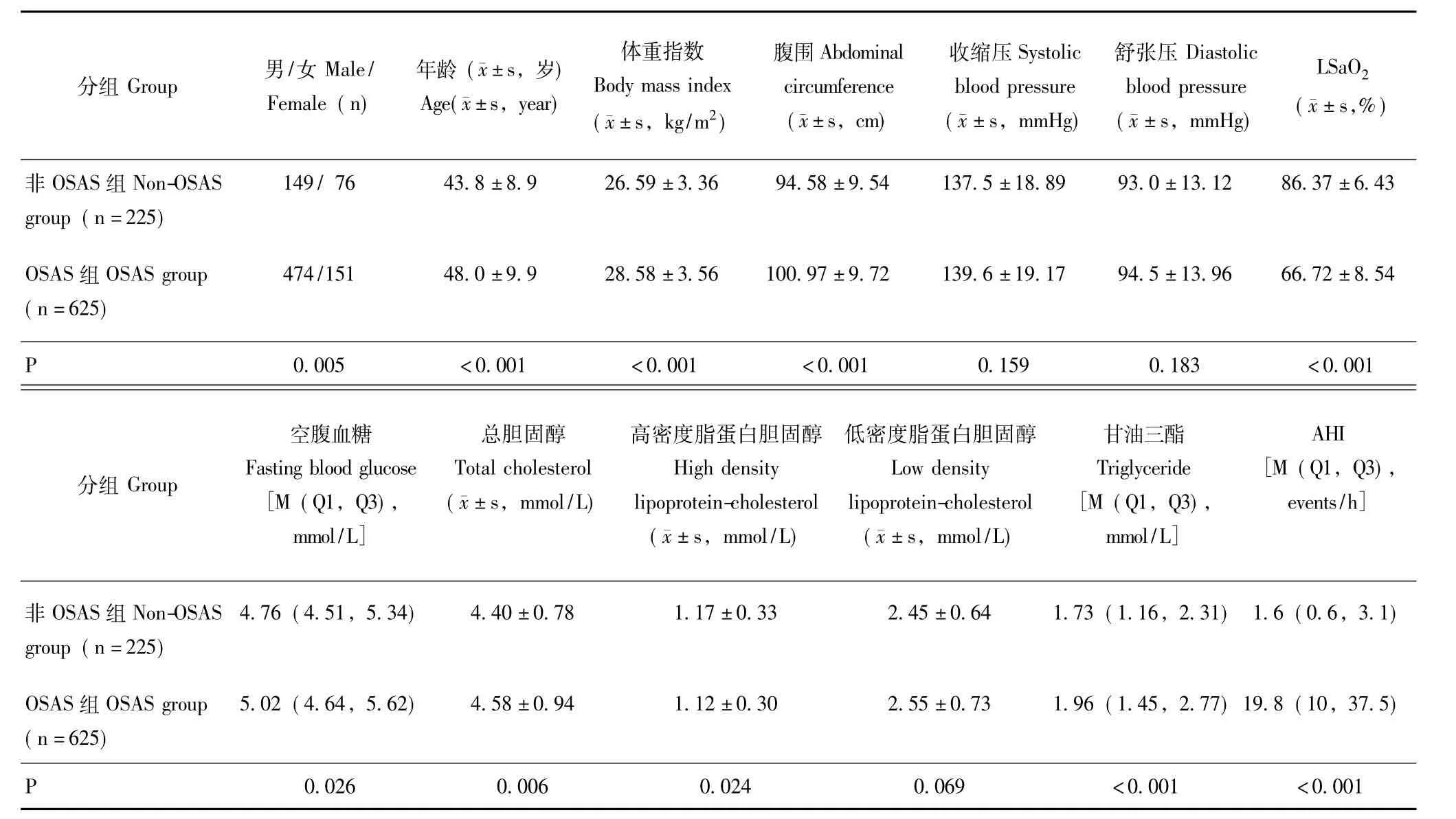
表2 两组临床资料的比较Table 2 Comparison of clinical data between two groups
IL-1β基因代表性变异基因型频率的分布 IL-1β基因的3个变异位点在各组的基因型分布符合Hardy-Weinberg平衡定律 (P>0.05)。IL-1β基因rs1143633位点的等位基因频率在总人群及男性人群中分布差异有统计学意义 (χ2=9.258,P=0.002; χ2=5.119,P=0.024);而在女性组,各位点基因型频率分布及等位基因频率分布差异无统计学意义 (P>0.05)。rs1143627、rs1143634位点在总人群、男性人群及女性人群基因型频率及等位基因频率分布在OSAS组和非OSAS组差异无统计学意义 (P>0.05)(表3)。
睡眠呼吸监测参数与IL-1β基因rs1143633变异位点不同基因型的关系总人群、男性人群及女性人群IL-1β基因rs1143633变异位点不同基因型组间AHI、LSaO2、TS90、ODI4差异均无统计学意义 (P均 >0.05),但在总人群及男性人群中观察到CT基因型的AHI值比CC、TT基因型高,而LSaO2在3种基因型间(CC>CT>TT)有逐渐增高趋势。rs11436327、rs1143634变异位点不同基因型组间睡眠呼吸监测参数差异均无统计学意义 (P均>0.05)(表4)。
IL-1β基因多态位点组成的单体型IL-1β基因3个标签SNP位点共组成6种单体型,其中5种单体型频率大于5%,这5种单体型累计频率达99.32%。总人群、男性人群及女性人群中单体型在OSAS组和非OSAS组的频率分布差异均无统计学意义 (P>0.05)(表 5)。
Logistic回归分析结果应用Logistic回归分析校正性别、年龄等混杂因素的影响,结果显示在总人群及男性人群中,IL-1β基因rs1143633变异位点与OSAS相关,并且IL-1β基因rs1143633变异CT基因型是OSAS的危险因素 (OR=1.574,95%CI=1.061 ~2.437,P=0.042;OR=1.887,95%CI=1.091 ~3.265,P=0.023),但是在女性人群中IL-1β基因rs1143633变异与OSAS无相关性 (P>0.05)。
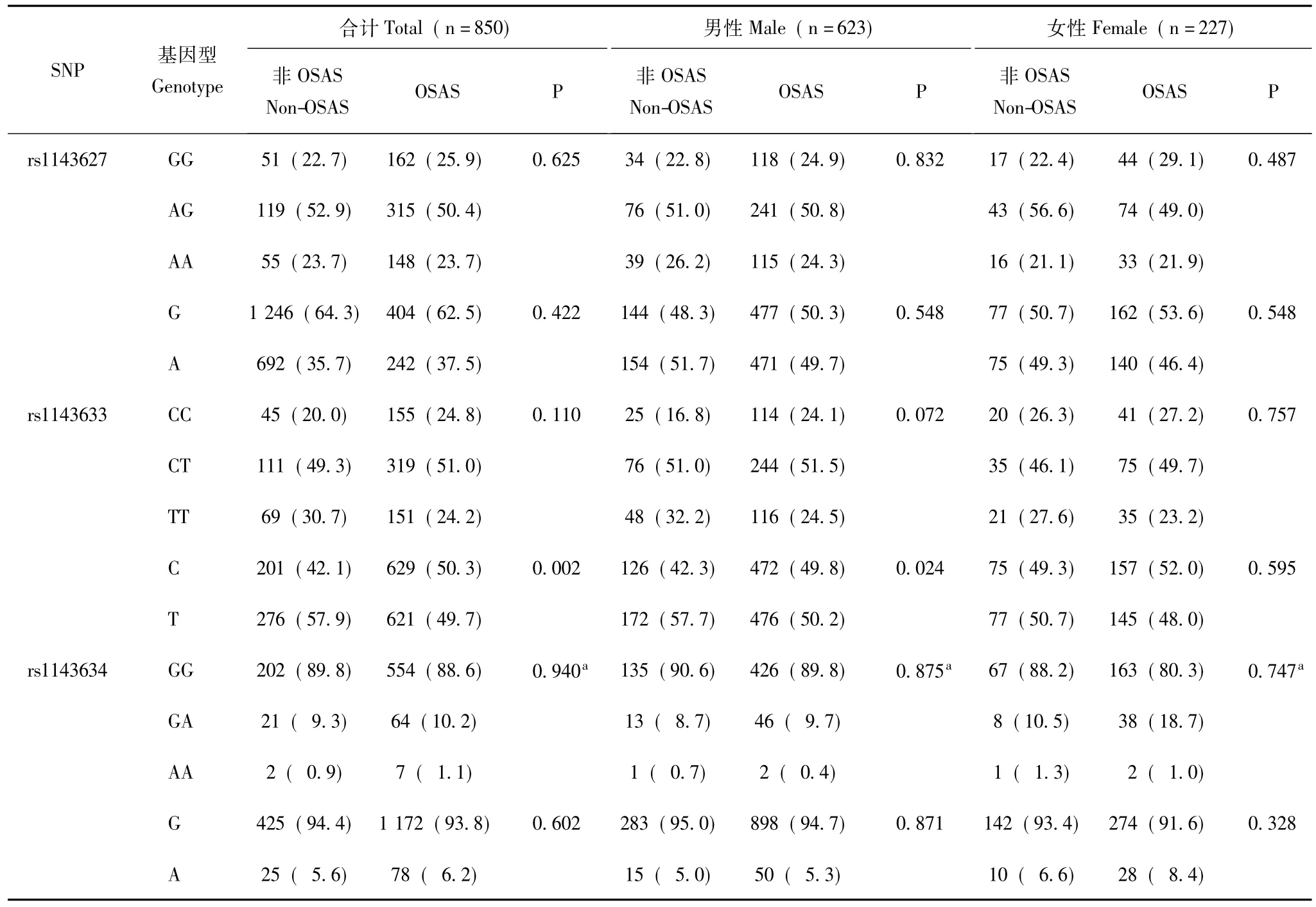
表3 IL-1β基因3个变异位点基因型频率及等位基因频率在OSAS组及非OSAS组间的分布[n(%)]Table 3 Distribution of genotypes and allele frequencies of three variations for IL-1β between OSAS and non-OSAS groups[n(%)]
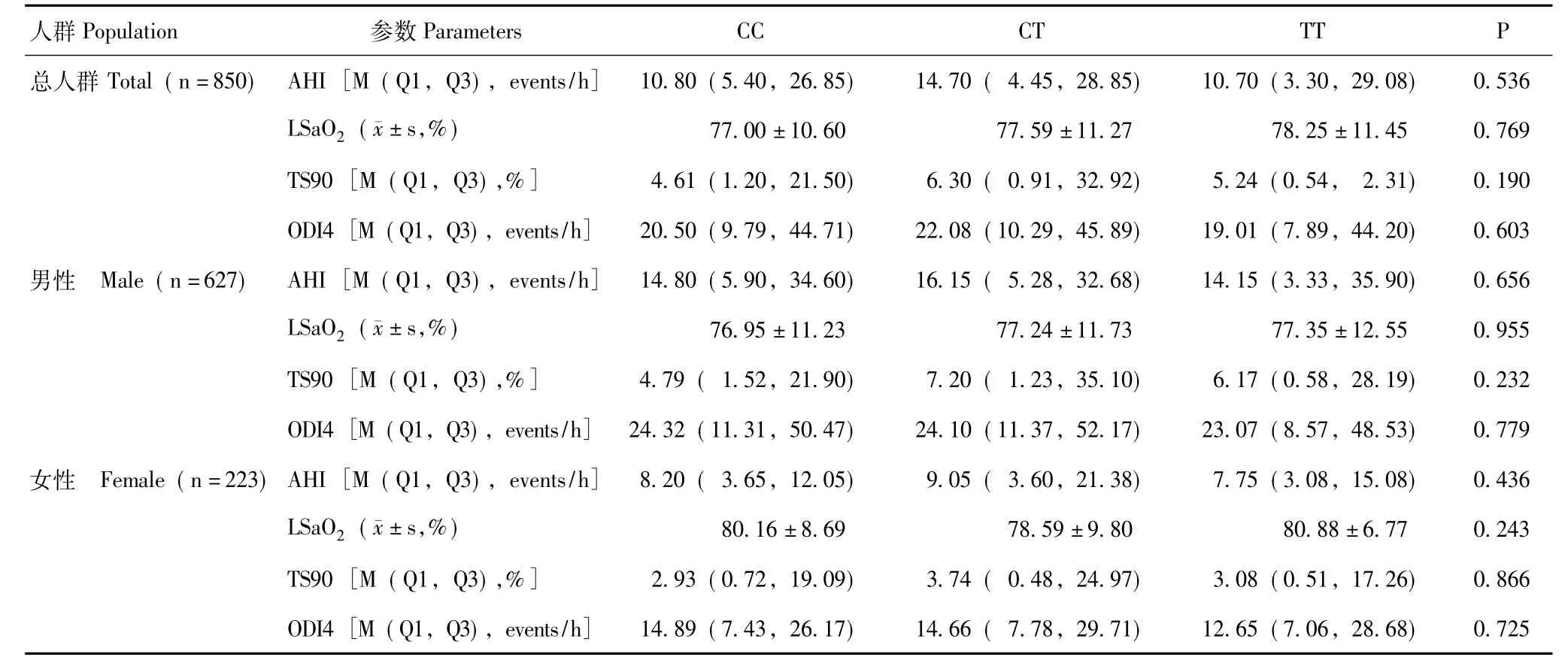
表4 IL-1β基因rs1143633变异位点不同基因型睡眠呼吸监测参数的比较Table 4 Comparison of parameters of sleep apnea monitoring among different genotypes at variations of rs1143633
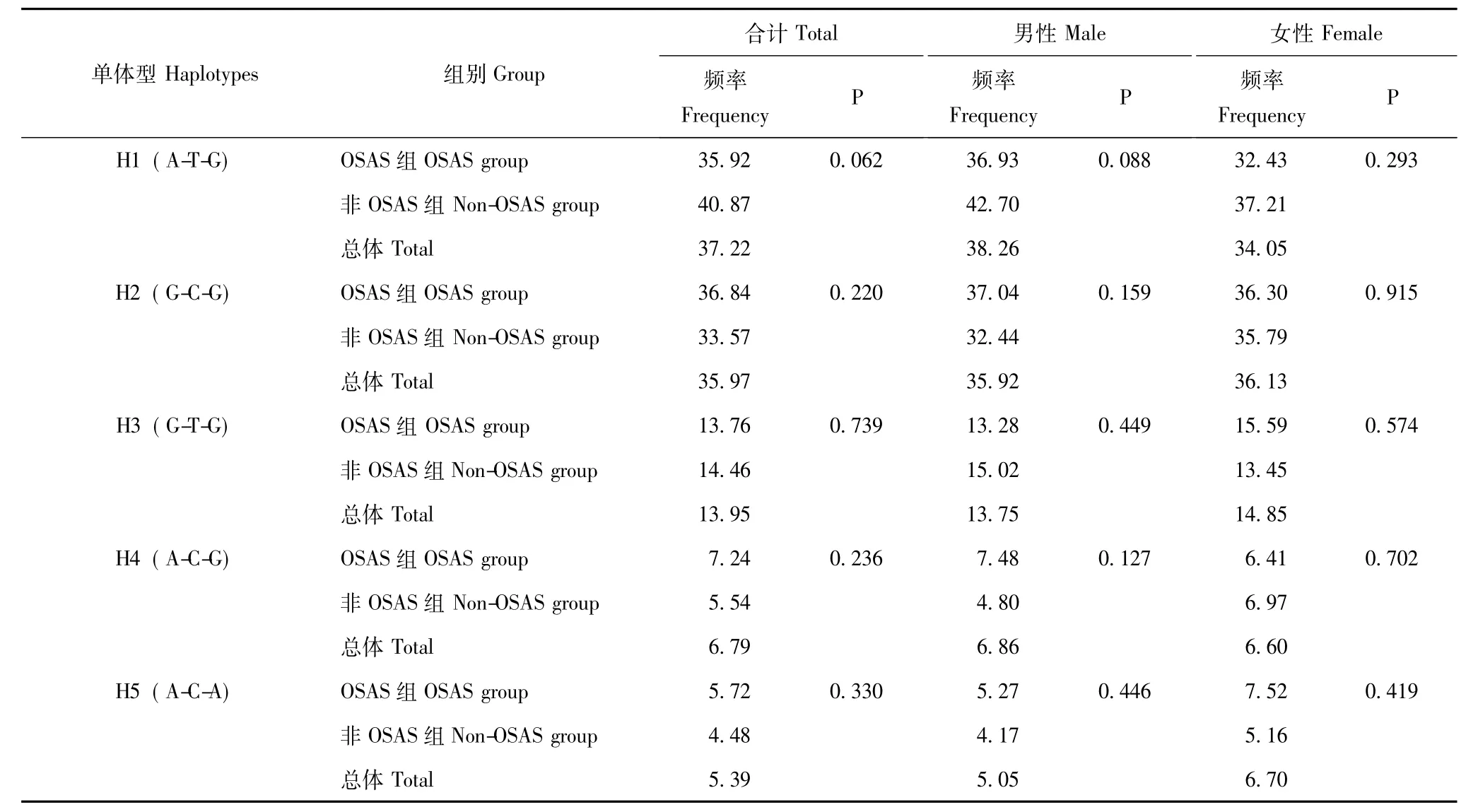
表5 两组IL-1β基因单体型频率的比较 (%)Table 5 Comparison of hyplotype frequency of IL-1β polymorphisms between two groups(%)
讨 论
睡眠呼吸暂停综合征是一种多基因多因素的复杂疾病,其发病与遗传易感性相关,当具备遗传易感性时,与环境因素相互作用导致疾病的发生。明确OSAS发病的遗传背景对于治疗和预防都有积极意义。炎症一直被认为是OSAS发病的重要因素之一,研究表明炎症因子特别是 IL-1β 与 OSAS的发生密切相关[4,6]。本研究选取3个有代表性的标签SNP进行基因型鉴定,开展病例-对照关联研究。本研究对照组采用原发性高血压患者 (AHI<5次/h),研究表明1997至2005年我国OSAS人群高血压患病率46%,是对照组的2.3倍[10],本研究对照组采用原发性高血压,在一定程度上排除了高血压对OSAS的影响。
本研究首先分析IL-1β基因3个变异位点基因型频率及等位基因频率在两组间的分布,结果显示总人群及男性人群中rs1143633变异位点等位基因频率分布在两组间差异有统计学意义,但在女性人群中差异无统计学意义。为进一步探讨IL-1β与OSAS的关系,本研究比较了rs1143633变异位点不同基因型组间睡眠呼吸监测参数 (AHI、LSaO2、TS90、ODI4),结果显示在总人群及男性人群中不同基因型间AHI、LSaO2、TS90、ODI4差异均无统计学意义,但观察到CT基因型的AHI值比CC、TT基因型高,而LSaO2在3种基因型间 (CC>CT>TT)有逐渐增高趋势,而在女性人群中无上述差异。OSAS的发生、发展可能是由遗传基因与环境因素相互作用的结果,而遗传基因又是由多种基因间相互复杂的交互作用所致,单个位点的差异对疾病的易感性只产生微弱的作用,在此基础上,本研究进一步比较两组间基因单体型的频率,分析后显示总人群、男性人群及女性人群中单体型在OSAS组和非OSAS组的频率分布差异均无统计学意义,这可能是由于rs1143634变异位点的AA基因型的频率偏低,相应的含有这两个等位基因的单体型也较少,掩盖了部分单体型对OSAS潜在的影响。为进一步探讨rs1143633变异位点与OSAS的关系,并排除年龄、性别等混杂因素的影响,应用Logistic回归将是否发生OSAS作为应变量,rs1143633变异、年龄、性别等作为自变量,分析后显示在总人群及男性人群中,IL-1β基因rs1143633变异位点与OSAS相关,并且IL-1β基因rs1143633变异CT基因型是OSAS的危险因素。通过不同角度、不同层面的分析均可以看出IL-1β基因rs1143633变异可能与OSAS相关。而目前国内外对于IL-1β基因rs1143633位点大部分集中在骨关节炎、精神分裂及不宁腿综合征等方面的研究[11-13],尚未发现rs1143633变异位点与OSAS相关。本研究在女性人群中未发现这种关联性,一方面考虑可能男性及女性不同的内分泌激素。从很多OSAS与女性更年期、睾酮水平及多囊卵巢综合征的研究中,可以看出一个相对高的孕激素/雌激素比和低睾酮可以保护女性不得 OSAS,且表明睾酮水平是 OSAS的危险因素[14-16],有研究表明OSAS在男性人群中发生比在女性人群中普遍,原因除了上述的激素外,还包括超重肥胖、上气道长短及塌陷等。而另一方面考虑可能在本研究中男性人群在总人群中占主要比例,而女性人群样本较少所致,但是也不能排除女性人群假阴性的结果,因为本研究仅是3个SNP的关联研究,不能排除IL-1β基因其他变异位点与OSAS相关的可能。在睡眠呼吸监测参数中,AHI、LSaO2、TS90、ODI4在rs1143633变异不同基因型分组中均无统计学意义,但是部分睡眠呼吸监测参数存在变化趋势,故考虑可能由于样本量较少造成的。因此,从本研究的结果可以看出IL-1β基因rs1143633变异可能与OSAS相关。
虽然本研究在质量控制、研究样本、研究方法等方面努力做到结果的可靠,但仍存在不足之处:(1)目前国际上大的研究机构与实验室所做的关联研究往往研究样本量均达到10 000例以上,本研究的样本量与之相比还有较大差距;(2)本研究仅对3个代表性SNP做了关联研究,这样会漏掉许多其他SNP与OSAS的关联信息。因此,本研究结果还有待于采用多种研究方法在大样本中进一步验证。
综上,本研究对IL-1β基因变异与OSAS的关系作了初步探讨,虽然研究结果提示IL-1β基因变异可能与OSAS相关,但仍有待于在大样本人群中进一步验证。本研究旨在为OSAS的易感基因研究提供一种参考,今后将会尽量扩大样本量,改进研究方法与实验技术,进一步探讨OSAS的分子遗传学机制。
[1]Laaban JP,Mounier L,Roque d’orbcastel O,et al.Cardiovascular risk factors in men and women with obstructive sleep apnoea syndrome [J].Respir Med,2010,104(7):1063-1068.
[2]Palmer LJ,Redline S.Genomic approaches to understanding obstructive sleep apnea [J].Respir Physiol Neurobiol,2003,135(2/3):187-205.
[3]肖敏,彭建军,张瑞良,等.促炎因子IL-1β和抑炎因子TGF-β1与急性高原反应的关联性研究 [J].西南国防医药,2013,23(3):233-235.
[4]陈梅晞,田小梅.间歇性低氧对大鼠白细胞介素-1水平的影响 [J].临床肺科杂志,2012,17(7):1176-1177.
[5]钱小顺,李天志,孙宝君,等.阻塞性睡眠呼吸暂停综合征患者炎症因子水平与合并高血压病关系的研究[J].军医进修学院学报,2009,30(3):349-350.
[6]Popko K,Gorska E,Potapinska O,et al.Frequency of distribution of inflammatory cytokines IL-1,IL-6 and TNF-alpha gene polymorphism in patients with obstructive sleep apnea[J].J Physiol Pharmacol,2008,59(Suppl 6):607-614.
[7]Opp MR,Kapas L,Toth LA.Cytokine involvement in the regulation of sleep [J].Proc Soc Exp Biol Med,1992,201(1):16-27.
[8]Moldofsky H,Lue FA,Eisen J,et al.The relationship of interleukin-1 and immune functions to sleep in humans [J].Psychosom Med,1986,48(5):309-318.
[9]Kapás L,Hong L,Cady AB,et al.Somnogenic,pyrogenic,and anorectic activities of tumor necrosis factor-alpha and TNF-alpha fragments[J].Am J Physiol,1992,263(3 Pt 2):R708-R715.
[10]李南方,王磊,周克明,等.新疆维吾尔自治区人民医院住院高血压患者病因构成特点 [J].中华心血管病杂志,2007,35(9):865-868.
[11]Solovieva S,Kämäräinen OP,Hirvonen A,et al.Association between interleukin 1 gene cluster polymorphisms and bilateral distal interphalangeal osteoarthritis [J].J Rheumatol,2009,36(9):1977-1986.
[12]Sasayama D,Hori H,Teraishi T,et al.Possible association between interleukin-1 beta gene and schizophrenio in a Japanese population [J].Behav Brain Funct,2011,7:35.
[13]Hennessy MD,Zak R,Gay CL,et al.Polymorphisms of interleukin-1 beta and interleukin-17 alpha genes are associated with restless legs syndrome [J].Biol Res Nurs,2014,16(2):143-151.
[14]Bixler EO,Vgontzas AN,Lin HM,et al.Prevalence of sleep-disordered breathing in women:effects of gender[J].Am J Respir Crit Care Med,2001,163(3 Pt 1):608-613.
[15]Shahar E,Redline S,Young T,et al.Hormone replacement therapy and sleep-disordered breathing [J].Am J Respir Crit Care Med,2003,167(9):1186-1192.
[16]Matsumoto AM,Sandblom RE,Schoene RB,et al.Testosterone replacement in hypogonadal men:effects on obstructive sleep apnoea,respiratory drives,and sleep [J].Clin Endocrinol(Oxf),1985,22(6):713-721.
Association of Interleukin-1β Genetic Polymorphisms with Obstructive Sleep Apnea Syndrome
ZHANG Jing-jing1,LI Nan-fang2,YAO Xiao-guang2,ZHOU Ling2,SHAO Liang2,HONG Jing2,YIN Ting2,KONG Jian-qiong2
1Medical School of Shihezi University of Xinjiang,Shihezi,Xinjiang 832000,China
2Hypertension Center of People’s Hospital of Xinjiang Uygur Autonomous Region,Hypertension Institute of Xinjiang,Urumqi 830001,China
LI Nan-fang Tel:0991-8564818,Fax:0991-8561831,E-mail:lnanfang2010@sina.com
ObjectiveTo investigate the association between interleukin(IL)-1β genetic polymorphisms and obstructive sleep apnea syndrome(OSAS).MethodsTotally 850 individuals with hypertension were included.All of them were checked by polysomnography in the Hypertension Center of People’s Hospital ofXinjiang Uygur Autonomous Region from January to December in 2010.According to the results of polysomnography,these subjects were divided into non-OSAS group(n=225)and OSAS group(n=625) .Genetic variations were sequenced and screened at loci over functional region of IL-1β gene in 96 patients with severe OSAS.The typical loci were selected for genotyping by TaqMan-polymerase chain reaction in 850 subjects.ResultsOne novel and 5 known variations in the IL-1β gene were identified,and then three representative mutation loci were selected for genotyping.The allele frequency distribution of rs1143633 was significantly different between the OSAS and non-OSAS groups in the total and male populations(χ2=9.258,P=0.002; χ2=5.119,P=0.024,respectively).Although the parameters of sleep apnea monitoring showed no significant difference in individuals with CC,CT,and TT genotypes of rs1143633 in total,male,and female populations(P >0.05),the median of the apnea hypopnea index of CT genotype was significantly higher than that of CC and TT in total and male populations and the mean of the lowest blood oxygen saturation increased in individuals with CC,CT,and TT genotypes of rs1143633 in total and male populations.Haplotype was no significantly associated with OSAS in total,male,and female populations(P > 0.05) .Logistic regression analysis showed that CT genotype of rs1143633 variation was a risk factor for OSAS in total and male populations(OR=1.574,95%CI=1.061-2.437,P=0.042;OR=1.887,95%CI=1.091-3.265,P=0.023) .Conclusion The rs1143633 polymorphism in IL-1β gene may be associated with OSAS.
interleukin-1β gene;genetic polymorphism;obstructive sleep apnea syndrome
李南方 电话:0991-8564818,传真:0991-8561831,电子邮件:lnanfang2010@sina.com
R34
A
1000-503X(2014)02-0145-08
10.3881/j.issn.1000-503X.2014.02.006
国家自然科学基金 (81260017)和新疆维吾尔自治区重点实验室开放性课题 (XJYS0906-2011-06)Supported by the National Natural Sciences Foundation of China(81260017)and the Open Project of Key Labotary of Xinjiang Uygur Autonomous Region(XJYS0906-2011-06)
2013-12-09)
·论 著·

