立体碳包覆钛掺杂LiFePO4的制备及高低温性能研究*
韩绍昌,陈 进,范长岭,林朝荣,张可贺
(湖南大学 材料科学与工程学院,湖南 长沙 410082)
自1997年J B Goodenough[1]小组报道以来,磷酸铁锂已经获得了广泛的关注.磷酸铁锂是一种非常有发展前景的材料,它具有比容量高、原料来源广、环境友好且无毒等优点.然而,低的电子电导率(10-9S/cm)[2]和离子迁移率(1.8×10-14cm2/s)[3]限制其在高功率领域以及低温环境下的应用.针对改善磷酸铁锂的低电子电导率及离子迁移率,人们已经做了大量的研究工作.2001年,N. Ravet[4]等人首次对LiFePO4进行碳包覆改性使其比容量及循环可逆性都有较大提升;次年,S Y Chung等[2]通过对LiFePO4进行Mg,Al,Zr等不同金属离子掺杂使LiFePO4的电子电导率提高了8个数量级.自此,掺杂与包覆作为两种不同的改性方法获得广泛的关注.在最近的研究报道中,陆晓挺[5]等采用Na作为掺杂离子,以液相-碳热还原法合成了Li0.97Na0.03FePO4,2 C倍率放电比容量为109 mAh/g;曹小卫[6]等通过不同的碳源对LiFePO4进行包覆处理,得到了优良的效果,2 C倍率放电最多可达到96.4 mAh/g;此外,J Su等[7]还通过水热法结合碳包覆技术合成了自组装的LiFePO4/C纳米微球,5 C倍率放电能超过90 mAh/g.
然而,以上的研究报道中的成果仍然存在着或多或少的不足之处:一,倍率性能依然有待提高;二,合成方法过于复杂不利于工业化生产;三,合成过程中产生污染环境的气体.本文在总结前人工作的基础上,通过选用掺杂效果优异的金属离子及立体包覆碳源对LiFePO4进行综合改性,采用简易可行的固相法合成了LiFe0.96Ti0.02PO4/C,并重点关注其倍率性能与高低温电化学性能.
1 实 验
1.1 材料制备与表征
所用试剂Li2CO3,FeC2O4·H2O,TiO2,NH4H2PO4和PVA均为分析纯,将它们按照n(Li)∶n(Fe)∶n(Ti)∶n(P)= 1∶0.96∶0.02∶1的比例加入到球磨罐中,再向其中加入一定量的经过择优筛选的碳源(最终的活性物质中碳含量控制在质量分数5%).以无水乙醇作为分散介质,高速球磨2 h后取出烘干,然后转至真空管式炉中,以高纯氩气作为保护气体,分别在350 ℃预分解5 h和650 ℃烧结18 h得到材料LiFe0.96Ti0.02PO4/C.采用同样的方法制备未经掺杂包覆的LiFePO4作为对比试样.在碳源筛选的过程中,不同碳源参照LiFe0.96Ti0.02PO4/C的热处理条件进行热解.
本实验采用Setsys Evolution 24型综合热分析仪考察PVA的热分解过程,升温速度为10 ℃/min.采用中国科学院山西煤炭化学研究所产GM-II型多功能电阻率自动测定仪与Agilent公司产34401A型6 1/2Digit 繁用表(Multimeter)相结合来测定热解碳的电子电导率.采用日本Rigaku D/max 2500VB型X射线衍射仪进行物相分析,扫描角度2θ为10~80°.采用JSM-6700F型场发射扫描电镜、JEM-3010型高分辨透射电镜和EDAX genesisxm-2型能谱仪对样品进行微观形貌表征以及微区元素分析.
1.2 电池的组装与电化学测试
将合成的材料、乙炔黑、聚偏二氟乙烯(PVDF)按照8∶1∶1的质量比进行称取,在N-甲基-2-吡咯烷酮(NMP)中混合均匀后涂在铝箔上,在120 ℃真空干燥10 h,然后用冲片机冲得所需正极片.电池的装配在充满高纯氩气的手套箱中进行,以Celgard2400多孔聚丙烯膜为隔膜,1 mol/L LiPF6/EC+DMC+EMC (体积比为1∶1∶1)为电解液,金属锂片为负极装成LIR2016型纽扣电池.采用CHI660-C电化学工作站在室温下对电池进行循环伏安(CV)和交流阻抗(EIS)测试,高低温恒流充放电测试在Arbin BT2000型电池测试系统上进行,循环伏安和恒流充放电的电位范围都为2.5~4.1 V(vs. Li/Li+).包覆于LiFePO4外的碳也算作活性物质,电流密度按1 C=170 mA/g进行计算.
2 结果与讨论
2.1 碳源的筛选
选取几种不同类型的碳源,参照LiFe0.96Ti0.02PO4/C的热处理条件进行热解,并测定其热解碳的电子电导率,所得结果如表1所示.
由表1可知,第一类碳源热解碳的电子电导率最高,但由于其在保护气氛中加热时不会裂解,因此在LiFePO4颗粒表面难以形成原位包覆.第二、第三类碳源都是碳的前驱体,加热后可以热解,其导电率明显低于第一类.第二类碳源本身为小分子有机物,虽然能达到包覆的效果,但裂解形成的碳难以成为三维的导电网络,无法进行原位立体式包覆.第三类碳源为有机高分子材料,其热解碳的电子电导率较第二类碳源热解碳的电子电导率大,同时由于热分解过程中其分子长链互相交织容易形成导电网络,因此容易实现原位立体式包覆.其中,在第三类碳源中又以聚乙烯醇(polyvinyl alcohol, 简称PVA)热解碳的电子电导率最大;另外,PVA作为包覆碳源时,不需要像酚醛树脂与环氧树脂添加固化剂加热固化,能减少烧结的时间与成本.综合比较,PVA是最佳的包覆碳源,因此,选择PVA对LiFePO4进行包覆.

表1 不同碳源热解碳的电子电导率
2.2 PVA的热分解过程
为了考察PVA在热分解过程中的立体包覆作用,本文采用综合热分析仪对PVA的热分解过程进行探究,图1为PVA的TG-DSC曲线图.

Temperature/℃
由图1可知,DSC曲线上第一个明显的吸热峰出现在154 ℃左右,与此同时TG曲线上有微小的质量下降,这是由于样品上的一些吸附水在加热时解吸与样品分离所致.当温度上升到224 ℃附近时,DSC曲线上出现第二个明显的吸热峰,而TG曲线并没有太大的质量变化,说明该阶段对应着PVA的熔融过程.随着温度升高至333 ℃时,DSC曲线上出现第三个吸热峰,并伴随着急剧失重,此时为PVA的分解过程.在该过程中,部分位置的氢和羟基结合脱除结构水,随后发生脱除H2反应,生成气态和液态的碳氢化合物[8].热分析结束后观察发现,装PVA样品用的坩埚内壁上有明显的液态物质粘附的痕迹,这也说明在PVA热解的过程中也确实形成了液态物质,因而能在LiFePO4表面进行均匀的包覆.
随着温度的升高,碳氢化合物进一步发生芳构化和芳香环的缩合、聚合[8-10].当温度上升到400~450 ℃之间,产生的液态碳氢化合物开始热解形成无定形碳,对应着413 ℃和449 ℃处的吸热峰.温度升至450 ℃以后,DSC曲线中没有明显的放热和吸热峰出现,同时TG曲线不再有明显的质量损失,说明此时PVA已转化为碳.经计算可知,残碳质量为PVA质量的5.3 %.
2.3 试样的结构与形貌分析
图2为LiFePO4与LiFe0.96Ti0.02PO4/C的XRD图谱.由图可知,两样品的特征峰都比较尖锐,表明其结晶良好.与标准LiFePO4的JCPDS卡片(PDF40-1499)对比可知,样品均为橄榄石结构,未观察到杂相,这表明掺杂的Ti4+以及PVA裂解之后形成的碳并未在磷酸铁锂中形成新的物相,也没有改变它的晶体结构.

2θ/(°)
图3(a)和(b)分别为LiFePO4,LiFe0.96Ti0.02PO4/C的SEM图.由图可知,纯LiFePO4虽然一次颗粒形貌比较规则,但是存在明显的团聚现象;相比之下,LiFe0.96Ti0.02PO4/C颗粒之间的团聚现象要轻微许多,颗粒粒径比LiFePO4小,基本上为200 nm左右,这是因为,PVA热解碳包覆于LiFePO4颗粒表面抑制了其团聚生长.
根据有关文献报道[2],高价的Ti4+能有效地提高LiFePO4的电子电导率.本文以TiO2为掺杂剂向活性材料中引入掺杂离子Ti4+,为了证实Ti4+的存在,本实验采用EDS对试样LiFe0.96Ti0.02PO4/C进行了微区元素分析.图3(c)和(d)分别为LiFe0.96Ti0.02PO4/C中Fe和Ti的EDS图谱.从图3(d)可以看出,Ti4+已经均匀地分布在LiFe0.96Ti0.02PO4/C试样中.均匀的体相离子掺杂能够使得LiFePO4和FePO4晶格中的Fe都以混合价态的形式存在,使活性材料变为非本征的p型半导体,从而极大地提高了材料的电子电导率.另外,与低价离子掺杂相比,高价离子的掺杂能促使活性材料产生更多的空位缺陷,使得锂离子在材料中的迁移更加容易,从而促进离子电导率的提高.

图3 LiFePO4 (a)的SEM图与LiFe0.96Ti0.02PO4/C的SEM图(b)及其Fe (c)和Ti (d)的EDS图
2.4 LiFePO4表面的立体碳包覆的形成
PVA在碳化分解过程中能产生低黏度液相碳氢化合物[11],它既可以很好地吸附在磷酸铁锂前驱物表面,也可以渗入颗粒间的微小间隙中.因而由此分解产生的碳可在磷酸铁锂表面或颗粒之间形成分散均匀的纳米级包覆层,这种三维立体式的均匀包覆使颗粒之间形成相互连通的网络状导电碳膜,既提高了颗粒间的导电性又抑制了颗粒的生长.图4给出了LiFePO4表面的碳包覆模型.

图4 LiFePO4表面的碳包覆模型
未经碳包覆的LiFePO4可视为模型图4(a),由于LiFePO4本身电子电导率较低(10-9S/cm),加之表面缺少导电碳层,因而颗粒之间的导电性较差.部分包覆碳的LiFePO4可视为模型图4(b),造成这种不完全包覆状态的原因主要有两点:一是包覆的碳含量不够;二是碳源本身的包覆效果不好,在材料的合成过程中未形成三维包覆.相比而言,图4(c)是一种立体包覆形态,包覆效果最好,形成的导电网络最为完善,因此能在高倍率时表现出优异的性能.本文中的PVA包覆即为该种模型,这由样品的透射电镜照片(图5)得到了证实.图5中,活性材料晶体区与无定形区有着明显的边界,晶面平行的部分易知为LiFe0.96Ti0.02PO4;另外,晶体区周围360°有一层3~4 nm厚的均匀无定形层,易知其为PVA裂解后形成的立体包覆碳层.这表明,PVA用作包覆碳源能很好地实现LiFePO4的立体包覆.

图5 立体包覆LiFePO4的透射电镜图
2.5 试样的CV及EIS分析
图6 (a)和(b)分别为LiFePO4与LiFe0.96Ti0.02PO4/C两试样的CV和EIS图谱,CV扫描速度为0.1 mV/s.

Voltage/V

Z′/Ω
从图6(a)可知,两材料的图谱曲线相似,都有一对氧化还原峰,对应着充放电过程中Fe2+/Fe3+的氧化还原反应.相比之下,LiFe0.96Ti0.02PO4/C的氧化还原峰强度更大、峰形更加尖锐,而且两峰之间的电位差仅为0.28 V,明显小于LiFePO4的0.37 V.这表明,经过包覆掺杂之后,活性材料具有更好的反应可逆性和更小的极化程度.
由图6(b)可知,两试样的图谱均由高频区的半圆和低频区的近45°直线组成.高频区的半圆由电解液与活性材料之间的界面组成的双电层电容与电荷转移电阻引起,低频区的45°直线为锂离子在活性材料中扩散所引起的Warburg阻抗.对比可知,经过掺杂包覆改性后,LiFe0.96Ti0.02PO4/C的电荷转移电阻为48.6 Ω,明显低于LiFePO4的152.0 Ω.这是因为,一方面无定形碳包覆在颗粒表面形成导电网络提升了颗粒之间的导电性;另一方面,Ti4+的掺杂使材料向非本征p型半导体转变,活性材料的能隙值降低,电子的跃迁更加容易,从而使电子电导率得到提高.
2.6 试样的高低温电化学性能
图7 (a)和(b)给出了LiFePO4与LiFe0.96Ti0.02PO4/C两试样在0.1 C倍率不同温度时的放电曲线.在各个温度点进行恒电流充放电之前,两试样的电池都在该温度点先静置12 h.
从图7中可以看出:1) 当温度从30 ℃下降到0 ℃时,两试样的放电比容量和电压平台都随之下降.这是由于,随着温度的下降,锂离子在电解液及活性材料中的迁移变得更加困难,内阻增大,极化增强.
2) 与纯LiFePO4相比,LiFe0.96Ti0.02PO4/C的比容量随温度下降衰减较轻微,电压平台下降较少.其在0 ℃时0.1 C倍率的放电比容量还能保持在128.7 mAh/g,相对于30 ℃时的158.5 mAh/g,容量保持率为81.20%,明显高于纯LiFePO4的70.66%(0 ℃时为83.8 mAh/g,30 ℃时为118.6 mAh/g).这是由于,经过掺杂与包覆改性的LiFe0.96Ti0.02PO4/C,一方面电子导电率增大;另一方面颗粒团聚现象减弱,锂离子的扩散距离缩短,离子电导率也得到提升,因此在放电过程中极化现象减弱.
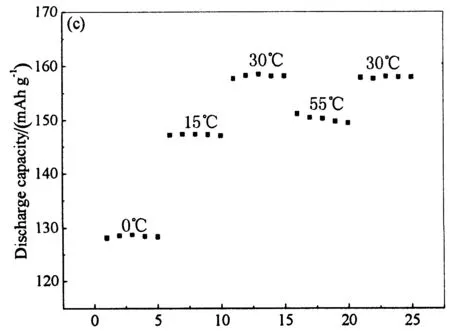
3) 在55 ℃时,两试样的放电曲线都出现了电压的波动.很显然,这种波动并非由于材料本身的结构破坏引起,因为结构的破坏将会直接导致充放电过程的不可逆使得放电比容量锐减;而由图7(c)中的循环曲线可知,经历了低温和高温的充放电过程再回到30 ℃进行充放电测试,电池的放电比容量并没有十分明显的减少,由此可以看出磷酸铁锂具有很好的高低温稳定性,这也与文献的报道相符[12-14].出现这种电压波动的原因可能是,高温时电池内部环境不能与外部进行有效的热交换,从而出现热量积累.随着热量不断的积累,电池温度逐渐升高;再由于实验所使用的电解液为普通电解液,在高温下电解液发生副反应的速率增加,导致负极表面出现不规则的锂沉积,从而产生不规则的锂枝晶.锂枝晶生长到一定程度就会刺穿隔膜,导致微短路,使得两试样的放电曲线出现电压波动和放电比容量减小的现象.

Capacity/(mAh·g-1)

Capacity/(mAh·g-1)
Cycle number
2.7 试样的倍率性能分析
图8 (a)和(b)为LiFePO4与LiFe0.96Ti0.02PO4/C在温度为30 ℃时不同倍率下的放电曲线.由图可知,经过掺杂包覆改性后,LiFe0.96Ti0.02PO4/C复合材料的倍率性能得到了较大的提升,5 C时的放电比容量仍有97.4 mAh/g,而纯LiFePO4在0.5 C时仅为58.1 mAh/g.这与前面所得实验结果一致,说明经过改性后活性材料的电子电导率与离子电导率得到了提高,从而改善了LiFe0.96Ti0.02PO4/C复合材料的倍率性能.

Capacity/(mAh·g-1)

Capacity/(mAh·g-1)
3 结 论
1) 结合对电子电导率、热分解过程以及透射电镜图片的分析,可知PVA是一种导电性优良的原位立体包覆碳源.
2) 采用高价的Ti4+作为掺杂离子以及PVA作为碳源,采用固相法合成了颗粒细小原位立体包覆均匀的LiFe0.96Ti0.02PO4/C复合材料.该复合材料在0 ℃时0.1 C的放电比容量为128.7 mAh/g,30 ℃时5 C的放电比容量还有97.4 mAh/g,表现出优良的低温性能与高倍率性能.
3) 掺杂包覆作用并没有改变LiFePO4的晶体结构,因此,无论在高温还是低温环境下,LiFe0.96Ti0.02PO4/C复合材料依然保持着与LiFePO4相同的结构稳定性.
[1]PADHI A K, NANJUNDASWAMY K S, GOODENOUGH J B. Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J]. Journal of the Electrochemical Society, 1997, 144(4): 1188-1194.
[2]CHUNG S Y, BLOKING J T, CHIANG Y M. Electronically conductive phospho-olivines as lithium storage electrodes[J]. Nature Materials, 2002, 1 (2): 123-128.
[3]PROSINI P P, LISI M, ZANE D,etal. Determination of the chemical diffusion coefficient of lithium in LiFePO4[J]. Solid State Ionics, 2002, 148 (1): 45-51.
[4]RAVET N, CHOUINARD Y, MAGNAN J F,etal. Electroactivity of natural and synthetic triphylite[J]. Journal of Power Sources, 2001, 97: 503-507.
[5]陆晓挺, 李东林, 樊小勇, 等. Na掺杂对LiFePO4/C复合正极材料的结构和倍率性能的影响[J]. 化学学报, 2012, 70(3): 223-228.
LU Xiao-ting, LI Dong-lin, FAN Xiao-yong,etal. Study on structure and rate performance of LiFePO4/C composite cathode material via Na doping [J]. Acta Chimica Sinica, 2012, 70(3): 223-228. (In Chinese)
[6]曹小卫, 张俊喜, 颜立成, 等. 用不同碳源对LiFePO4的碳包覆改性[J]. 材料研究学报, 2009, 23(4): 369-374.
CAO Xiao-wei, ZHANG Jun-xi, YAN Li-cheng,etal. On the modification of the carbon-coated LiFePO4materials by different carbon sources[J]. Chinese Journal of Materials Research, 2009, 23(4): 369-374.(In Chinese)
[7]SU J, WU X L, YANG C P,etal. Self-assembled LiFePO4/C nano/micro- spheres by using phytic acid as phosphorus source[J]. The Journal of Physical Chemistry C, 2012, 116(6): 5019-5024.
[8]SHIE J L, CHEN Y H, CHANG C Y,etal. Thermal pyrolysis of poly (vinyl alcohol) and its major products[J]. Energy & Fuels, 2002, 16(1): 109-118.
[9]MAKSIMOVA N I, KRIVORYCHKO O P. Study of thermocatalytic decomposition of polyethylene and polyvinyl alcohol in the presence of an unsteady-state Fe-containing catalyst[J]. Chemical Engineering Science, 1999, 54(20): 4351-4357.
[10]PENG Z, KONG L X. A thermal degradation mechanism of polyvinyl alcohol/silica nanocomposites[J]. Polymer Degradation and Stability, 2007, 92(6): 1061-1071.
[11]ÖZKAL B, JIANG W, YAMAMOTO O,etal. Preparation and characterization of carbon-coated ZnO and CaO powders by pyrolysis of PVA[J]. Journal of Materials Science, 2007, 42(3): 983-988.
[12]ANDERSSON A S, THOMAS J O, KALSKA B,etal. Thermal stability of LiFePO4-based cathodes[J]. Electrochemical and Solid-State Letters, 2000, 3(2): 66-68.
[13]KOLTYPIN M, AURBACH D, NAZAR L,etal. On the stability of LiFePO4olivine cathodes under various conditions (electrolyte solutions, temperatures)[J]. Electrochemical and Solid-State Letters, 2007, 10(2): A40- A44.
[14]TAKAHASHI M, OHTSUKA H, AKUTO K,etal. Confirmation of long-term cyclability and high thermal stability of LiFePO4in prismatic lithium-ion cells[J]. Journal of the Electrochemical Society, 2005, 152(5): A899-A904.

